Hệ thống kiến thức Hóa học lớp 11 Học kì 1
Hệ thống kiến thức Hóa học lớp 11 Học kì 1 chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 11 Học kì 1. Mời các bạn cùng đón xem:
Hệ thống kiến thức Hóa học lớp 11 Học kì 1
CHƯƠNG I : SỰ ĐIỆN LI
|
SỰ ĐIỆN LI |
|
|
Khái niệm |
- Là quá trình các chất khi hòa tan trong nước (hoặc ở trạng thái nóng chảy), phân li thành các ion (ion dương hoặc âm). Các ion này có khả năng dẫn điện. - Quá trình điện li không phải là quá trình oxi hóa - khử vì không có sự cho - nhận e, mà chỉ là quá trình tách các ion từ mạng tinh thể ion thành các ion dương (cation) hoặc ion âm (anion), dưới tác dụng của các phần tử dung môi phân cực (H2O). |
|
Phân loại |
- Chất điện li : là những chất khi tan trong nước phân li thành các ion. a/ Chất điện li mạnh : là các chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion. Bao gồm : các axit mạnh như HCl, H2SO4, HNO3, HClO3, HClO4, HI, HBr,… Các bazơ mạnh như KOH, NaOH, Ba(OH)2,… và hầu hết các muối. b/ Chất điện li yếu : là các chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch. Bao gồm : các axit yếu như HF, H2SO3, H2S, HClO, HNO2, H3PO4, CH3COOH, HCOOH,… Các bazơ yếu như Bi(OH)3, Mg(OH)2, NH3, các amin,… Một số muối của thủy ngân HgCl2, Hg(CN)2,… c/ Chất không điện li : là những chất khi tan vào nước hoàn toàn không phân li thành ion. Ví dụ : saccarozơ C12H22O11 , ancol etylic C2H5OH , glixerol C3H5(OH)3 ,… |
|
Cách biểu diễn |
- Trong phương trình của chất điện li mạnh, dùng mũi tên 1 chiều : KOH → K+ + OH- ; Na2SO4 → 2Na+ + SO42- … - Trong phương trình của điện li yếu, dùng mũi tên 2 chiều : CH3COOH CH3COO- + H+ ; H2S HS- + H+ … |
|
Axit |
1. Định nghĩa : Theo thuyết Arenius, axit là chất khi tan trong nước, phân li ra cation H+ . Thí dụ : HCl → H+ + Cl- ; HCOOH HCOO- + H+ Các dung dịch axit đều có một số tính chất chung, đó là tính chất của các cation H+ trong dung dịch. Từ hai thí dụ ta thấy, phân tử HCl cũng như phân tử HCOOH trong dung dịch nước chỉ phân li một nấc ra ion H+. Đó là axit một nấc. 2. Axit nhiều nấc : Những axit khi tan trong nước mà phân tử phân li nhiều nấc ra ion H+ là các axit nhiều nấc (đa axit) H3PO4 H+ + H2PO4- H2PO4- H+ + HPO42- HPO42- H+ + PO43- Phân tử H3PO4 phân li ba nấc ra ion H+ , H3PO4 là axit ba nấc. |
|
Bazơ |
Theo thuyết Arenius, bazơ là chất khi tan trong nước phân li ra ion OH- . Ví dụ : NaOH → Na+ + OH- ; Ba(OH)2 → Ba2+ + 2OH- * Hiđroxit lưỡng tính : là các hiđroxit khi tan trong nước vừa có thể phân li như axit, vừa có thể phân li như bazơ. Các hiđroxit lưỡng tính thường gặp là : Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3. Chúng đều ít tan trong nước, lực axit (khả năng phân li ra ion) và lực bazơ đều yếu. Ví dụ 1: phương trình điện li của Zn(OH)2 ↔ H2ZnO2 + Phân li kiểu bazơ : Zn(OH)2 Zn2+ + 2OH- + Phân li kiểu axit : H2ZnO2 ZnO22- + 2H+ Ví dụ 2 : phương trình điện li của Al(OH)3 ↔ HAlO2.H2O + Phân li kiểu bazơ : Al(OH)3 Al3+ + 3OH- + Phân li kiểu axit : HAlO2.H2O H+ + AlO2- + H2O |
|
Muối |
Là hợp chất khi tan trong nước, phân li ra cation kim loại (hoặc cation NH4+) và anion gốc axit. a/ Muối trung hòa : là những muối mà anion gốc axit không còn hiđro có khả năng phân li ra ion H+ : NaCl, NH4NO3, K2CO3,… hoặc anion gốc axit còn hiđro nhưng không có khả năng phân li ra ion H+ : Na2HPO3 , NaH2PO3. b/ Muối axit : là những muối mà anion gốc axit vẫn còn hiđro có khả năng phân li ra ion H+ : NaHCO3 , KHSO4, Na2HPO4,… c/ Muối hỗn tạp : là những muối trong thành phần phân tử gồm cation kim loại với nhiều anion khác nhau. Ví dụ : clorua vôi CaOCl2 có 2 gốc axit Cl – Ca – OCl. d/ Muối kép : là muối trong thành phần phân tử gồm nhiều cation kim loại, một loại ion âm. Ví dụ : kali nhôm sunfat KAl(SO4)2 (phèn chua) … |
|
Tích số ion của nước |
(ở 250C). Một cách gần đúng, có thể coi giá trị của tích số này là hằng số cả trong dd loãng của các chất khác nhau. |
|
Các giá trị [H+] và pH đặc trưng |
- Môi trường trung tính : [H+] = [OH-] = 10-7M hoặc pH = 7 - Môi trường axit : [H+] > [OH-] hay [H+] > 10-7M hoặc pH < 7 - Môi trường bazơ : [H+] < [OH-] hay [H+] < 10-7M hoặc pH > 7 |
|
Khái niệm pH và ý nghĩa thực tiễn |
- Có thể đánh giá độ axit và độ kiềm của dung dịch bằng nồng độ H+ . Nhưng dd thường có nồng độ H+ nhỏ. Để tránh ghi nồng độ H+ với số mũ âm, người ta dùng giá trị pH với quy ước sau : pH = -log[H+] . Nếu [H+] = 1,0.10-a thì pH = a. - Giá trị pH có ý nghĩa thực tế to lớn. Chẳng hạn, pH của máu người và động vật có giá trị gần như không đổi. Thực vật chỉ có thể sinh trưởng bình thường khi giá trị pH của dd trong đất ở trong khoảng xác định đặc trưng cho mỗi loại cây. Tốc độ ăn mòn kim loại trong nước tự nhiên phụ thuộc rất nhiều vào giá trị pH của nước mà kim loại tiếp xúc. |
|
Chất chỉ thị axit – bazơ |
Là chất có màu biến đổi phụ thuộc vào giá trị pH của dung dịch. + Quỳ tím : đỏ (pH ≤ 6) , tím (pH = 7) , xanh (pH ≥ 8) + Phenolphtalein : không màu (pH < 8,3), hồng (pH ≥ 8,3) (trong xút đặc, màu hồng bị mất) |
|
PHẢN ỨNG TRAO ĐỔI ION TRONG DUNG DỊCH |
|
|
- Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion. - Điều kiện : + Các chất tham gia phản ứng trao đổi ion phải là chất tan (dung dịch) , trừ 1 số trường hợp muối không tan tác dụng với axit mạnh (FeS + HCl ; CaCO3 + HNO3 ,…) + Phản ứng chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau : chất kết tủa, chất khí, chất điện li yếu. - Phương trình ion thu gọn cho biết bản chất của phản ứng trong dịch các chất điện li. - Trong phương trình ion thu gọn, người ta loại bỏ những ion không tham gia phản ứng, còn những chất kết tủa, điện li yếu, chất khí được giữ nguyên dưới dạng phân tử. |
|
|
1. Phản ứng tạo thành chất kết tủa |
Ví dụ 1 : Na2SO4 + BaCl2 → BaSO4 ↓ + 2NaCl - Bước 1 : viết phương trình ion đầy đủ: ta chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dạng phân tử. 2Na+ + SO42- + Ba2+ + 2Cl- → BaSO4 ↓ + 2Na+ + 2Cl- - Bước 2 : lược bỏ những ion không tham gia phản ứng:
- Bước 3 : ta được phương trình ion thu gọn : Ba2+ + SO42- → BaSO4 ↓ Ví dụ 2 : AgNO3 + HCl → AgCl ↓ + HNO3 - Bước 1 : Ag+ + NO3- + H+ + Cl- → AgCl ↓ + H+ + NO3-
- Bước 3 : Ag+ + Cl- → AgCl ↓ |
|
2. Phản ứng tạo thành chất khí |
Ví dụ 1 : 2HCl + K2CO3 → 2KCl + CO2 ↑ + H2O - Bước 1 : 2H+ + 2Cl- + 2K+ + CO32- → 2K+ + 2Cl- + CO2 ↑ + H2O
- Bước 3 : 2H+ + CO32- → CO2 ↑ + H2O Ví dụ 2 : FeS (r) + H2SO4 → FeSO4 + H2S ↑
- Bước 2 : FeS + 2H+ + SO42- → Fe2+ + SO42- + H2S ↑ - Bước 3 : FeS + 2H+ → Fe2+ + H2S ↑ |
|
3. Tạo thành chất điện li yếu |
Ví dụ 1 : HNO3 + KOH → KNO3 + H2O - Bước 1 : H+ + NO3- + K+ + OH- → K+ + NO3- + H2O
- Bước 3 : H+ + OH- → H2O Ví dụ 2 : CH3COONa + HCl → CH3COOH + NaCl - Bước 1 : CH3COO- + Na+ + H+ + Cl- → CH3COOH + Na+ + Cl-
- Bước 3 : CH3COO- + H+ → CH3COOH |
CHƯƠNG II : NITƠ - PHOTPHO
|
NITƠ (N) |
|
|
I. Vị trí, cấu hình e nguyên tử |
- Nitơ ở ô số 7, nhóm VA, chu kì 2 - Cấu hình e : 1s22s22p3. - Ba e ở phân lớp 2p có thể tạo được ba liên kết cộng hóa trị với các nguyên tử khác. - Phân tử nitơ gồm hai nguyên tử, giữa chúng hình thành một liên kết ba. - CTCT phân tử N2 là : N≡N |
|
II. Tính chất vật lí và trạng thái tự nhiên |
- Điều kiện thường, là chất khí không màu, không vị, không mùi, hơi nhẹ hơn không khí, hóa lỏng ở -1960C, rất ít tan trong nước (ở điều kiện thường, 1 lít nước hòa tan được 0,015 lít khí nitơ). Nitơ không duy trì sự cháy và sự hô hấp. - Trong tự nhiên, nitơ tồn tại ở dạng tự do và dạng hợp chất. + Ở dạng tự do, khí nitơ chiếm 78,16% thể tích không khí (≈ 4/5 thể tích không khí). Nitơ thiên nhiên là hỗn hợp của 2 đồng vị : (99,63%) và (0,37%). + Ở dạng hợp chất, nitơ có nhiều trong khoáng chất natri nitrat NaNO3 (diêm tiêu natri) |
|
III. Tính chất hóa học |
- Ở nhiệt độ thường, nitơ khá trơ về mặt hóa học (do liên kết ba trong phân tử nitơ rất bền, ở 30000C nó vẫn chưa bị phân hủy rõ rệt thành các nguyên tử). Ở nhiệt độ cao, nitơ trở nên hoạt động hơn và tác dụng được với nhiều chất. - N có các số oxi hóa : -3 , từ +1 đến +5. Khi tham gia phản ứng oxi hóa – khử, số oxi hóa của N có thể tăng hoặc giảm, do đó nó thể hiện tính khử hoặc là tính oxi hóa. Tuy nhiên, tính oxi hóa vẫn là tính chất chủ yếu. 1. Tính oxi hóa : Trong các hợp chất cộng hóa trị của nitơ với những nguyên tố có độ âm điện nhỏ hơn (như hiđro, kim loại,…), nguyên tố nitơ có số oxi hóa -3. a/ Tác dụng với kim loại : - Ở nhiệt độ thường, nitơ chỉ tác dụng với kim loại liti, tạo thành liti nitrua: 6Li + N2 → 2Li3N - Ở nhiệt độ cao, nitơ tác dụng được với một số kim loại hoạt động như Mg, Ca, Al,… tạo thành nitrua kim loại. 2Ca + N2 Ca3N2 (canxi nitrua) 2Al + N2 2AlN (nhôm nitrua) b/ Tác dụng với hiđro : N2 + 3H2 2NH3 2. Tính khử : Trong các hợp chất cộng hóa trị của nitơ với những nguyên tố có độ âm điện lớn hơn (như oxi,flo), nguyên tố nitơ có số oxi hóa dương, có thể từ +1 đến +5. N2 + O2 2NO Trong thiên nhiên, khí NO được tạo thành khi có sấm sét. Ở điều kiện thường, khí NO không màu kết hợp ngay với khí oxi của không khí tạo ra khi nitơ đioxit NO2 màu nâu đỏ : 2NO + O2 → 2NO2 Ngoài các oxit trên, các oxit khác của nitơ như N2O, N2O3, N2O5, chúng không điều chế trực tiếp bằng phản ứng giữa nitơ và oxi. |
|
IV. Ứng dụng |
- Nguyên tố nitơ là một trong những thành phần dinh dưỡng chính của thực vật. - Trong công nghiệp, phần lớn lượng khí nitơ sản xuất ra được dùng để tổng hợp khí amoniac, từ đó sản xuất ra axit nitric, phân đạm,… - Nhiều ngành công nghiệp như luyện kim, thực phẩm, điện tử,… sử dụng nitơ làm môi trường trơ. Nitơ lỏng được dùng để bảo quản máu và các mẫu vật khác. |
|
V. Điều chế |
1. Trong công nghiệp : phương pháp chưng cất phân đoạn không khí lỏng. 2. Trong phòng thí nghiệm : - Một lượng nhỏ nitơ tinh khiết được điều chế bằng cách đun nóng nhẹ dung dịch bão hào muối amoni nitrit : NH4NO2 N2 + 2H2O - Muối này kém bền, có thể thay thế bằng dung dịch bão hòa của amoni clorua và natri nitrit : NH4Cl + NaNO2 N2 + NaCl + 2H2O |
|
AMONIAC (NH3) |
|
|
I. Cấu tạo phân tử |
|
|
II. Tính chất vật lí |
Là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí, tan rất nhiều trong nước (ở điều kiện thường, 1 lít nước hòa tan được khoảng 800 lít khí amoniac) |
|
III. Tính chất hóa học |
1. Tính bazơ yếu : a. Tác dụng với nước : Khi tan trong nước, NH3 kết hợp với ion H+ của nước, tạo thành ion NH4+ và OH- , làm cho dd có tính bazơ và dẫn điện : NH3 + H2O NH4+ + OH- Trong dd, amoniac là 1 bazơ yếu, hóa xanh quỳ tím, hóa hồng phenolphtalein. b. Tác dụng với dd muối : - Dung dịch amoniac có thể tác dụng với dd muối của nhiều kim loại, tạo thành kết tủa hiđroxit của kim loại đó. FeSO4 + 2NH3 + 2H2O → (NH4)2SO4 + Fe(OH)2 ↓ - Với các dd muối Cu2+ , Zn2+ , Ag+ có thể tạo phức chất tan [Cu(NH3)4]2+ , [Zn(NH3)4]2+ , [Ag(NH3)2]+ CuCl2 + 2NH3 + 2H2O → 2NH4Cl + Cu(OH)2 ↓ 4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2 (phức xanh thẫm) c. Tác dụng với axit : Khí amoniac, cũng như dd amoniac, tác dụng với dd axit tạo ra muối amoni NH3 + HCl → NH4Cl ; 2NH3 + H2SO4 → (NH4)2SO4 2. Tính khử mạnh : Trong phân tử amoniac, N có số oxi hóa -3 (số oxi hóa thấp nhất), vì vậy amoniac có tính khử. Tính chất này được thể hiện khi amoniac tác dụng với các chất oxi hóa. a. Với oxi : 4NH3 + 3O2 2N2 + 6H2O (phản ứng cháy với ngọn lửa màu vàng) 4NH3 + 5O2 4NO + 6H2O b. Với clo : clo oxi hóa mạnh amoniac tạo nitơ và hiđro clorua 2NH3 + 3Cl2 → N2 + 6HCl Đồng thời NH3 kết hợp ngay với HCl tạo thành “khói” trắng NH4Cl NH3 + HCl → NH4Cl Tổng hợp : 8NH3 + 3Cl2 → N2 + 6NH4Cl c. Với CuO : 2NH3 + 3CuO 3Cu + N2 + 3H2O |
|
IV. Điều chế và ứng dụng |
1. Điều chế : a. Trong phòng thí nghiệm : đun nóng muối amoni với dd kiềm. 2NH4Cl + Ca(OH)2 CaCl2 + 2NH3 ↑ + 2H2O Để làm khô khí, người ta cho khí amoniac vừa tạo thành có lẫn hơi nước đi qua bình đựng vôi sống (CaO). Khi muốn điều chế nhanh một lượng nhỏ khí amoniac, người ta thường đun nóng dd amoniac đậm đặc. b. Trong công nghiệp : tổng hợp tử nitơ và hiđro
Đây là phản ứng thuận nghịch và tỏa nhiệt. Các điều kiện áp dụng trong công nghiệp sản xuất amoniac là : - Nhiệt độ : 450 - 5000C. Ở nhiệt độ thấp hơn, cân bằng hóa học trên chuyển dịch sang phải làm tăng hiệu suất phản ứng, nhưng lại làm giảm tốc độ phản ứng. - Áp suất cao, từ 200 – 300 atm. - Chất xúc tác là sắt kim loại được trộn thêm Al2O3, K2O,… Trong khí amoniac tạo thành còn lẫn nitơ và hiđro. Hỗn hợp được làm lạnh, chỉ có amoniac hóa lỏng và tách ra. Còn nitơ và hiđro chưa tham gia phản ứng lại được bổ sung vào hỗn hợp nguyên liệu ban đầu. 2. Ứng dụng : Amoniac được sử dụng chủ yếu để sản xuất axit nitric, phân đạm như urê, amoni nitrat, amoni sunfat,… ; điều chế hiđrazin N2H4 làm nhiên liệu tên lửa. Amoniac lỏng được dùng làm chất gây lạnh trong thiết bị lạnh. |
|
PHOTPHO (P) |
||
|
I. Vị trí và cấu hình e nguyên tử |
- Photpho ở ô số 15, nhóm VA, chu kì 3 - Cấu hình e : 1s22s22p63s23p3 Do lớp ngoài cùng có 5 e , nên trong các hợp chất, hóa trị của p có thể là 5. Ngoài ra, trong 1 số hợp chất, P còn có hóa trị 3. |
|
|
II. Tính chất vật lí |
Photpho có thể tồn tại ở 1 số dạng thù hình khác nhau, nhưng quan trọng hơn cả là Photpho trắng và Photpho đỏ. |
|
|
1. Photpho trắng |
2. Photpho đỏ |
|
|
- Chất rắn trong suốt, màu trắng hoặc hơi vàng, trông giống như sáp, có cấu trúc mạng tinh thể nguyên tử. Trong tinh thể, những phân tử P4 nằm ở nút mạng và liên kết với nhau bằng liên kết yếu. Do đó P trắng mềm, dễ nóng chảy (tnc = 44,10C). - P trắng không tan trong nước, tan trong các dung môi hữu cơ : C6H6, CS2,… rất độc, gây bỏng. - P trắng bốc cháy trong không khí ở t0 > 400C, nên được bảo quản bằng cách ngâm trong nước. - Phát quang màu lục nhạt trong bóng tối ở nhiệt độ thường. P trắng P đỏ |
- Chất bột màu đỏ, dễ hút ẩm và chảy rữa, bền trong không khí ở nhiệt độ thường, không phát quang màu lục trong bóng tối, không tan trong các dung môi thông thường. - P đỏ có cấu trúc polime, nên khó nóng chảy, chỉ bốc cháy ở nhiệt độ trên 2500C, khó bay hơi hơn P trắng. - Khi đun nóng không có không khí, P đỏ chuyển thành hơi, khi làm lạnh thì hơi đó ngưng tụ lạnh thành P trắng. |
|
|
III. Tính chất hóa học |
P là phi kim tương đối hoạt động. P trắng hoạt động hóa học mạnh hơn P đỏ. Trong các hợp chất, P có số oxi hóa -3, +3, +5. Do đó, khi tham gia phản ứng hóa học P thể hiện tính oxi hóa hoặc tính khử. 1. Tính oxi hóa : P thể hiện tính oxi hóa khi tác dụng với một số kim loại hoạt động tạo ra photphua kim loại. 2P + 3Mg Mg3P2 (magie photphua) 2P + 3Zn Zn3P2 (kẽm photphua – thuốc chuột) 2. Tính khử : P thể hiện tính khử khi tác dụng với các phi kim hoạt động như oxi, halogen, lưu huỳnh,… và các hợp chất có tính oxi hóa mạnh khác. 4P + O2 (thiếu) 2P2O3 (điphotpho trioxit) 4P + O2 (dư) 2P2O5 (điphotpho pentaoxit) 2P + 3Cl2 (thiếu) 2PCl3 (photpho triclorua) 2P + 5Cl2 (dư) 2PCl5 (photpho pentaclorua) 3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO 6P + 5K2Cr2O7 → 5K2O + 5Cr2O3 + 3P2O3 6P (đỏ) + 5KClO3 3P2O5 + 5KCl (phản ứng xảy ra trong quá trình đốt diêm) |
|
|
IV. Trạng thái tự nhiên - ứng dụng – sản xuất |
1. Trạng thái tự nhiên : Trong tự nhiên không gặp P ở trạng thái tự do vì nó khá hoạt động về mặt hóa học. Hai khoáng vật chính của P là photphorit Ca3(PO4)2 và apatit 3Ca3(PO4)2.CaF2 . 2. Ứng dụng : - Phần lớn Photpho sản xuất ra được sử dụng dùng để sản xuất axit photphoric, phần còn lại chủ yếu dùng trong sản xuất diêm. - Ngoài ra, Photpho còn được dùng trong vào mục đích quân sự : sản xuất bom, đạn cháy, đạn khói,… 3. Sản xuất : Ca3(PO4)2 + 3SiO2 + 5C 3CaSiO3 + 5CO + 2P (hơi P thoát ra được ngưng tụ khi làm lạnh, sẽ thu được P trắng ở dạng rắn). |
|
|
Muối amoni |
Muối amoni là chất tinh thể ion, gồm cation amoni NH4+ và anion gốc axit. I. Tính chất vật lí : Tất cả các muối amoni đều tan nhiều trong nước, khi tan điện li hoàn toàn thành các ion. Ion NH4+ không màu. II. Tính chất hóa học : 1. Tác dụng với dd kiềm : Dung dịch đậm đặc của muối amoni phản ứng với dd kiềm khi đun nóng sẽ cho khí amoniac bay ra (NH4)2CO3 + KOH K2CO3 + 2NH3 ↑ + 2H2O Phương trình ion thu gọn : NH4+ + OH- → NH3 ↑ + H2O (Phản ứng dùng để nhận biết ion amoni và điều chế amoniac trong phòng thí nghiệm). 2. Phản ứng nhiệt phân : các muối amoni dễ bị phân hủy bởi nhiệt. a/ Muối amoni chứa gốc của axit không có tính oxi hóa (Cl- , HSO4- , SO42- , HCO3-, CO32-,…) khi đun nóng bị phân hủy thành amoniac. NH4Cl NH3 + HCl (NH4)2CO3 NH3 + NH4HCO3 (NH4)2SO4 NH3 + NH4HSO4 NH4HSO4 NH3 + N2 + 3SO2 + 6H2O NH4HCO3 NH3 + CO2 + H2O (NH4HCO3 được dùng làm bột nở) b/ Muối amoni chứa gốc axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho N2 , N2O (đinitơ oxit). NH4NO2 N2 + 2H2O ; NH4NO3 N2O + 2H2O (các phản ứng này dùng để điều chế N2 và N2O trong phòng thí nghiệm) |
|
Muối nitrat |
Muối của axit nitric được gọi là muối nitrat. I. Tính chất vật lí : Tất cả các muối nitrat đều dễ tan trong nước và là chất điện li mạnh. Trong dd loãng, chúng phân li hoàn toàn thành các ion. Ion NO3- không màu. II. Tính chất hóa học : 1. Phản ứng nhiệt phân : - Các muối nitrat của kim loại hoạt động mạnh (Na, K,…) bị phân hủy tạo ra muối nitrit và O2. NaNO3 NaNO2 + O2 - Muối nitrat của Mg, Zn, Fe, Pb, Cu,… bị phân hủy tạo ra oxit của kim loại tương ứng, NO2 và O2. 2Cu(NO3)2 2CuO + 4NO2 + O2 4Al(NO3)3 2Al2O3 + 12NO2 + 3O2 4Fe(NO3)2 2Fe2O3 + 8NO2 + O2 4Fe(NO3)3 2Fe2O3 + 12NO2 + 3O2 - Muối nitrat của Ag, Au, Hg,… bị phân hủy tạo thành kim loại tương ứng, NO2 và O2 2AgNO3 2Ag + 2NO2 + O2 Hg(NO3)2 Hg + 2NO2 + O2 2. Phản ứng oxi hóa – khử : 3Cu + 8H+ + 2NO3- 3Cu2+ + 2NO ↑ + 4H2O 2NO + O2 (không khí) → 2NO2 (màu nâu đỏ) (phản ứng để nhận biết ion NO3- trong dung dịch) III. Ứng dụng : - Các muối nitrat chủ yếu được sử dụng làm phân bón (phân đạm). Ví dụ : NH4NO3 (đạm 2 lá), NaNO3, KNO3,… - Kali nitrat còn được dùng chế tạo thuốc nổ đen (thuốc nổ có khói). Thuốc nổ đen chứa 75% KNO3 , 10% S và 15% C. |
|
Muối photphat |
Muối photphat là muối của axit photphoric. Gồm 3 loại muối : - Muối photphat trung hòa : Na3PO4, (NH4)3PO4 , Ca3(PO4)2 ,… - Muối đihiđrophotphat : KH2PO4, NH4H2PO4 , Ca(H2PO4)2 ,… - Muối hiđrophotphat : Na2HPO4 , (NH4)2HPO4 , CaHPO4 ,… 1. Tính tan : tất cả muối đihiđrophotphat đều tan. Trong các muối hiđrophotphat và photphat trung hòa chỉ có muối của kim loại Na, K và amoni là dễ tan còn muối các kim loại khác đều không tan hoặc ít tan. 2. Nhận biết ion photphat : 3Ag+ + PO43- → Ag3PO4 ↓ (màu vàng) (kết tủa này không tan trong nước, nhưng tan trong dd axit nitric loãng) |
|
|
AXIT NITRIC (HNO3) |
AXIT PHOTPHORIC (H3PO4) |
|
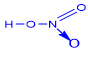
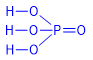
I. Cấu tạo phân tử |
Trong hợp chất HNO3, N có số oxi hóa cao nhất là +5 và hóa trị IV. |
Trong hợp chất H3PO4 , P có số oxi hóa cao nhất là +5 và hóa trị V.
|
|
II. Tính chất vật lí |
- Là chất lỏng không màu, bốc khói mạnh trong không khí ẩm. - Kém bền, phân hủy ngay ở nhiệt độ thường khi có ánh sáng 4HNO3 4NO2 + O2 + 2H2O Khí NO2 (nitơ đioxit) tan trong dd axit, làm cho dd có màu vàng. - Tan trong nước theo bất kì tỉ lệ nào. |
Là chất tinh thể trong suốt, nóng chảy ở 42,50C, rất háo nước nên dễ chảy rữa, tan trong nước theo bất kì tỉ lệ nào. Axit photphoric thường dùng là dd đặc, sánh, không màu, nồng độ 85%. |
|
III. Tính chất hóa học |
1. Tính axit : Là một trong các axit mạnh nhất, trong dd loãng phân li hoàn toàn thành ion H+ và NO3-. Làm quỳ tím hóa đỏ, tác dụng bazơ, oxit bazơ và muối của axit yếu hơn tạo thành muối nitrat. MgO + 2HNO3 → Mg(NO3)2 + H2O Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O BaCO3 + 2HNO3 → Ba(NO3)2 + CO2 + H2O 2. Tính oxi hóa mạnh : Axit nitric là một trong những axit có tính oxi hóa mạnh. Tùy thuộc vào nồng độ của axit và độ mạnh yếu của chất khử, mà HNO3 có thể bị khử đến các sản phẩm khác nhau của nitơ. a. Tác dụng với kim loại : + HNO3 phản ứng với hầu hết các kim loại trừ Au và Pt → muối nitrat + H2O và sản phẩm khử của N+5 (NO2, NO, N2O, N2 và NH4NO3). + Với các kim loại có tính khử mạnh : Mg, Al, Zn,… HNO3 loãng có thể bị khử đến N2O, N2, NH4NO3. Cu + 4HNO3 (đặc)→ Cu(NO3)2 + 2NO2 + 2H2O Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O 4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O * Chú ý : Fe, Al, Cr bị thụ động trong dd HNO3 đặc, nguội do tạo màng oxit bền, bảo vệ kim loại khỏi tác dụng của axit → dùng bình Al hoặc Fe để đựng HNO3 đặc nguội. * Au, Pt tan được trong nước cường toan (cường thủy 3HCl : 1HNO3), không hòa tan được Ag vì tạo kết tủa AgCl. Au + 3HCl + HNO3 → AuCl3 + NO + 2H2O b. Tác dụng với phi kim : S + 6HNO3 H2SO4 + 6NO2 + 2H2O C + 4HNO3 CO2 + 4NO2 + 2H2O 5HNO3 + P H3PO4 + 5NO2 + H2O 5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO c. Tác dụng với hợp chất : HNO3 đặc còn oxi hóa được hợp chất vô cơ và hữu cơ. Vải, giấy, mùn cưa, dầu thông,… bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc. 4HNO3 + FeCO3 → Fe(NO3)3 + NO2 + 2H2O + CO2 Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O |
- Có tính chất của axit (làm quỳ tím hóa đỏ, kim loại trước H trong dãy hoạt động hóa học, tác dụng bazơ, oxit bazơ và 1 số muối) 2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O 2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2 H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4 - Có độ mạnh trung bình, là axit 3 nấc. Trong dd nước, nó phân li theo từng nấc : Nấc 1 : H3PO4 H+ + H2PO4- (chủ yếu) Nấc 2 : H2PO4- H+ + HPO42- (kém hơn) Nấc 3 : HPO42- H+ + PO43- (rất yếu) → trong dd axit photphoric chứa các ion H+ , H2PO4- , HPO42- , PO43- và các phân tử H3PO4 không phân li (không kể các ion H+ và OH- do nước phân li) - Khi tác dụng với dd kiềm, tùy theo lượng chất tác dụng mà axit photphoric tạo ra muối axit, muối trung hòa hoặc hỗn hợp muối đó. KOH + H3PO4 → KH2PO4 + H2O 2KOH + H3PO4 → K2HPO4 + 2H2O 3KOH + H3PO4 → K3PO4 + 3H2O - Khác với axit nitric, axit photphoric không có tính oxi hóa. |
|
IV. Ứng dụng |
Phần lớn axit nitric sản xuất ra được dùng để điều chế phân đạm NH4NO3, Ca(NO3)2,… Ngoài ra, axit nitric còn được dùng để điều chế thuốc nổ (TNT,…), thuốc nhuộm, dược phẩm,… |
Một lượng lớn axit H3PO4 loại kĩ thuật được dùng để điều chế muối photphat và để sản xuất phân lân, hợp chất cơ photpho (làm thuốc trừ sâu),… H3PO4 tinh khiết được dùng trong công nghiệp dược phẩm. |
|
V. Điều chế |
1. Trong phòng thí nghiệm : Đun nóng hỗn hợp natri nitrat rắn hoặc kali nitrat rắn với axit sunfuric đặc NaNO3 + H2SO4 HNO3 + NaHSO4 Hơi HNO3 thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó. 2. Trong công nghiệp : Đi từ amoniac qua 3 giai đoạn : 4NH3 + 5O2 4NO + 6H2O (∆H < 0) 2NO + O2 → NO2 4NO2 + O2 + 2H2O → 4HNO3 dd HNO3 thu được thường có nồng độ 52 – 68%. Để có axit nitric với nồng độ cao hơn 68%, người ta chưng cất axit này với H2SO4 đậm đặc. |
1. Trong phòng thí nghiệm : P + 5HNO3 (đặc) H3PO4 + 5NO2 + H2O 2. Trong công nghiệp : Ca3(PO4)2 + 3H2SO4 đặc 3CaSO4 + 2H3PO4 Để điều chế H3PO4 với độ tinh khiết cao ta dùng sơ đồ: P → P2O5 → H3PO4 4P + 5O2 → 2P2O5 P2O5 + 3H2O → 2H3PO4 |
CHƯƠNG 3 : CACBON – SILIC
|
|
CACBON (C) |
SILIC (SI) |
|
I. Vị trí và cấu hình e |
- Ở ô số 6, chu kì 2, nhóm IVA. - Cấu hình e : 1s22s22p2 LNC có 4 e nên trong các hợp chất, nguyên tử C có thể tạo được tối đa 4 liên kết cộng hóa trị với các nguyên tử khác. |
- Ở ô số 14, chu kì 3, nhóm IVA - Cấu hình e : 1s22s22p63s23p2 |
|
II. Tính chất vật lí |
Nguyên tố C có 4 dạng thù hình : 1. Kim cương : - Là tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém. - Có cấu trúc tinh thể nguyên tử và cứng nhất trong tất cả các chất. 2. Than chì : Than chì là tinh thể màu xám đen, có ánh kim, dẫn điện tốt nhưng kém kim loại. Tinh thể than chì có cấu trúc lớp. Do cấu trúc này mà than chì mềm, khi vạch trên giấy nó để lại vạch đen gồm nhiều lớp tinh thể. 3. Fuleren 4. Cacbon vô định hình : Các loại than được điều chế nhân tạo như than gỗ, than xương, than muội,… được gọi chung là cacbon vô định hình. Than gỗ, than xương có cấu tạo xốp, nên chúng có khả năng hấp phụ mạnh các chất khí và chất tan trong dd. |
Silic có 2 dạng thù hình là silic vô định hình và silic tinh thể. - Silic vô định hình : là chất bột màu nâu, không tan trong nước nhưng tan trong kim loại nóng chảy. - Silic tinh thể : có màu xám, dòn, có ánh kim, có cấu trúc giống kim cương, có tính bán dẫn, nóng chảy ở 14200C, hoạt tính thấp.
|
|
III. Tính chất hóa học |
- Ở nhiệt độ thường, cacbon khá trơ, còn khi đun nóng nó phản ứng với rất nhiều chất. Cacbon vô định hình hoạt động hơn cả về mặt hóa học. - Các oxi hóa thường gặp là: -4; 0; +2; +4. Trong phản ứng oxi hóa – khử, đơn chất cacbon có thể tăng hoặc giảm số oxi hóa, nên nó thể hiện tính khử hoặc tính oxi hóa. Nhưng tính khử vẫn là tính chất chủ yếu. 1. Tính khử : a. Tác dụng với các phi kim : C + O2 CO2 C + CO2 2CO b. Tác dụng với oxit kim loại : - Cacbon khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại: CuO + C Cu + CO Fe2O3 + 3C 2Fe + 3CO - Với CaO và Al2O3: CaO + 3C CaC2 + CO 2Al2O3 + 9C Al4C3 + 6CO c. Tác dụng với các chất oxi hóa mạnh : thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2). C + 2H2SO4 (đặc) CO2 + 2SO2 + 2H2O C + 4HNO3 (đặc) CO2 + 4NO2 + 2H2O C + 4KNO3 2K2O + CO2 + 4NO2 - Khi nhiệt độ cao, C tác dụng được với hơi nước: C + H2O CO + H2 C + 2H2O CO2 + 2H2 2. Tính oxi hóa : a. Tác dụng với H2 : C + 2H2 CH4 b. Tác dụng với kim loại → muối cacbua: 4Al + 3C Al4C3 |
- Các mức oxi hóa có thể có của Si: -4; 0; +2; +4 (số oxi hóa +2 ít đặc trưng) nên Si có cả tính khử và tính oxi hoá. - Silic vô định hình có khả năng phản ứng cao hơn silic tinh thể.
1. Tính khử : a. Tác dụng với phi kim : Si + 2F2 → SiF4 (phản ứng xảy ra ở nhiệt độ thường) Si + 2O2 SiO2 b. Tác dụng với hợp chất : - Si tan dễ dàng trong dung dịch kiềm → H2 Si + 2NaOH + H2O → Na2SiO3 + 2H2 - Si tác dụng với axit : 4HNO3 + 18HF + 3Si → 3H2SiF6 + 4NO + 8H2O * Trong hồ quang điện, Silic tác dụng với H2 tạo thành một hỗn hợp các silan: Si + H2 → SiH4 + Si2H6 + Si3H6 + ... 2. Tính oxi hóa : Si tác dụng được với nhiều kim loại ở nhiệt độ cao → silixua kim loại. 2Mg + Si → Mg2Si (magie silixua)
|
|
IV. Ứng dụng, trạng thái tự nhiên, điều chế |
1. Ứng dụng : - Kim cương được dùng làm đồ trang sức. Trong kĩ thuật, kim cương được dùng làm mũi khoan, dao cắt thuỷ tinh, bột mài. - Than chì được dùng làm điện cực; làm nồi, chén để nấu chảy các hợp kim chịu nhiệt; chế tạo chất bôi trơn; làm bút chì đen. - Than cốc được dùng làm chất khử trong luyện kim để luyện kim loại từ quặng. - Than gỗ được dùng để chế thuốc nổ đen, thuốc pháo, chất hấp phụ. - Than muội được dùng làm chất độn khi lưu hoá cao su, để sản xuất mực in, xi đánh giày. 2. Trạng thái tự nhiên : - Kim cương và than chì là cacbon ở dạng tự do gần như tinh khiết. - Cacbon còn có trong các khoáng vật như canxit (đá vôi, đá hoa, đá phấn đều chứa CaCO3), magiezit (MgCO3), đolomit (CaCO3.MgCO3). Dầu mỏ, khí thiên nhiên là hỗn hợp của các chất khác nhau chứa cacbon. Cơ thể động thực vật cũng chứa nhiều hợp chất của cacbon. |
1. Ứng dụng : - Silic siêu tinh khiết là chất bán dẫn, được dùng trong kĩ thuật vô tuyến và điện tử, để chế tạo tế bào quang điện, bộ khuếch đại, bộ chỉnh lưu, pin mặt trời,… - Trong luyện kim, silic được dùng để tách oxi ra khỏi kim loại nóng chảy. Ferosilic là hợp kim để chế tạo thép chịu axit. 2. Trạng thái tự nhiên : - Là nguyên tố phổ biến thứ 2 sau oxi, chiếm gần 29,5% khối lượng vỏ Trái Đất. - Trong tự nhiên, không gặp Si ở trạng thái tự do, mà chỉ gặp ở trạng thái hợp chất : chủ yếu là silic đioxit ; các khoáng vật silicat và aluminosilicat như cao lanh, mica, fenspat, đá xà vân, thạch anh,… 3. Điều chế : Dùng các chất khử mạnh như Mg, Al, C khử silic đioxit ở nhiệt độ cao. SiO2 + C 2CO + Si SiO2 + 2Mg 2MgO + Si |
|
CÁC HỢP CHẤT CỦA CACBON |
CÁC HỢP CHẤT CỦA SILIC |
|
I. Cacbon monooxit : CO 1. Tính chất vật lí : - CO là chất khí, không màu, không mùi, không vị, tan rất ít trong nước và rất bền với nhiệt, hơi nhẹ hơn không khí, hóa lỏng ở - 191,50C, hóa rắn ở - 205,20C. - CO là khí rất độc vì nó kết hợp với hemoglobin ở trong máu tạo thành hợp chất bền làm cho hemoglobin mất tác dụng vận chuyển khí O2. (lửa màu lam nhạt, tỏa nhiều nhiệt. Vì vậy, CO được dùng làm nhiên liệu) 2. Tính chất hóa học : a/ CO là oxit trung tính (oxit không tạo muối) → không tác dụng với nước, dd bazơ và dd axit ở điều kiện thường. b/ CO là chất khử mạnh : - Tác dụng với các phi kim : 2CO + O2 2CO2 - CO khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại (phản ứng xảy ra ở nhiệt độ cao). 3CO + Fe2O3 3CO2 + 2Fe CO + CuO CO2 + Cu (Tính chất này được dùng trong luyện kim) 3. Điều chế : a/ Trong phòng thí nghiệm : HCOOH CO + H2O b/ Trong công nghiệp : - Cho hơi nước đi qua than nóng đỏ : C + H2O CO + H2 hỗn hợp khí tạo thành là khí than ướt (44% CO, còn lại CO2, H2, N2,…) - Hỗn hợp khí than khô (khí lò gas) : thổi không khí đi qua than nóng đỏ. C + O2 CO2 C + CO2 2CO (hỗn hợp chứa 25% CO, N2, CO2 và lượng nhỏ các khí khác). Khí than ướt, khí lò gas đều được dùng làm nhiên liệu khí. II. Cacbon đioxit : CO2 1. Tính chất vật lí : Là khí không màu, vị hơi chua. Tan ít trong nước. CO2 khi bị làm lạnh đột ngột là thành phần chính của nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên được dùng để làm môi trường lạnh và khô, rất tiện lợi để bảo quản thực phẩm. 2. Tính chất hóa học : - Khí CO2 không cháy và không duy trì sự cháy của nhiều chất, nên được dùng để dập tắt đám cháy. Nhưng không thể dập tắt các đám cháy của kim loại mạnh (Mg, Al, Na,…) CO2 + 2Mg 2MgO + C a. CO2 là oxit axit : - CO2 tan trong nước tạo thành axit cacbonic (là một điaxit rất yếu): CO2 + H2O H2CO3 - CO2 tác dụng với oxit bazơ → muối: CaO + CO2 → CaCO3 - CO2 tác dụng với dung dịch bazơ : NaOH + CO2 → NaHCO3 2NaOH + CO2 → Na2CO3 + H2O b. CO2 bền, ở nhiệt độ cao bị nhiệt phân một phần và tác dụng được với các chất khử mạnh : 2CO2 2CO + O2 CO2 + C 2CO c. CO2 còn được dùng để sản xuất urê : CO2 + 2NH3 H2O +(NH2)2CO 3. Điều chế : - Quá trình hô hấp của người và động vật : C6H12O6 + 6O2 → 6CO2 + 6H2O - Quá trình lên men bia rượu : C6H12O6 → 2CO2 + 2C2H5OH - Quá trình đốt cháy nhiên liệu : CxHy + O2 xCO2 + H2O - Trong công nghiệp : C + O2 CO2 (đốt cháy hoàn toàn than cốc trong không khí) CaCO3 CaO + CO2 - Trong phòng thí nghiệm: CaCO3 + 2HCl → CaCl2 + CO2 + H2O 4. Nhận biết : Tạo kết tủa trắng với dung dịch nước vôi trong dư. CO2 + Ca(OH)2 → CaCO3 + H2O III. Axit cacbonic : H2CO3 - Rất kém bền, chỉ tồn tại trong dd loãng, dễ bị phân hủy thành CO2 và H2O. Trong dd, axit này phân li 2 nấc : H2CO3 H+ + HCO3- (chủ yếu) HCO3- H+ + CO32- (rất ít) Axit cacbonic tạo ra 2 loại muối : muối cacbonat chứa ion CO32- (Na2CO3, CaCO3,…) ; muối hiđrocacbonat chứa ion HCO3- (NaHCO3, Ca(HCO3)2,…) IV. Muối cacbonat : Là muối của axit cacbonic (gồm muối CO32- và HCO3-). 1. Tính tan : Các muối cacbonat trung hoà của kim loại kiềm (trừ Li2CO3), amoniac và các muối hidrocacbonat dễ tan trong nước (trừ NaHCO3 ít tan). Các muối cacbonat trung hoà của những kim loại khác không tan hoặc ít tan trong nước. 2. Tính chất hóa học : a. Phản ứng nhiệt phân : - Muối cacbonat tan không bị nhiệt phân (trừ muối amoni), muối cacbonat không tan bị nhiệt phân: MgCO3 MgO + CO2 - Tất cả các muối hiđrocacbonat đều bị nhiệt phân: 2NaHCO3 → Na2CO3 + CO2 + H2O Ca(HCO3)2 → CaCO3 + H2O + CO2 b. Tính chất hóa học chung của muối : - Tác dụng với axit : NaHCO3 + HCl → NaCl + H2O + CO2 - Tác dụng với dung dịch bazơ : NaHCO3 + NaOH → Na2CO3 + H2O - Tác dụng với muối : Na2CO3 + CaCl2 → CaCO3 + 2NaCl * Ứng dụng : - CaCO3 tinh khiết là chất bột màu trắng, nhẹ, được dùng làm chất độn trong một số ngành công công nghiệp. - Sođa khan Na2CO3 được dùng trong công nghiệp thủy tinh, đồ gốm, bột giặt,… - NaHCO3 được dùng trong công nghiệp thực phẩm (bột nở), dược phẩm (thuốc chữa đau dạ dày),… |
I. Silic đioxit : SiO2 1. Tính chất vật lí và trạng thái tự nhiên : - Là chất ở dạng tinh thể nguyên tử, không tan trong nước. - Trong tự nhiên chủ yếu tồn tại ở dạng cát và thạch anh. 2. Tính chất hoá học : - SiO2 có tính chất của oxit axit, tan chậm trong dung dịch kiềm và tan dễ trong kiềm nóng chảy hoặc cacbonat kim loại kiềm nóng chảy → silicat: SiO2 + 2NaOH → Na2SiO3 + H2O SiO2 + Na2CO3 → Na2SiO3 + CO2 - SiO2 tan dễ trong axit HF: SiO2 + 4HF → SiF4 + 2H2O Phản ứng này dùng để khắc chữ trên thủy tinh → không dùng bình thủy tinh để đựng axit HF. II. Axit silixic : H2SiO3 Dạng keo, không tan trong nước, khi đun nóng dễ bị mất nước: H2SiO3 H2O + SiO2 - Khi sấy khô, H2SiO3 mất một phần nước tạo thành vật liệu xốp là silicagen được dùng làm chất hút ẩm và hấp phụ nhiều chất. - H2SiO3 chỉ tác dụng với dung dịch kiềm mạnh. H2SiO3 + 2NaOH → Na2SiO3 + 2H2O - Là axit yếu, yếu hơn axit cacbonic nên điều chế bằng cách dùng axit mạnh đẩy ra khỏi muối hoặc thủy phân một số hợp chất của Si. Na2SiO3 + 2HCl → 2NaCl + H2SiO3 Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3 III. Muối silicat : Là muối của axit silixic, thường không màu, khó tan (trừ muối kim loại kiềm tan được). Dung dịch đậm đặc của Na2SiO3 được gọi là thủy tinh lỏng được dùng để chế tạo keo dán thủy tinh và sứ, bảo quản vải và gỗ khỏi bị cháy. Trong dung dịch, silicat của kim loại kiềm bị thủy phân mạnh tạo môi trường bazơ: Na2SiO3 + 2H2O → 2Na+ + 2OH‑ + H2SiO3
|
Chương 4 : Đại cương hóa hữu cơ
I/ HÓA HỌC HỮU CƠ VÀ HỢP CHẤT VÔ CƠ :
1. Khái niệm hóa học hữu cơ và hợp chất vô cơ :
- Hợp chất hữu cơ là hợp chất của nguyên tố Cacbon (trừ CO, CO2 , CN- , CO32- , HCO3- , HCN ... )
- Hóa học hữu cơ : là ngành nghiên cứu các hợp chất hữu cơ.
2. Đặc điểm chung của hợp chất hữu cơ :
- Đặc điểm cấu tạo : Liên kết chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị. Thành phần các nguyên tố tạo nên các hợp chất hữu cơ là : C, H, O, N (1 số ít có S, Cl, P, kim loại có ít hơn), nhưng số lượng các hợp chất hữu cơ rất nhiều (do hiện tượng đồng phân).
- Tính chất vật lí :
+ Nhiệt độ sôi và nhiệt độ nóng chảy thấp.
+ Phần lớn không tan trong nước, tan nhiều trong các dung môi hữu cơ.
- Tính chất hóa học :
+ Các hợp chất hữu cơ thường kém bền với nhiệt và dễ cháy.
+ Phản ứng hữu cơ thường xảy ra chậm, theo nhiều hướng khác nhau và thường tạo thành hỗn hợp sản phẩm.
II/ PHÂN LOẠI CÁC HỢP CHẤT HỮU CƠ :
1. Phân loại : Hợp chất hữu cơ thường chia thành 2 loại :
- Hiđrocacbon : là HCHC chỉ chứa 2 nguyên tố là C và H ; công thức chung : CxHy (y ≤ 2x + 2) hoặc CnH2n+2-2a (a ≥ 0) (a là số liên kết pi hoặc vòng).
|
Mạch hở |
No |
Ankan |
CnH2n + 2 (n ≥ 1 , a = 0) |
|
Không no |
Anken (1 liên kết =) |
CnH2n (n ≥ 2 , a = 1) |
|
|
Ankađien (2 liên kết = ) |
CnH2n-2 (n ≥ 3 , a = 2) |
||
|
Ankin (1 liên kết ≡ ) |
CnH2n-2 (n ≥ 2 , a = 2) |
||
|
Mạch kín (vòng) |
No |
Xicloankan (1 vòng) |
CnH2n (n ≥ 3 , a = 1) |
|
Thơm |
Aren (3π + 1 vòng) |
CnH2n-6 (n ≥ 6 , a = 4) |
- Dẫn xuất của Hiđrocacbon : là các hợp chất hữu cơ mà trong phân tử ngoài các nguyên tố C, H thì còn chứa các nguyên tố khác : O, N, S, Cl ...
+ Dẫn xuất halogen : CH3Br , CHCl3 , ...
+ Ancol : C2H5OH , C3H5(OH)3 ,... ; phenol : C6H5OH ,... ; ete : CH3OCH3 ,....
+ Anđêhit : CH3CHO, (CHO)2 , ... ; xeton : CH3COCH3 , ...
+ Amin : CH3NH2 , C6H5NH2 , ... ; nitro : CH3NO2 ...
+ Axit : HCOOH, CH3COOH , ... ; este : HCOOCH3 , C2H5COOCH3 , ...
+ Hợp chất tạp chức, polime ....
2. Nhóm chức : là nhóm nguyên tử quyết định tính chất đặc trưng, cơ bản của một chất hữu cơ .
a. Các nhóm chức tham khảo trong chương trình phổ thông :
+ Nhóm chức hóa trị I :
|
Công thức |
- OH |
- CHO |
- COOH |
- NH2 |
- NO2 |
- C≡N |
|
Tên gọi |
Hiđroxyl |
Fomyl |
Cacboxyl |
Amino |
Nitro |
Nitrin |
|
Chức |
Ancol, phenol |
Anđêhit |
Axit |
Amin bậc I |
|
|
+ Nhóm chức hóa trị II :
|
Công thức |
- O - |
- COO - |
- NH - |
- CO – NH - |
|
|
Tên gọi |
Oxit |
Cacbonyl |
Cacboxylat |
Amino |
Amit |
|
Chức |
Ete |
Xeton |
Este |
Amin bậc II |
Peptit |
+ Ngoài ra còn chức hóa trị III (≡N) : amin bậc III
b. Hợp chất hữu cơ đơn chức, đa chức, tạp chức :
+ Hợp chất hữu cơ dơn chức : là chất hữu cơ chỉ chứa 1 nhóm chức duy nhất.
Ví dụ : CH3OH (rượu metylic 1 chức –OH) , CH3NH2 (metyl amin 1 chức –NH2 ) ...
+ Hợp chất hữu cơ đa chức (đồng nhất) : là hợp chất hữu cơ chứa nhiều nhóm chức giống nhau.
Ví dụ : C3H5(OH)3 (glixerol) , C2H4(OH)2 (etylen glicol) ....
+ Hợp chất hữu cơ tạp chức : là hợp chất hữu cơ có nhiều nhóm chức khác nhau.
Ví dụ : H2N-CH2-COOH (glixin) , HO-CH2-CHO , ....
c. Bậc cacbon, bậc ancol, bậc amin :
|
Cacbon mang số |
1 |
2 |
3 |
4 |
5 |
|
Bậc của cacbon |
I |
III |
IV |
II |
I |
* Bậc của cacbon : Cacbon bậc n khi liên kết trực tiếp bằng n liên kết với cacbon bên cạnh.
* Bậc của amin :
|
Các bậc |
Bậc 1 |
Bậc 2 |
Bậc 3 |
|
CTTQ |
R – NH2 |
|
* Bậc của ancol : là bậc của C mang nhóm –OH
|
Các bậc |
Bậc 1 |
Bậc 2 |
Bậc 3 |
|
CTTQ |
R–CH2–OH |
R, R’ , R’’ là các gốc hiđrocacbon.
III/ Sơ lược về phân tích nguyên tố :
1. Phân tích định tính : Nhằm xác định các nguyên tố có mặt trong hợp chất hữu cơ bằng cách phân hủy hợp chất hữu cơ thành các chất vô cơ đơn giản, rồi nhận biết chúng bằng các phản ứng đặc trưng.
a. Xác định cacbon và hiđro : Nung hợp chất hữu cơ với CuO để chuyển C thành CO2 , nguyên tố H thành H2O, rồi nhận biết chúng bằng các phản ứng đặc trưng : khí CO2 làm vẩn đục nước vôi trong, H2O làm xanh CuSO4 khan ...
b. Xác định nitơ : Khi đun nóng với H2SO4 đặc, nitơ có trong một số hợp chất hữu cơ có thể chuyển thành muối amoni và được nhận biết dưới dạng amoniac :
CxHyOzNt (NH4)2SO4 + ... (NH4)2SO4 + 2NaOH Na2SO4 + 2NH3 + 2H2O
c. Xác định halogen : Khi đốt hợp chất hữu cơ chứa clo bị phân hủy, clo tách ra dưới dạng HCl và được nhận biết bằng AgNO3 :
CxHyOzClt → CO2 + H2O + HCl ; HCl + AgNO3 → AgCl + HNO3
2. Phân tích định lượng : Nhằm xác định tỉ lệ khối lượng (hàm lượng) các nguyên tố trong hợp chất hữu cơ bằng cách phân hủy hợp chất hữu cơ thành các chất vô cơ đơn giản, rồi định lượng chúng bằng phương pháp khối lượng, phương pháp thể tích hoặc phương pháp khác.
a. Định lượng cacbon, hiđro : Oxi hóa hoàn toàn một lượng xác định hợp chất hữu cơ A (mA) rồi cho hấp thụ qua các bình riêng để định lượng CO2 và định lượng H2O sinh ra. Hàm lượng hiđro (%H) tính từ khối lượng H2O sinh ra ( ) , hàm lượng phần trăm C tính từ khối lượng CO2 ( ) sinh ra như sau : ;
b. Định lượng nitơ : Nung m (gam) hợp chất hữu cơ A chứa A với CuO trong dòng khí CO2 :
CxHyOzNt CO2 + H2O + N2
Hấp thụ CO2 và H2O bằng dung dịch KOH 40% , đo được thể tích khí còn lại. Giả sử xác định được V (lít) khí N2 ở đktc thì khối lượng nitơ (mN) và hàm lượng phần trăm của nitơ (%N) được tính như sau : ;
c. Định lượng các nguyên tố khác :
* Halogen : Phân hủy hợp chất hữu cơ, chuyển halogen thành HX rồi định lượng dưới dạng AgX (X = Cl, Br).
* Lưu huỳnh : Phân hủy hợp chất hữu cơ rồi định lượng lưu huỳnh dưới dạng sunfat.
* Oxi : Sau khi xác định C, H, N, halogen, S, ... còn lại oxi.
CÔNG THỨC PHÂN TỬ HỢP CHẤT HỮU CƠ
I. CÁC CÔNG THỨC THƯỜNG DÙNG TRONG HÓA HỮU CƠ :
1. Công thức tổng quát (CTTQ) : cho biết thành phần định tính các nguyên tố.
CxHyOzNt (x,y,z,t là số nguyên dương) → hợp chất có 4 nguyên tố C, H, O, N.
2. Công thức thực nghiệm (công thức nguyên) (CTTN) : cho biết tỉ lệ về số lượng các nguyên tử trong phân tử (tức tỉ lệ khối lượng giữa các nguyên tố). (CH2O)n (n là số nguyên dương ≥ 1)
3. Công thức đơn giản nhất (CTĐGN) :
a. Định nghĩa : Là công thức biểu thị tỉ lệ tối giản về số nguyên tử của các nguyên tố trong phân tử (dạng đặc biệt của CTTN khi n = 1).
b. Cách thiết lập CTĐGN :
Thiết lập CTĐGN của HCHC CxHyOz là tìm tỉ lệ :
x : y : z = nC : nH : nO = dưới dạng tỉ lệ giữa các số nguyên tối giản.
Trong thực tế, kết quả phân tích định lượng các nguyên tố trong phân tử chất hữu cơ cho biết phần trăm khối lượng các nguyên tố nên ta thường xác định CTĐGN giữa vào số liệu này. Đầu tiên lập tỉ lệ : x : y : z = . Sau đó biến đổi hệ thức trên về tỉ lệ giữa các số nguyên tối giản.
4. Công thức phân tử (CTPT) :
a. Định nghĩa : biểu thị số lượng nguyên tử của mỗi nguyên tố trong phân tử (cho biết giá trị n trong CTTN).
b. Quan hệ giữa CTPT và CTĐGN :
|
Hợp chất |
Metan |
Etilen |
Ancol etylic |
axit axetic |
Glucozơ |
|
CTPT |
CH4 |
C2H4 |
C2H6O |
C2H4O2 |
C6H12O6 |
|
CTĐGN |
CH4 |
CH2 |
C2H6O |
CH2O |
CH2O |
Nhận xét :
- Số nguyên tử mỗi nguyên tố trong CTPT là số nguyên lần số nguyên tử của nó trong CTĐGN.
- Trong nhiều trường hợp, CTPT cũng chính là CTĐGN.
Ví dụ : ancol etylic C2H6O ; metan CH4,…
- Một số hợp chất có CTPT khác nhau nhưng có cùng một CTĐGN.
Ví dụ : axetilen C2H2 và benzen C6H6 ; axit axetic C2H4O2 và glucozơ C6H12O6,…
c. Cách thiết lập CTPT HCHC :
v Dựa vào thành phần phần trăm khối lượng các nguyên tố :
Xét sơ đồ : CxHyOz → xC + yH + zO
Khối lượng : M (g) 12x (g) y (g) 16z (g)
Thành phần phần trăm khối lượng : 100% %C %H %O
Từ tỉ lệ :
Ta có :
Thí dụ : Phenolphtalein – chất chỉ thị màu dùng nhận biết dd bazơ – có phần trăm khối lượng C, H và O lần lượt bằng 75,47% , 4,35% và 20,18%. Khối lượng mol phân tử của phenolphtalein bằng 318 g/mol. Hãy lập CTPT của phenolphtalein.
Giải : Ta thấy %C + %H + %O = 100%, vậy thành phần phân tử phenolphtalein gồm ba nguyên tố C, H, O nên có thể đặt CTPT là CxHyOz (x,y,z nguyên dương). Ta có :
x = ; y = ; z =
CTPT của phenolphtalein là C20H14O4 .
v Thông qua CTĐGN :
Ví dụ : Chất hữu cơ X có CTĐGN là CH2O và có khối lượng mol phân tử bằng 60 g/mol. Xác định CTPT của X ?
Giải : CTPT của X là (CH2O)n hay CnH2nOn
Từ MX = (12 + 2 + 16)n = 60 → n = 2. Vậy X có CTPT là C2H4O2 .
v Tính trực tiếp theo khối lượng sản phẩm cháy :
Thí dụ : Hợp chất Y chứa các nguyên tố C, H, O. Đốt cháy hoàn toàn 0,88 gam Y thu được 17,6 gam CO2 và 0,72 gam H2O. Tỉ khối hơi của Y so với không khí ≈3,04. Xác định CTPT của Y?
Giải : MY = 29.3,04 ≈ 88 (g/mol) ; nY = = 0,01 (mol)
;
Đặt CTPT của Y là CxHyOz (x, y, z nguyên dương).
Phương trình hóa học của phản ứng cháy :
CxHyOz + O2 xCO2 + H2O
1 mol x mol mol
0,01 mol 04 mol 0,04 mol
Từ tỉ lệ : ta được x = 4 ; y = 8.
Từ MY = 12.4 + 1.8 + 16z = 88 ta có z =2. Vậy CTPT của Y là C4H8O2.
5. Công thức electron (công thức điện tử) : Là công thức cho biết thành phần nguyên tố, số lượng nguyên tử như CTPT, nhưng đặc biệt nó còn cho biết sự góp chung các cặp electron hóa trị giữa các nguyên tử với nhau để tạo liên kết cộng hóa trị.
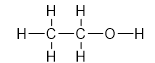
Ví dụ : Công thức e của phân tử ancol etylic.
6. Công thức cấu tạo (CTCT) : Khi thay các cặp e dùng chung bằng các gạch nối (−) ta có CTCT.
Ví dụ : CTCT của ancol etylic.
II. THUYẾT CẤU TẠO HÓA HỌC :
1. Nội dung cơ bản của thuyết cấu tạo hóa học (Butlerop – 1861) :
a. Trong phân tử hợp chất hữu cơ, các nguyên tử liên kết với nhau thep một thứ tự nhất định và theo đúng hóa trị của chúng. Thứ tự liên kết đó được gọi là cấu tạo hóa học. Sự thay đổi thứ tự liên kết đó, tức là thay đổi công thức cấu tạo, sẽ tạo ra chất mới có những tính chất mới.
Thí dụ : Ancol etylic và đimetyl ete có cùng CTPT là C2H6O, nhưng chúng có cấu tạo hóa học và tính chất hóa lí khác nhau.
Ancol etylic
CH3 – CH2 – OH , ts = 78,30C
Tan vô hạn trong nước, tác dụng với Na sinh ra khí H2
Đimetyl ete
CH3 – O – CH3 , ts = -230C
Tan ít trong nước, không tác dụng với Na.
b. Trong phân tử hợp chất hữu cơ, hóa trị C = 4, O = 2, H =1. Những nguyên tử C không những có thể liên kết với các nguyên tử của các nguyên tố khác mà còn liên kết với nhau thành mạch C – C (mạch vòng, mạch không vòng, mạch nhánh, mạch không nhánh).
CH3 – CH2 – CH2 – CH3
Mạch hở không nhánh
Mạch hở có nhánh
Mạch vòng
c. Tính chất của các chất phụ thuộc vào thành phần phân tử (bản chất, số lượng các nguyên tử) và cấu tạo hóa học (thứ tự liên kết các nguyên tử).
Thí dụ :
|
Khác về loại nguyên tử |
CH4 |
ts = -1620C |
Không tan trong nước, bị cháy khi đốt với oxi. |
|
CCl4 |
ts = 77,50C |
Không tan trong nước, không bị cháy khi đốt với oxi |
|
|
Cùng CTPT, khác CTCT |
CH3 – CH2 – OH |
ts = 78,30C |
Tan nhiều trong nước, tác dụng với Na |
|
CH3 – O – CH3
|
ts = -230C |
Tan ít trong nước, không tác dụng với Na |
|
|
Khác CTPT, tương tự về CTCT |
CH3 – CH2 – OH |
ts = 78,30C |
Tan nhiều trong nước, tác dụng với Na |
|
CH3 – CH2 – CH2 – OH |
ts = 97,20C |
Tan nhiều trong nước, tác dụng với Na |
2. Ý nghĩa : giải thích hiện tượng đồng đẳng, đồng phân.
III. LIÊN KẾT HÓA HỌC VÀ CẤU TRÚC PHÂN TỬ HỢP CHẤT HỮU CƠ :
Liên kết hóa học thường gặp nhất trong phân tử hợp chất hữu cơ là liên kết cộng hóa trị. Liên kết cộng hóa trị được chia thành hai loại : liên kết xích ma (σ) và liên kết pi (π). Sự tổ hợp liên kết σ với liên kết π tạo thành liên kết đôi hoặc liên kết ba.
1. Liên kết đơn :
Liên kết đơn (hay liên kết σ) do một cặp e chung tạo nên và được biễu diễn bằng một gạch nối giữa hai nguyên tử. Liên kết σ là liên kết bền.
2. Liên kết đôi :
Liên kết đôi do 2 cặp e chung giữa 2 nguyên tử tạo nên. Liên kết đôi gồm 1 liên kết σ và 1 liên kết π. Liên kết π kếm bền hơn liên kết σ nên dễ bị đứt ra trong các phản ứng hóa học. Liên kết được biểu diễn bằng 2 gạch nối song song giữa 2 nguyên tử.
Mỗi nguyên tử C của liên kết đôi còn tạo được 2 liên kết đơn với 2 nguyên tử khác. Bốn nguyên tử liên kết trực tiếp với 2 nguyên tử C của liên kết đôi nằm trong cùng mặt phẳng với 2 nguyên tử C đó.
3. Liên kết ba :
Liên kết ba do 3 cặp e chung giữa 2 nguyên tử tạo nên. Liên kết ba gồm 1 liên kết σ và 2 liên kết π. Liên kết ba được biểu diễn bằng ba gạch nối song song giữa 2 nguyên tử.
Mỗi nguyên tử C của liên kết ba còn tạo được 1 liên kết đơn với 1 nguyên tử khác. Hai nguyên tử liên kết với hai nguyên tử C của liên kết ba nằm trên đường thẳng nối 2 nguyên tử C.
IV. ĐỒNG ĐẲNG – ĐỒNG PHÂN :
1. Đồng đẳng :
v Khái niệm : Những hợp chất có thành phần phân tử hơn kém nhau 1 hay nhiều nhóm metilen (CH2) nhưng có tính chất hóa học tương tự nhau là những chất đồng đẳng, chúng hợp thành dãy đồng đẳng.
Sở dĩ các chất trong cùng dãy đồng đẳng có tính chất hóa học tương tự nhau là do chúng có cấu tạo hóa học tương tự nhau.
Thí dụ :
- Xét các hiđrocacbon : CH4 , C2H6 , C3H8, C4H10, … CnH2n+2.
Công thức phân tử các chất trên hơn kém nhau 1 hay 1 số nhóm CH2 và chúng có tính chất hóa học tương tự nhau (giống metan). Chúng được gọi là các chất đồng đẳng của nhau.
- Các ancol CH3 – OH, C2H5 – OH, C3H7 – OH,… CnH2n+1 – OH có thành phần phân tử hơn kém nhau 1 hay nhiều nhóm CH2, có tính chất hóa học tương tự nhau (giống ancol etylic). Các ancol này được gọi là đổng đẳng của nhau.
· Khối lượng phân tử các đồng đẳng lập thành 1 cấp số cộng có công sai d = 14.
Trong đó : KLPT cuối Mn = M1 + (n – 1)d
Tổng khối lượng cả dãy : S = (M1 + Mn).
2. Đồng phân :
a. Khái niệm : Là những chất có cùng công thức phân tử nhưng có cấu tạo hóa học khác nhau, nên có tính chất hóa học khác nhau.
Ví dụ : Ancol etylic (CH3 – CH2 – OH) và đimetyl ete (CH3 – O – CH3) đều có cùng CTPT là C2H6O, nhưng có tính chất hóa học khác nhau. Ta nói ancol etylic và đimetyl ete là các chất đồng phân của nhau. Các chất đồng phân của nhau có tính chất hóa học khác nhau là do chúng có cấu tạo hóa học khác nhau.
b. Phân loại đồng phân :
- Đồng phân cấu tạo (đồng phân phẳng) gồm : đồng phân mạch cacbon, đồng phân loại nhóm chức, đồng phân vị trí liên kết bội hoặc nhóm chức,…
Do trật tự sắp xếp khác nhau của các nguyên tử hay nhóm nguyên tử trong phân tử.
Thí dụ :
|
Đồng phân mạch cacbon |
CH3 – CH2 – CH2 – CH3 n – butan |
|
|
Đồng phân vị trí liên kết bội |
CH3 – CH2 – CH = CH2 : but – 1 – en |
CH3 – CH = CH – CH3 : but – 2 – en |
|
Đồng phân loại nhóm chức (1) |
HCOOCH2CH3 : etyl fomat |
CH3CH2COOH : axit propionic |
|
Đồng phân vị trí nhóm chức |
CH3 – CH2 – CH2 – CH2 – OH butan – 1 – ol |
(1) Nhóm chức là nhóm nguyên tử gây ra phản ứng hóa học đặc trưng của phân tử hợp chất hữu cơ.
- Đồng phân lập thể (đồng phân không gian) (đồng phân khác nhau về vị trí không gian của các nhóm nguyên tử).
v Đồng phân hình học (cis – trans) : Do vị trí không gian của các nhóm thế khác nhau gây nên.
Điều kiện để có đồng phân hình học : hai nguyên tử C có nối đôi phải được liên kết với các nguyên tử hay nhóm nguyên tử khác nhau.
v Đồng phân quang học : chỉ xét ở chương trình cấp cao.
c. Cách viết đồng phân :
+ Xác định nối đôi, nối ba, vòng, các nhóm chức có thể có (tức xác định độ bất bão hòa a)
+ Viết các loại mạch C (thẳng, nhánh, vòng) kèm theo nối đôi, ba, nhóm chức (nếu có).
+ Thêm H vào cạnh C cho đủ hóa trị 4.
Trừ muối amoni, số liên kết π và vòng trong CxHyOzNt (N hóa trị 3) là :