Cấu hình electron của Sr, strontium (stronti) chương trình mới
Bài viết hướng dẫn cách viết Cấu hình electron của Sr, strontium (stronti) theo chương trình sách mới của ba bộ sách Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Cấu hình electron của Sr, strontium (stronti).
Bài viết dưới đây sẽ giúp em viết được cấu hình electron của nguyên tử strontium, biểu diễn electron trên các ô orbital, từ đó xác định vị trí của nguyên tố này trong bảng tuần hoàn và dự đoán một số tính chất đặc trưng của nó.
Cấu hình electron của Sr, strontium (stronti) chương trình mới
1. Cấu hình electron nguyên tử strontium (Z = 38)
- Strontium có kí hiệu hóa học là Sr.
- Strontium có số hiệu nguyên tử là 38 ⇒ nguyên tử Sr có 38 electron.
- Do có sự chèn mức năng lượng, theo trật tự phân mức năng lượng các electron được phân bố như sau: 1s22s22p63s23p64s23d104p65s2.
- Sau đó, sắp xếp các phân lớp theo đúng thứ tự lớp để thu được cấu hình electron của Sr là: 1s22s22p63s23p63d104s24p65s2.
Viết gọn: [Kr]5s2.
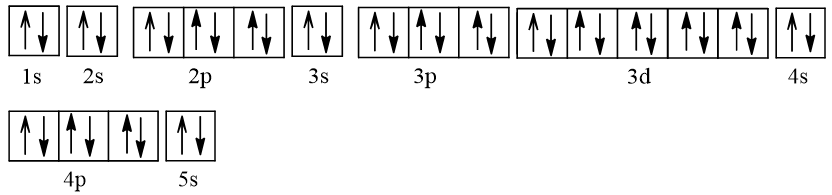
2. Cấu hình electron của nguyên tử strontium (Z = 38) theo ô orbital
- Cấu hình electron của nguyên tử strontium (Z = 38) theo ô orbital là:
- Nguyên tử Sr không có electron độc thân.
3. Mối quan hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
- Vị trí Sr trong bảng tuần hoàn:
Từ cấu hình electron của Sr là 1s22s22p63s23p63d104s24p65s2 ta xác định được:
+ Sr thuộc ô số 38 (do Z = 38)
+ Chu kì 5 (do có 5 lớp electron)
+ Nhóm IIA (do có 2 electron hóa trị, nguyên tố s).
- Tính chất nguyên tố:
+ Sr thuộc nhóm IIA nên Sr là kim loại kiềm thổ.
+ Trong các phản ứng hóa học, Sr có xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm gần nó nhất là Kr.
Sr ⟶ Sr2+ + 2e
+ Công thức oxide: SrO (là basic oxide)
+ Công thức hydroxide tương ứng: Sr(OH)2. (là base mạnh).
4. Ví dụ
Câu 1. Cho nguyên tố X có cấu hình electron nguyên tử lớp ngoài cùng và lớp sát ngoài cùng là 4s24p65s2. Vị trí của X trong bảng tuần hoàn là
A. ô thứ 10, chu kì 5, nhóm IIA
B. ô thứ 38, chu kì 5, nhóm IIA
C. ô thứ 28, chu kì 2, nhóm VA
D. ô thứ 28, chu kì 5, nhóm IIA
Hướng dẫn giải
Đáp án đúng là: B
X có cấu hình electron nguyên tử lớp ngoài cùng và lớp sát ngoài cùng là 4s24p65s2
⇒ cấu hình electron đầy đủ là: 1s22s22p63s23p63d10 là 4s24p65s2 ⇒ Z = 38
Z = 38 ⇒ X ở ô thứ 38
Có 5 lớp electron ⇒ X ở chu kì 5
X là nguyên tố s, có 2 electron lớp ngoài cùng ⇒ X thuộc nhóm IIA.
Câu 2: Nguyên tử của nguyên tố M có electron cuối cùng điền vào phân lớp s. Tổng số electron phân lớp s bằng 10. Cấu hình electron của nguyên tử M là
A. [He]4s2.
B. [Ne]5s2.
C. [Ar]4s2.
D. [Kr]5s2.
Lời giải:
Đáp án đúng là: D
Nguyên tố M có electron cuối cùng điền vào phân lớp s nên cấu hình electron của nguyên tử M có dạng nsa. (a = 1 hoặc a = 2)
Nguyên tử M có 10 electron phân lớp s.
⇒ Số electron trên các phân lớp s là 1s2, 2s2, 3s2, 4s2 và 5s2.
⇒ Cấu hình electron của nguyên tử M là [Kr]5s2.
Xem thêm cách viết cấu hình electron của các nguyên tố hóa học hay, chi tiết khác:
Cấu hình electron của H, hydrogen (hiđro) chương trình mới
Cấu hình electron của He, helium (heli) chương trình mới
Cấu hình electron của Li, lithium (liti) chương trình mới
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)