Cấu hình electron của Li, lithium (liti) chương trình mới
Bài viết hướng dẫn cách viết Cấu hình electron của Li, lithium (liti) theo chương trình sách mới của ba bộ sách Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Cấu hình electron của Li, lithium (liti).
Cấu hình electron của nguyên tử lithium (liti) được viết như thế nào? Từ cấu hình electron của nguyên tử lithium sẽ giúp ta suy ra điều gì? Bài viết bên dưới sẽ giúp các em giải quyết những thắc mắc trên.
Cấu hình electron của Li, lithium (liti) chương trình mới
1. Cấu hình electron nguyên tử lithium (Z = 3)
- Lithium có kí hiệu hóa học là Li. Số hiệu nguyên tử Z = 3
⇒ Nguyên tử Li có 3 electron.
- Cấu hình electron nguyên tử lithium là 1s22s1.
Viết gọn: [He]2s1.
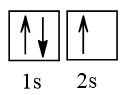
2. Cấu hình electron nguyên tử lithium (Z = 3) theo ô orbital.
- Cấu hình electron nguyên tử lithium (Z = 3) theo ô orbital là:
- Nguyên tử Li có 1 electron độc thân, thuộc AO 2s.
3. Mối liên hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
- Vị trí Li trong bảng tuần hoàn:
Từ cấu hình electron của Li là 1s22s1 sẽ xác định được:
+ Li thuộc ô thứ 3 (do Z = 3).
+ Chu kì 2 (do có 2 lớp electron).
+ Nhóm IA (do có 1 electron hóa trị, nguyên tố s).
+ Là nguyên tố s (do cấu hình electron lớp ngoài cùng là 2s1).
- Tính chất nguyên tố:
+ Li thuộc nhóm IA ⇒ là kim loại kiềm.
+ Li có 1 electron ở lớp ngoài cùng, có xu hướng nhường đi 1 electron này khi hình thành liên kết hóa học để đạt cấu hình bền vững của khi hiếm He ⇒ Li có tính khử mạnh.
+ Hóa trị cao nhất với oxygen: I
+ Công thức oxide cao nhất: Li2O (là basic oxide)
+ Công thức base tương ứng: LiOH (là base mạnh)
4. Ví dụ
Câu 1: Nguyên tử nguyên tố X có 1 electron duy nhất ở lớp thứ 2. Vị trí của X trong bảng tuần hoàn là
A. ô 1, chu kì 2, nhóm IVA.
B. ô 2, chu kì 2, nhóm IA.
C. ô 3, chu kì 2, nhóm IA.
D. ô 3, chu kì 3, nhóm VIIIA.
Lời giải:
Đáp án đúng là: C
Nguyên tử nguyên tố X có 1 electron duy nhất ở lớp thứ 2 ⇒ Cấu hình electron của X là:
1s22s1
Dựa vào cấu hình electron, suy ra:
+ X thuộc ô thứ 3 (do Z = 3);
+ X thuộc chu kì 2 (do có 2 lớp electron)
+ Nhóm IA (do có 1 electron hóa trị).
Câu 2: M là nguyên tố s. Tổng số hạt mang điện trong nguyên tử của nguyên tố M là 6. Số electron độc thân trong nguyên tử nguyên tố M là
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: A
M là nguyên tố s nên M thuộc nhóm A.
Tổng số hạt mang điện trong nguyên tử của nguyên tố M là 6 ⇒ Số p = số e = 3
⇒ Cấu hình electron của M là 1s22s1.
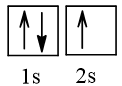
⇒ Cấu hình electron nguyên tử M theo ô orbital là:
⇒ Nguyên tử M có 1 electron độc thân, thuộc AO 2s.
Xem thêm cách viết cấu hình electron của các nguyên tố hóa học hay, chi tiết khác:
Cấu hình electron của H, hydrogen (hiđro) chương trình mới
Cấu hình electron của He, helium (heli) chương trình mới
Cấu hình electron của Be, beryllium (beri) chương trình mới
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)