Lý thuyết Sự điện li (mới 2023 + Bài Tập) - Hóa học 11
Tóm tắt lý thuyết Hóa 11 Bài 1: Sự điện li ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 11 Bài 1.
Lý thuyết Hóa 11 Bài 1: Sự điện li
Bài giảng Hóa 11 Bài 1: Sự điện li
I. Hiện tượng điện li
1. Thí nghiệm
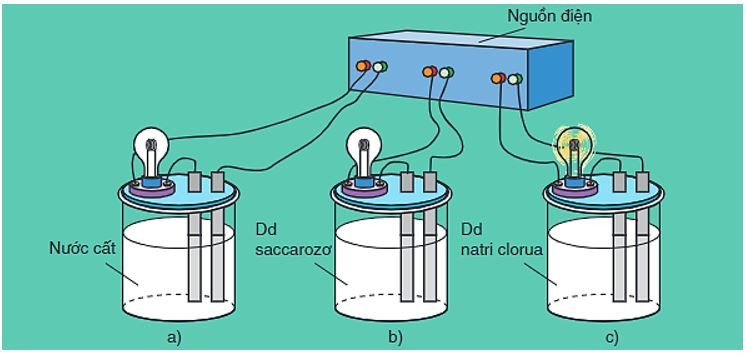
Hình 1: Bộ dụng cụ chứng minh tính dẫn điện của dung dịch
- Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta chỉ thấy bóng đèn ở cốc đựng dung dịch NaCl bật sáng.
⇒ Dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozơ không dẫn điện.
- Nếu làm các thí nghiệm tương tự, người ta thấy:
+ NaCl rắn, khan; NaOH rắn, khan; các dung dịch ancol etylic (C2H5OH), glixerol (C3H5(OH)3) không dẫn điện.
+ Các dung dịch axit, bazơ và muối đều dẫn điện.
2. Nguyên nhân tính dẫn điện của các dung dịch axit, bazơ và muối trong nước
Nguyên nhân: Các dung dịch axit, bazơ và muối dẫn điện được là do trong dung dịch của chúng có các tiểu phân mang điện tích chuyển động tự do được gọi là các ion.
3. Các khái niệm cần nắm vững
- Sự điện li là quá trình phân li các chất trong nước ra ion.
- Chất điện li là những chất khi tan trong nước phân li ra ion.
⇒ Axit, bazơ và muối là những chất điện li.
- Sự điện li được biểu diễn bằng phương trình điện li.
Ví dụ:
- Muối phân li thành cation kim loại (hoặc cation amoni) và anion gốc axit:
NH4Cl → NH4+ + Cl-
- Axit phân li thành cation H+ và anion gốc axit:
- Bazơ phân li thành cation kim loại và anion hiđroxit:
Chú ý: Nhiều chất khi nóng chảy cũng phân li ra ion, nên ở trạng thái nóng chảy các chất này dẫn điện được.
II. Phân loại các chất điện li
Dựa vào mức độ phân li ra ion, chất điện li được chia thành hai loại:
1. Chất điện li mạnh
- Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion.
- Những chất điện li mạnh là:
+ Các axit mạnh như HCl, HNO3, HClO4, H2SO4, ...;
+ Các bazơ mạnh như NaOH, KOH, Ba(OH)2 ,...
+ Hầu hết các muối.
- Phương trình điện li, người ta dùng một mũi tên chỉ chiều của quá trình điện li.
Ví dụ:
2. Chất điện li yếu
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử hoà tan phân li ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
- Những chất điện li yếu là:
+ Các axit yếu như CH3COOH, HClO, H2S, HF, H2SO3, ... ;
+ Các bazơ yếu như Bi(OH)3, Mg(OH)2, ...
+ Một số muối: HgCl2; Hg(CN)2; …
+ Nước (H2O).
- Trong phương trình điện li của chất điện li yếu, người ta dùng hai mũi tên ngược chiều nhau.
- Sự phân li của chất điện li yếu là quá trình thuận nghịch, khi nào tốc độ phân li và tốc độ kết hợp các ion tạo thành phân tử bằng nhau cân bằng của quá trình điện li được thiết lập.
Ví dụ:
Lưu ý: Cân bằng điện li là cân bằng động và tuân theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê.
Trắc nghiệm Hóa 11 Bài 1: Sự điện li
Câu 1: Các chất dẫn điện là
A. KCl nóng chảy, dung dịch NaOH, dung dịch HNO3.
B. Dung dịch glucozơ, dung dịch ancol etylic, glixerol.
C. KCl rắn khan, NaOH rắn khan, kim cương.
D. Khí HCl, khí NO, khí O3.
Đáp án: A
Giải thích:
Chất dẫn điện là các chất có thể phân li thành các ion.
KCl → K+ + Cl-
NaOH → Na+ + OH-
Chú ý: Một số chất nóng chảy cũng có thể phân li ra ion.
Câu 2: Trộn 200 ml dung dịch chứa 12 gam MgSO4 với 300 ml dung dịch chứa 34,2 gam Al2(SO4)3 thu được dung dịch X. Nồng độ ion trong X là
A. 0,2M.
B. 0,8M.
C. 0,6M.
D. 0,4M.
Đáp án: B
Giải thích:
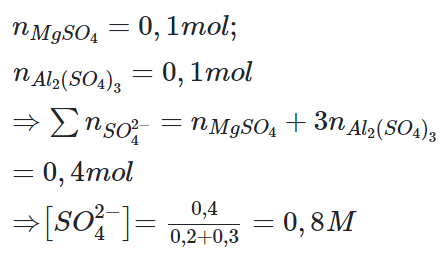
Câu 3: Một dung dịch chứa các ion: Cu2+ (0,02 mol), K+ (0,10 mol), (0,05 mol) và (x mol). Giá trị của x là
A. 0,050.
B. 0,070.
C. 0,030.
D. 0,045.
Đáp án: D
Giải thích:
Áp dụng bảo toàn số mol điện tích ta có:
2. 0,02 + 0,1 = 0,05 + 2x
x = 0,045mol
Câu 4: Trong dung dịch axit nitric (bỏ qua sự phân li của H2O) có những phần tử nào ?
A. H+, .
B. H+, , H2O.
C. H+, , HNO3.
D. H+, , HNO3, H2O.
Đáp án: B
Giải thích:
→ Trong dung dịch axit nitric, bỏ qua sự phân li của nước có các phần tử và H2O.
Câu 5: Chất nào sau đây không dẫn điện được ?
A. KCl rắn, khan.
B. NaOH nóng chảy.
D. HBr hòa tan trong nước
Đáp án: A
Giải thích: KCl rắn, khan thì không dẫn điện.
Câu 6: Chất nào sau đây là chất điện li mạnh?
A. NaCl
B. CH3COOH
C. H2O
D. HF
Đáp án: A
Giải thích:
Hầu hết các muối đều là chất điện li mạnh (trừ HgCl2, Hg(CN)2,..).
Câu 7: Chất nào sau đây là chất điện li?
A. HCl
B. C6H6
C. CH4
D. C2H5OH
Đáp án: A
Giải thích:
Chất điện li là chất tan trong nước phân li ra các ion.
Câu 8: Phương trình điện li nào sau đây không đúng?
A. CH3COOH
B. HCl →
C. H3PO4 →
D. Na3PO4 →
Đáp án: C
Giải thích:
Vì H3PO4 là chất điện li yếu.
H3PO4
Câu 9: Dung dịch nào sau đây không dẫn điện được ?
A. Ca(OH)2
B. CH3OH
C. HCl
D. Al2(SO4)3
Đáp án: B
Giải thích:
- Khi tan trong nước các dung dịch có khả năng phân li ra ion là:
- CH3OH không có khả năng phân li ion nên không dẫn điện.
Câu 10: Chất nào dưới đây thuộc loại chất điện li yếu?
A. HF.
B. KCl.
C. NaOH.
D. H2SO4.
Đáp án: A
Giải thích:
KCl, NaOH, H2SO4 là chất điện li mạnh.
HF là chất điện li yếu.
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 đầy đủ, chi tiết khác:
Lý thuyết Bài 2: Axit, bazo và muối
Lý thuyết Bài 3: Sự điện li của nước. pH. Chất chỉ thị axit – bazơ
Lý thuyết Bài 4: Phản ứng trao đổi ion trong dung dịch các chất điện li
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
