Lý thuyết Metan (mới 2024 + Bài Tập) - Hóa học 9
Tóm tắt lý thuyết Hóa 9 Bài 36: Metan ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 9 Bài 36.
Lý thuyết Hóa 9 Bài 36: Metan
Bài giảng Hóa 9 Bài 36: Metan
Công thức phân tử metan: CH4
Phân tử khối: 16
I. Trạng thái tự nhiên, tính chất vật lí
- Trong tự nhiên, metan có nhiều trong các mỏ khí (khí thiên nhiên), trong mỏ dầu (khí mỏ dầu), trong các mỏ than (khí mỏ than), trong bùn ao (khí bùn ao), trong khí biogas.
- Metan là chất khí, không màu, không mùi, nhẹ hơn không khí () và tan rất ít trong nước.
Hình 1: Khí metan có trong bùn ao
II. Cấu tạo phân tử
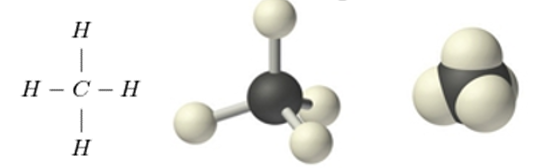
Hình 2: Công thức cấu tạo và mô hình phân tử metan dạng rỗng và dạng đặc.
- Quan sát công thức cấu tạo của metan thấy giữa nguyên tử cacbon và nguyên tử hiđro chỉ có một liên kết. Những liên kết như vậy là liên kết đơn.
⇒ Trong phân tử metan có bốn liên kết đơn.
III. Tính chất hóa học
1. Tác dụng với oxi
- Khi đốt trong oxi, metan cháy tạo thành khí CO2 và H2O. Phản ứng tỏa nhiều nhiệt.
CH4 + 2O2 CO2 + 2H2O
- Hỗn hợp gồm 1 thể tích metan và 2 thể tích oxi là hỗn hợp nổ mạnh.
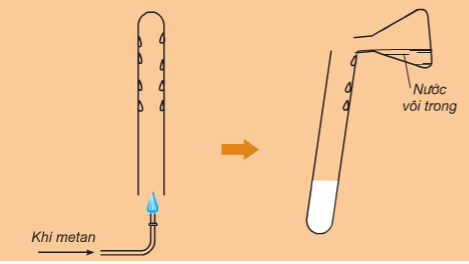
Hình 3: Phản ứng cháy của metan
2. Tác dụng với clo khi có ánh sáng
- Phương trình hóa học:
Viết gọn: CH4 + Cl2 CH3Cl (metyl clorua) + HCl
- Ở phản ứng này, nguyên tử H của metan được thay thế bởi nguyên tử Cl, vì vậy phản ứng này được gọi là phản ứng thế.
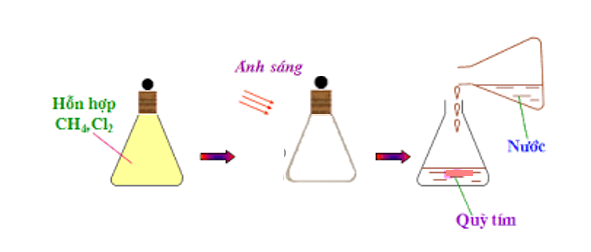
Hình 4: Phản ứng của clo với metan.
IV. Ứng dụng
- Metan cháy tỏa nhiều nhiệt nên được đùng làm nhiên liệu trong đời sống và trong sản xuất.
- Metan là nguyên liệu dùng điều chế hiđro theo sơ đồ:
Metan + H2O cacbon đioxit + hiđro
- Metan còn được dùng để điều chế bột than và nhiều chất khác.
Trắc nghiệm Hóa học 9 Bài 36: Metan
Câu 1: Đốt cháy hợp chất hữu cơ nào sau đây thu được số mol CO2 nhỏ hơn số mol H2O?
A. CH4
B. C4H6
C. C2H4
D. C6H6
Câu 2: Ứng dụng của metan là
A. Metan cháy tỏa nhiều nhiệt nên được đùng làm nhiên liệu trong đời sống và trong sản xuất.
B. Metan là nguyên liệu dùng điều chế hiđro.
C. Metan còn được dùng để điều chế bột than và nhiều chất khác.
D. Cả A, B, C đều đúng.
Câu 3: Đốt cháy 4,8 gam metan trong oxi, sau phản ứng thu được V lít khí CO2. Giá trị của V là
A. 3,36 lít
B. 4,48 lít
C. 5,60 lít
D. 6,72 lít
Câu 4: Tính chất vật lý của metan là
A. Chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
B. Chất lỏng, không màu, tan nhiều trong nước.
C. Chất khí, không màu, mùi xốc, nặng hơn không khí, ít tan trong nước.
D. Chất khí, màu vàng lục, tan nhiều trong nước.
Câu 5: Phản ứng hóa học đặc trưng của metan là
A. Phản ứng phân hủy
B. Phản ứng tách
C. Phản ứng cộng
D. Phản ứng thế
Câu 6: Thể tích khí oxi cần dùng để đốt cháy hết 4,48 lít khí metan là
A. 6,72 lít
B. 8,96 lít
C. 9,52 lít
D. 10,08 lít
Câu 7: Tính chất hóa học nào sau đây không phải của metan?
A. Làm mất màu dung dịch nước brom.
B. Tác dụng với oxi tạo thành CO2 và nước.
C. Tham gia phản ứng thế.
D. Tác dụng với clo khi có ánh sáng.
Câu 8: Điều kiện để xảy ra phản ứng giữa metan và khí clo là
A. Có ánh sáng
B. Có axit làm xúc tác
C. Có sắt làm xúc tác
D. Làm lạnh.
Câu 9: Khối lượng CO2 và H2O thu được khi đốt cháy 16 gam khí metan là
A. 44 gam và 36 gam
B. 44 gam và 18 gam
C. 22 gam và 18 gam
D. 22 gam và 36 gam
Câu 10: Chọn câu đúng trong các câu sau:
A. Metan có nhiều trong khí quyển.
B. Metan có nhiều trong nước biển.
C. Metan có nhiều trong nước ao, hồ.
D. Metan có nhiều trong các mỏ khí, mỏ dầu và mỏ than.
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
