Lý thuyết Nhôm (mới 2024 + Bài Tập) - Hóa học 9
Tóm tắt lý thuyết Hóa 9 Bài 18: Nhôm ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 9 Bài 16.
Lý thuyết Hóa 9 Bài 18: Nhôm
Bài giảng Hóa 9 Bài 18: Nhôm
I. Tính chất vật lí
Nhôm là kim loại màu trắng bạc, có ánh kim, dẻo, dẫn điện và dẫn nhiệt tốt. Nhôm là kim loại nhẹ (D = 2,7 g/cm3), mềm, nóng chảy ở 660°C.

Hình 1: Khối kim loại nhôm
Độ dẫn điện của nhôm bằng 2/3 độ dẫn điện của đồng.
II. Tính chất hóa học
1. Nhôm có những tính chất hóa học của kim loại
a) Phản ứng với oxi và một số phi kim
Nhôm phản ứng với oxi tạo thành oxit và phản ứng với nhiều phi kim khác như S, Cl2 tạo thành muối.
Ví dụ:
4Al + 3O2 2Al2O3
2Al + 3Cl2 2AlCl3
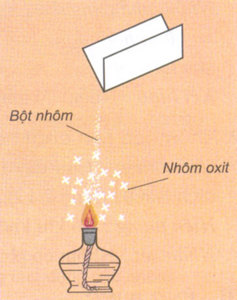
Hình 2: Thí nghiệm đốt bột nhôm trong không khí
Chú ý: Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
b) Phản ứng với axit (HCl, H2SO4 loãng,…) giải phóng H2.
Ví dụ:
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2

Hình 3: Nhôm tác dụng với H2SO4 loãng
Chú ý: Nhôm không tác dụng với H2SO4 đặc nguội và HNO3 đặc, nguội,
c) Phản ứng với dung dịch muối của kim loại yếu hơn.
Nhôm phản ứng được với nhiều dung dịch muối của những kim loại hoạt động hóa học yếu hơn tạo ra muối nhôm và kim loại mới.
Ví dụ:
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu

Hình 4: Nhôm tác dụng với CuSO4
2. Nhôm có tính chất hóa học nào khác?
Nhôm phản ứng với dung dịch kiềm.
Ví dụ:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2

Hình 5: Nhôm tác dụng với NaOH
III. ỨNG DỤNG
Nhôm và hợp kim của nhôm được sử dụng rộng rãi trong đời sống: đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng....
Đuyra (hợp kim của nhôm) nhẹ và bền được dùng trong công nghiệp chế tạo máy bay, ô tô, tàu vũ trụ…
IV. SẢN XUẤT NHÔM
Nguyên liệu: quặng bôxit có thành phần chủ yếu là Al2O3.
Phương trình hóa học:
2Al2O3 4Al+3O2
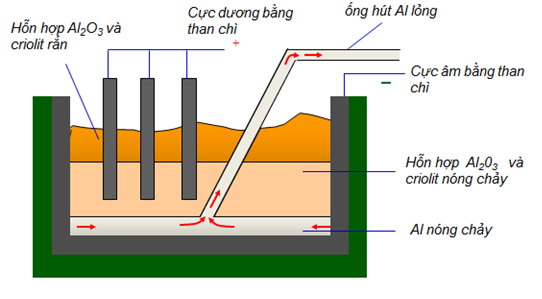
Hình 6: Sơ đồ bể điện phân Al2O3 nóng chảy
Trắc nghiệm Hóa học 9 Bài 18: Nhôm
Câu 1: Nhôm có tính chất vật lí là
A. Màu trắng bạc, nhẹ, có ánh kim, dẫn điện và dẫn nhiệt tốt.
B. Màu trắng bạc nặng, có ánh kim, dẫn điện và dẫn nhiệt tốt.
C. Màu trắng xám, nhẹ, có ánh kim, dẫn điện và nhiệt kém.
D. Màu trắng xám, nặng, có ánh kim, dẫn điện và nhiệt kém.
Câu 2: Quặng boxit là nguyên liệu chính dùng để điều chế kim loại
A. Al.
B. Fe.
C. Cu.
D. Zn.
Câu 3: Nhôm không phản ứng được với dung dịch
A. FeSO4.
B. HNO3 đặc, nguội.
C. HCl loãng, dư.
D. NaOH.
Câu 4: Các đồ vật bằng nhôm bền trong không khí và nước do
A. Có một lớp Al(OH)3 bên ngoài bảo vệ.
B. Có một lớp Al2O3 bên ngoài bảo vệ.
C. Nhôm không tan trong nước.
D. Nhôm bền, không bị oxi hóa.
Câu 5: Cách nào sau đây không phá hủy các đồ dùng làm bằng nhôm
A. Dùng nước chanh làm sạch bề mặt nhôm.
B. Rửa sạch, lau khô và để chỗ khô ráo sau khi sử dụng.
C. Dùng đồ làm bằng nhôm để đựng nước vôi.
D. Dùng đồ làm bằng nhôm để đựng nước biển.
Câu 6: Cho 5,4 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được khí H2 (ở đktc). Thể tích khí H2 là
A. 4,48 lít.
B. 6,72 lít.
C. 8,96 lít.
D. 5,04 lít.
Câu 7: Cho 2,04 gam oxit của một kim loại có công thức là M2O3 tác dụng vừa đủ 600mL dung dịch HCl 0,2M. Công thức oxit đó là
A. Fe2O3.
B. Al2O3.
C. Cr2O3.
D. Mn2O3.
Câu 8: Cho 10,8 gam một kim loại M (hóa trị III) phản ứng với khí clo tạo thành 53,4 gam muối. Kim loại M là
A. Na.
B. Fe.
C. Al.
D. Mg.
Câu 9: Hòa tan 9,72 gam Al bằng dung dịch H2SO4 loãng thu được V lit khí H2 (đktc). Giá trị của V là
A. 12,096.
B. 4,032.
C. 24,192.
D. 8,064.
Câu 10: Phần trăm theo khối lượng của Al có trong là
A. 79,07%.
B. 74,32%.
C. 25,68%.
D. 20,93%.
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 20: Hợp kim sắt: gang, thép
Lý thuyết Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
