Lý thuyết Một số axit quan trọng (mới 2024 + Bài Tập) - Hóa học 9
Tóm tắt lý thuyết Hóa 9 Bài 4: Một số axit quan trọng ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 9 Bài 4.
Lý thuyết Hóa 9 Bài 4: Một số axit quan trọng
Bài giảng Hóa 9 Bài 4: Một số axit quan trọng
I. Axit clohiđric (công thức hóa học: HCl)
- Khi hòa tan khí hiđro clorua (HCl, thể khí) vào nước ta thu được dung dịch axit clohiđric (HCl, thể lỏng).
- Dung dịch HCl đậm đặc là dung dịch bão hòa hiđro clorua, có nồng độ khoảng 37%, từ đây ta có thể pha chế thành dung dịch HCl có nồng độ khác nhau.
1. Tính chất hóa học
Axit clohiđric có đầy đủ tính chất của một axit mạnh.
a) Làm đổi màu quỳ tím thành đỏ:
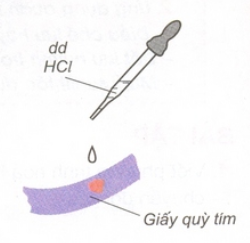
Hình 1: HCl làm đổi màu quỳ tím
b) Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) tạo thành muối clorua và giải phóng khí hiđro
Ví dụ:
6HCl + 2Al → 2AlCl3 + 3H2 (↑)
2HCl + Mg → MgCl2 + H2 (↑)

Hình 2: Mg tác dụng với HCl
Chú ý:
- Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với HCl.
- Các kim loại có nhiều hóa trị như Fe, Cr … khi tác dụng với HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
2HCl + Fe → FeCl2 + H2 (↑)
c) Tác dụng với bazơ tạo thành muối clorua và nước.
Ví dụ:
HCl + NaOH → NaCl + H2O
2HCl + Ba(OH)2 → BaCl2 + 2H2O
d) Tác dụng với oxit bazơ tạo thành muối clorua và nước.
Ví dụ:
2HCl + FeO → FeCl2 + H2O
2HCl + Na2O → 2NaCl + H2O
e) Tác dụng với một số muối tạo thành muối clorua và axit mới
Ví dụ:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
2HCl + CaCO3 → CaCl2 + CO2↑ + H2O

Hình 3: CaCO3 tác dụng với HCl
2. Ứng dụng
Axit clohiđric dùng để:
- Điều chế các muối clorua.
- Làm sạch bề mặt kim loại trước khi hàn.
- Tẩy gỉ kim loại trước khi sơn, tráng, mạ kim loại.
- Dùng trong chế biến thực phẩm, dược phẩm…
II. Axit sunfuric (công thức hóa học H2SO4)
1. Tính chất vật lí
- Axit H2SO4 là chất lỏng sánh, không màu, nặng gấp hai lần nước (ở nồng độ 98% có d = 1,83 g/cm3), không bay hơi, tan dễ dàng trong nước và tỏa rất nhiều nhiệt.
- Để pha loãng axit sunfuric đặc an toàn: Rót từ từ axit đặc vào bình đựng sẵn nước rồi khuấy đều bằng đũa thủy tinh. Tuyệt đối không được làm ngược lại.
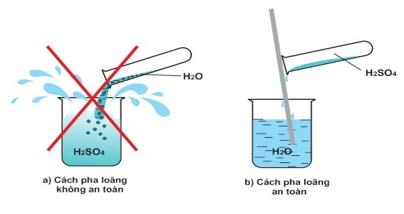
Hình 4: Cách pha loãng H2SO4 đặc
2. Tính chất hóa học
Axit H2SO4 loãng và H2SO4 đặc có những tính chất hóa học khác nhau.
a. Tính chất hóa học của axit H2SO4 loãng
H2SO4 loãng có đầy đủ tính chất của một axit mạnh.
- Làm đổi màu quỳ tím thành đỏ
- Tác dụng với nhiều kim loại (Mg, Al, Zn, Fe,...) tạo thành muối sunfat và giải phóng khí hiđro.
Ví dụ:
H2SO4 (loãng) + Mg → MgSO4 + H2 (↑)
3H2SO4 (loãng) + 2Al → Al2(SO4)3 + 3H2 (↑)
Chú ý: Các kim loại Hg, Cu, Ag, Au, Pt …không tác dụng với H2SO4 loãng.
Khi Fe tác dụng với H2SO4 loãng, sản phẩm thu được là muối sắt (II)
H2SO4 (loãng) + Fe → FeSO4 + H2 (↑)
- Tác dụng với bazơ tạo thành muối sunfat và nước.
Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
H2SO4 + 2KOH → K2SO4 + 2H2O
- Tác dụng với oxit bazơ tạo thành muối sunfat và nước.
Ví dụ:
H2SO4 + CuO → CuSO4 + H2O
H2SO4 + Na2O → Na2SO4 + H2O
- Tác dụng với một số muối tạo thành muối sunfat và axit mới
Ví dụ:
MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O
b. Axit H2SO4 đặc có tính chất hóa học riêng
- Tác dụng với kim loại
Axit H2SO4 đặc, nóng tác dụng với nhiều kim loại tạo thành muối sunfat (ứng với hóa trị cao của kim loại nếu kim loại có nhiều hóa trị) và khí sunfurơ (không giải phóng khí hiđro).
Ví dụ:
Cu + 2H2SO4 (đặc) CuSO4 + SO2 ↑ + 2H2O
2Fe + 6H2SO4 (đặc) Fe2(SO4)3 + 3SO2 ↑ + 6H2O

Hình 5: Phản ứng của Cu với H2SO4
- Tính háo nước
Axit sunfuric đặc chiếm nước kết tinh của nhiều muối ngậm nước, hoặc chiếm các nguyên tố H và O (thành phần của nước) trong nhiều hợp chất.
Ví dụ:
Khi cho axit H2SO4 đặc vào đường, đường sẽ hóa thành than.
C12H22O11 12C + 11H2O
Sau đó một phần C sinh ra lại bị H2SO4 đặc oxi hóa:
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O

Hình 6: H2SO4 đặc tác dụng với đường.
3. Ứng dụng
Hàng năm, thế giới sản xuất gần 200 triệu tấn axit H2SO4 .
Axit H2SO4 là nguyên liệu của nhiều ngành sản xuất như sản xuất phân bón, phẩm nhuộm, chế biến dầu mỏ,..
Hình 6: Sơ đồ về một số ứng dụng của axit sunfuric
4. Sản xuất axit H2SO4
Trong công nghiệp, axit sunfuric được sản xuất bằng phương pháp tiếp xúc. Nguyên liệu là lưu huỳnh (hoặc quặng pirit sắt), không khí và nước.
Quá trình sản xuất axit H2SO4 gồm 3 công đoạn sau:
- Sản xuất lưu huỳnh đioxit bằng cách đốt lưu huỳnh hoặc pirit sắt trong không khí;
S + O2 SO2
Hoặc 4FeS2 + 11O2 8SO2 + 2Fe2O3
- Sản xuất lưu huỳnh trioxit bằng cách oxi hóa SO2, có xúc tác là V2O5 ở 4500C
2SO2 + O2 2SO3
Sản xuất axit H2SO4 bằng cách cho SO3 tác dụng với nước:
SO3 + H2O → H2SO4
5. Nhận biết axit H2SO4 và muối sunfat
- Để nhận ra axit H2SO4 và dung dịch muối sunfat ta dùng thuốc thử là dung dịch muối bari (như BaCl2; Ba(NO3)2 …). Phản ứng tạo thành kết tủa trắng BaSO4 không tan trong nước và trong axit.

Hình 7: Kết tủa trắng BaSO4
- Phương trình hóa học:
H2SO4 + BaCl2 → 2HCl + BaSO4 ↓
Na2SO4 + BaCl2 → 2NaCl + BaSO4 ↓
Chú ý: Để phân biệt axit sunfuric và muối sunfat, ta có thể dùng một số kim loại như Mg, Zn, Al, Fe …
Trắc nghiệm Hóa học 9 Bài 4: Một số axit quan trọng
Câu 1: Chất nào dưới đây không dùng để phân biệt dung dịch Na2SO4 và dung dịch H2SO4 loãng?
A. MgO
B. Mg(OH)2
C. Mg
D. Cu
Câu 2: Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
A. Cho cả nước và axit vào cùng một lúc
B. Rót từng giọt nước vào axit
C. Rót từ từ axit vào nước và khuấy đều
D. Cả 3 cách trên đều được
Câu 3: Để hòa tan vừa hết 6,72 gam sắt phải dùng bao nhiêu ml hỗn hợp dung dịch HCl 0,2M và H2SO4 0,5M?
A. 100 ml
B. 150 ml
C. 250 ml
D. 200 ml
Câu 4: Kim loại nào sau đây không tác dụng với dung dịch axit H2SO4 loãng?
A. K
B. Mg
C. Zn
D. Ag
Câu 5: Ứng dụng của axit clohidric được dùng để
A. Điều chế các muối clorua
B. Làm sạch bề mặt kim loại trước khi hàn
C. Chế biến thực phẩm, dược phẩm
D. A, B, C đều đúng
Câu 6: Cho 8,1 gam kẽm oxit tác dụng vừa đủ với dung dịch axit HCl, sau phản ứng thu được m gam muối. Giá trị của m là
A. 12,6 gam
B. 13,6 gam
C. 14,6 gam
D. 15,6 gam
Câu 7: Chất nào sau đây khi tác dụng với H2SO4 loãng sinh ra dung dịch có màu xanh lam?
A. Zn
B. CaO
C. K2O
D. CuO
Câu 8: Cho 1,08 gam nhôm tác dụng với axit clohidric dư, sau phản ứng thu được V lít khí H2 ở đktc. Giá trị của V là
A. 2,224 lít
B. 1,344 lít
C. 3,336 lít
D. 4,448 lít
Câu 9: Chất nào sau đây tác dụng với dung dịch HCl loãng sinh ra chất khí cháy được trong không khí?
A. Na2O
B. MgO
C. Zn
D. Ca(OH)2
Câu 10: Oxit tác dụng được với axit clohiđric là
A. SO2
B. NO2
C. P2O5
D. BaO
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 5: Luyện tập tính chất hóa học của oxit và axit
Lý thuyết Bài 7: Tính chất hóa học của bazơ
Lý thuyết Bài 8: Một số bazơ quan trọng
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
