Lý thuyết Tính chất hóa học của bazơ (mới 2024 + Bài Tập) - Hóa học 9
Tóm tắt lý thuyết Hóa 9 Bài 7: Tính chất hóa học của bazơ ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 9 Bài 1.
Lý thuyết Hóa 9 Bài 7: Tính chất hóa học của bazơ
Bài giảng Hóa 9 Bài 7: Tính chất hóa học của bazơ
I. Phân loại bazơ
Dựa vào tính tan của bazơ trong nước, người ta chia bazơ thành 2 loại:
- Bazơ tan được trong nước tạo thành dung dịch bazơ (gọi là kiềm): LiOH, NaOH, KOH, Ba(OH)2, Ca(OH)2, ….
- Bazơ không tan trong nước: Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3…
II. Tính chất hóa học của bazơ
1) Tác dụng với chất chỉ thị màu.
- Dung dịch bazơ làm quỳ tím đổi thành màu xanh.
- Dung dịch bazơ làm phenolphtalein không màu đổi sang màu đỏ.
Ví dụ:
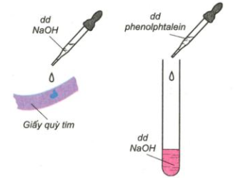
Hình 1: Tác dụng của bazơ với chất chỉ thị màu.
2) Tác dụng của dung dịch bazơ với oxit axit
Tổng quát: Dung dịch bazơ (kiềm) + oxit axit → muối + nước
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
Ba(OH)2 + CO2 → BaCO3 ↓ + H2O
3) Tác dụng của bazơ với axit:
Tổng quát: Bazơ + axit → muối + nước
Ví dụ:
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
Phản ứng giữa bazơ và axit được gọi là phản ứng trung hòa.
4) Tác dụng của dung dịch bazơ với dung dịch muối
Dung dịch bazơ tác dụng được với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Ba(OH)2 + Na2CO3 → BaCO3 (↓) + 2NaOH

Hình 2: Kết tủa Cu(OH)2 tạo thành sau phản ứng
5) Bazơ không tan bị nhiệt phân hủy thành oxit và nước.
Ví dụ:
Cu(OH)2 CuO + H2O
2Fe(OH)3 Fe2O3 + 3H2O
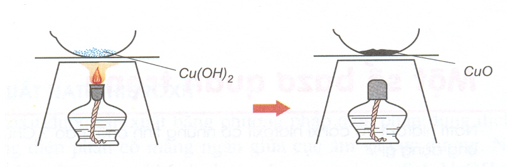
Hình 3: Cu(OH)2 bị nhiệt phân hủy.
Trắc nghiệm Hóa học 9 Bài 7: Tính chất hóa học của bazo
Câu 1: Tính chất hóa học của bazơ là
A. Tác dụng với chất chỉ thị màu
B. Tác dụng với oxit axit, axit
C. Tác dụng với dung dịch muối
D. A, B, C đều đúng
Câu 2: Để nhận biết dd KOH và dd Ba(OH)2 ta dùng thuốc thử là:
A. Phenolphtalein
B. Quỳ tím
C. dd H2SO4
D. dd HCl
Câu 3: Cho các bazơ sau: KOH, Ca(OH)2, Mg(OH)2, Al(OH)3, Zn(OH)2, Cu(OH)2. Những bazơ tác dụng được với dung dịch HCl là
A. KOH, Cu(OH)2
B. Ca(OH)2, Zn(OH)2
C. Mg(OH)2, Al(OH)3
D. Cả A, B, C đều đúng
Câu 4: Cho 200ml dung dịch Ca(OH)2 1M tác dụng vừa đủ với dung dịch HCl, thu được m gam muối. Giá trị của m là
A. 22,2 gam
B. 24,2 gam
C. 25,4 gam
D. 23,6 gam
Câu 5: Cho các chất dưới đây, dãy chất nào toàn là dung dịch kiềm?
A. NaOH, KOH, Mg(OH)2
B. Cu(OH)2, Zn(OH)2, Ba(OH)2
C. Al(OH)3, Ca(OH)2, KOH
D. Ca(OH)2, NaOH, KOH
Câu 6: Cho 24,8 gam natri oxit (Na2O) tác dụng với nước, thu được 0,4 lít dung dịch bazơ (NaOH) xM. Giá trị của x là
A. 1M
B. 2M
C. 3M
D. 4M
Câu 7: Cặp chất không tồn tại trong một dung dịch (chúng xảy ra phản ứng với nhau) là
A. CuSO4 và KOH
B. CuSO4 và NaCl
C. MgCl2 và Ba(NO3)2
D. AlCl3 và Mg(NO3)2
Câu 8: Nhiệt phân hoàn toàn m gam Fe(OH)3 đến khối lượng không đổi thu được 32 gam chất rắn. Giá trị của m là
A. 42,8 gam
B. 43,2 gam
C. 44,5 gam
D. 45,1 gam
Câu 9: Nhóm các chất vừa tác dụng với H2SO4 vừa tác dụng được với dung dịch KOH là
A. NaOH, Ca(OH)2
B. Zn(OH)2, Al(OH)3
C. Mg(OH)2, KOH
D. Ba(OH)2, Cu(OH)2
Câu 10: Cho 150 ml dung dịch Ba(OH)2 4M vào 200 ml dung dịch H2SO4 2M. Khối lượng kết tủa thu được là
A. 90,8 gam
B. 91,6 gam
C. 92,4 gam
D. 93,2 gam
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 8: Một số bazơ quan trọng
Lý thuyết Bài 9: Tính chất hóa học của muối
Lý thuyết Bài 10: Một số muối quan trọng
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
