Lý thuyết Tính chất hóa học của bazơ: Một số bazơ quan trọng (mới 2024 + Bài Tập) - Hóa học 9
Tóm tắt lý thuyết Hóa 9 Bài 8: Một số bazơ quan trọng ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 9 Bài 8.
Lý thuyết Hóa 9 Bài 8: Một số bazơ quan trọng
Bài giảng Hóa 9 Bài 8: Một số bazơ quan trọng
I. Natri hiđroxit (công thức hóa học NaOH)
1. Tính chất vật lí
- Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
- Dung dịch NaOH có tính nhờn, làm bục vải giấy và ăn mòn da. Khi sử dụng NaOH phải hết sức cẩn thận!

Hình 1: Natri hiđroxit
2. Tính chất hóa học
Natri hiđroxit có đầy đủ tính chất của một bazơ tan (kiềm).
a) Làm đổi màu chất chỉ thị.
Dung dịch NaOH làm đổi màu quỳ tím thành xanh, đổi màu dung dịch phenolphatalein không màu thành màu đỏ.
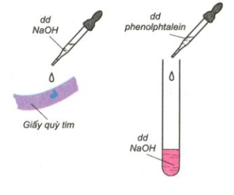
Hình 2: Tác dụng của NaOH với chất chỉ thị màu.
b. Tác dụng với axit tạo thành muối và nước (phản ứng trung hòa)
Ví dụ:
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
c. Tác dụng với oxit axit tạo thành muối và nước
Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O
2NaOH + SO2 → Na2SO3 + H2O
Chú ý: Nếu oxit axit dư, sản phẩm thu được còn có muối axit do:
CO2 dư + Na2CO3 + H2O → 2NaHCO3
SO2 dư + Na2SO3 + H2O → 2NaHSO3
d. Tác dụng với dung dịch muối.
Dung dịch NaOH có thể tác dụng được với nhiều dung dịch muối.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
3. Ứng dụng
Natri hiđroxit có nhiều ứng dụng trong đời sống và trong công nghiệp. Nó được dùng trong:
-Sản xuất xà phòng, chất tẩy rửa, bột giặt.
- Sản xuất giấy, tơ nhân tạo, trong chế biến dầu mỏ.
- Sản xuất nhôm (làm sạch quặng nhôm trước khi sản xuất).
- Chế biến dầu mỏ và nhiều ngành công nghiệp hóa chất khác.
4. Sản xuất natri hiđroxit
Trong công nghiệp, NaOH được sản xuất bằng phương pháp điện phân dung dịch NaCl bão hòa. Thùng điện phân có màng ngăn giữa cực âm và cực dương.
2NaCl + 2H2O 2NaOH + H2 + Cl2
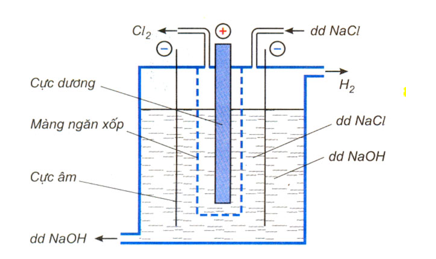
Hình 3: Sơ đồ bình điện phân dung dịch NaCl có màng ngăn
II. Canxi hiđroxit (công thức hóa học Ca(OH)2)
Dung dịch canxi hiđroxit có tên thông thường là nước vôi trong.
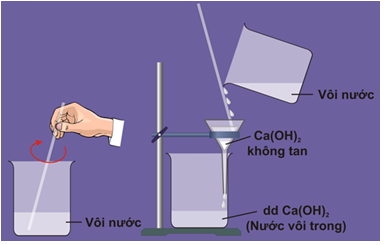
Hình 4: Pha chế dung dịch Ca(OH)2
1. Tính chất hóa học Ca(OH)2
Dung dịch Ca(OH)2 có tính chất hóa học của một bazơ tan.
a) Làm đổi màu chất chỉ thị
Dung dịch Ca(OH)2 làm đổi màu quỳ tím thành xanh, đổi màu dung dịch phenolphatalein không màu thành màu đỏ.
b) Tác dụng với axit
Ca(OH)2 tác dụng với axit, sản phẩm là muối và nước (phản ứng trung hòa)
Ví dụ
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
c) Tác dụng với oxit axit
Dung dịch Ca(OH)2 tác dụng với oxit axit sản phẩm là muối và nước
Ví dụ
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
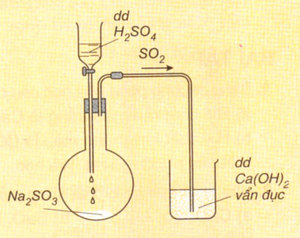
Hình 5: SO2 phản ứng với Ca(OH)2
Chú ý: Nếu oxit axit dư, sản phẩm thu được còn có muối axit do:
CO2 dư + CaCO3 + H2O → Ca(HCO3)2
SO2 dư + CaSO3 + H2O → Ca(HSO3)2
Ngoài ra dung dịch canxi hiđroxit còn tác dụng được với nhiều dung dịch muối.
2. Ứng dụng
Canxi hiđroxit có nhiều ứng dụng. Nó được dùng để:
- Làm vật liệu trong xây dựng.
- Khử chua đất trồng trọt.
- Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật…

Hình 6: Một số ứng dụng của Ca(OH)2
III. Thang PH
Thang pH để biểu thị độ axit, độ bazơ của dung dịch:
- Nếu pH = 7: Dung dịch là trung tính (không có tính axit và không có tính bazơ). Ví dụ: nước cất có pH = 7.
- Nếu pH < 7: Dung dịch có tính axit. pH càng nhỏ độ axit của dung dịch càng lớn.
- Nếu pH > 7: Dung dịch có tính bazơ, pH càng lớn độ bazơ của dung dịch càng lớn.
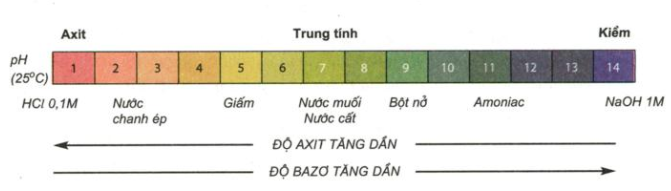
Hình 7: Thang pH của dung dịch một số chất.
Trắc nghiệm Hóa học 9 Bài 8: Một số bazơ quan trọng
Câu 1: Tính chất vật lý của NaOH là
A. Là chất rắn không màu
B. Hút ẩm mạnh
C. Tan nhiều trong nước và tỏa nhiệt
D. A, B, C đều đúng
Câu 2: Trung hòa 500 ml dung dịch H2SO4 1M cần vừa đủ 160 gam dung dịch NaOH. Tính nồng độ phần trăm dung dịch NaOH đã dùng.
A. 25%
B. 30%
C. 35%
D. 40%
Câu 3: Ứng dụng của NaOH là
A. Sản xuất xà phòng, chất tẩy rửa, bột giặt
B. Sản xuất giấy, tơ nhân tạo, trong chế biến dầu mỏ, sản xuất nhôm
C. Chế biến dầu mỏ và nhiều ngành công nghiệp hóa chất khác
D. Cả A, B, C đều đúng
Câu 4: Để hấp thụ hoàn toàn 8,96 lít khí SO2 (ở đktc) thì cần vừa đủ 200 ml dung dịch Ca(OH)2. Tính nồng độ mol của dung dịch Ca(OH)2. Biết sản phẩm thu được chỉ có muối CaSO3.
A. 5M
B. 1M
C. 3M
D. 2M
Câu 5: Chọn phát biểu đúng:
Thang pH dùng đểu biểu thị độ axit, độ bazơ của dung dịch, nếu:
A. pH = 7: Dung dịch là trung tính
B. pH < 7: Dung dịch có tính axit
C. pH > 7: Dung dịch có tính bazơ
D. A, B, C đều đúng
Câu 6: Cho 13,2 gam CO2 vào dung dịch Ca(OH)2 dư. Khối lượng muối CaCO3 tạo thành là
A. 25 gam
B. 30 gam
C. 35 gam
D. 40 gam
Câu 7: Canxi hiđroxit có ứng dụng được dùng để:
A. Làm vật liệu trong xây dựng
B. Khử chua đất trồng trọt
C. Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật
D. Cả A, B, C đều đúng
Câu 8: Cho phương trình phản ứng:
Ca(OH)2 + H2SO4 → CaSO4 + H2O
Tổng hệ số cân bằng (là các số nguyên, tối giản) trong phương trình hoá học là
A. 2
B. 3
C. 4
D. 5
Câu 9: Nhóm các dung dịch có pH < 7 là
A. HCl, H2SO4
B. NaOH, HCl
C. HNO3, KOH
D. Ba(OH)2, Ca(OH)2
Câu 10: Hòa tan 3,36 gam CaO vào nước, thu được dung dịch Ca(OH)2. Khối lượng của Ca(OH)2 có trong dung dịch là
A. 2,22 gam
B. 2,86 gam
C. 3,64 gam
D. 4,44 gam
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 9: Tính chất hóa học của muối
Lý thuyết Bài 10: Một số muối quan trọng
Lý thuyết Bài 11: Phân bón hóa học
Lý thuyết Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ
Lý thuyết Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
