Lý thuyết Phi kim – Sơ lược về bảng tuần hoàn (mới 2024 + Bài Tập) - Hóa học 9
Tóm tắt lý thuyết Hóa 9 Bài 32: Luyện tập chương 3: Phi kim – Sơ lược về bảng tuần hoàn ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 9 Bài 32.
Lý thuyết Hóa 9 Bài 32: Luyện tập chương 3: phi kim – Sơ lược về bảng tuần hoàn
Bài giảng Hóa 9 Bài 32: Luyện tập chương 3: phi kim – Sơ lược về bảng tuần hoàn
Kiến thức cần nắm vững
1. Tính chất hóa học của phi kim
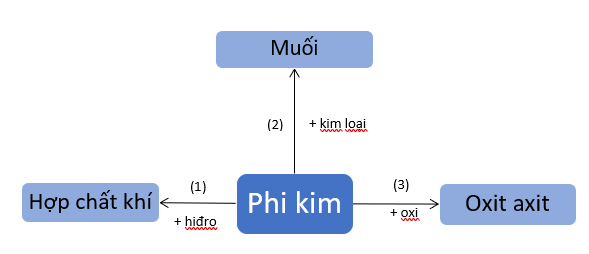
Phương trình hóa học minh họa cho sơ đồ, ứng với phi kim là lưu huỳnh:
(1) S + H2 H2S
(2) S + Fe FeS
(3) S + O2 SO2
2. Tính chất hóa học của 1 số phi kim cụ thể
a. Tính chất hóa học của clo
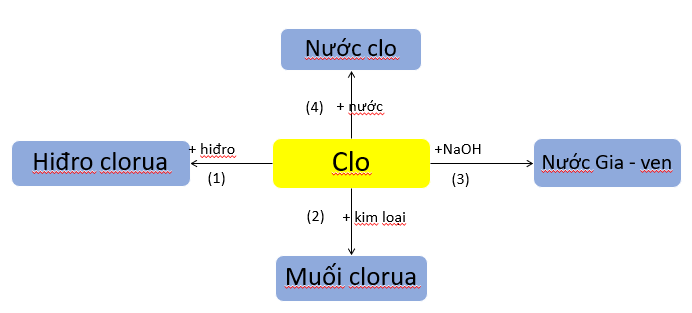
Các phương trình hóa học minh họa cho sơ đồ:
(1) Cl2 + H2 2HCl
(2) 3Cl2 + 2Fe 2FeCl3
(3) Cl2 + 2NaOH → NaCl + NaClO + H2O
(4) Cl2 + H2O HCl + HClO
b. Tính chất hóa học các hợp chất của cacbon
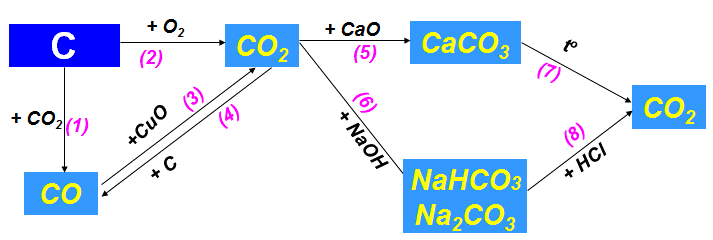
Phương trình hóa học minh họa cho sơ đồ:
(1) C + CO2 2CO
(2) C + O2 CO2
(3) CO + CuO Cu + CO2 ↑
(4) CO2 + C 2CO
(5) CaO + CO2 CaCO3
(6) CO2 + 2NaOH (dư) → Na2CO3 + H2O
CO2 dư + NaOH → NaHCO3
(7) CaCO3 CaO + CO2
(8) Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
3. Bảng tuần hoàn các nguyên tố hóa học
a. Cấu tạo của bảng tuần hoàn
- Ô nguyên tố
- Chu kỳ
- Nhóm
b. Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn
- Trong một chu kỳ, khi đi từ đầu đến cuối chu kỳ theo chiều tăng của điện tích hạt nhân:
+) Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
+) Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần.
- Trong một nhóm, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân:
+) Số lớp electron của nguyên tử tăng dần.
+) Tính kim loại của các nguyên tố tăng dần, đồng thời tính phi kim của các nguyên tố giảm dần.
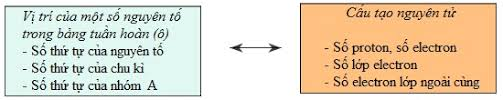
c. Ý nghĩa bảng tuần hoàn
Biết vị trí của nguyên tố trong bảng tuần hoàn ta có thể suy đoán cấu tạo nguyên tử và ngược lại.
Trắc nghiệm Hóa học 9 Bài 32: Luyện tập chương 3: Phi kim – Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Câu 1: Cho 0,4 gam khí hidro tác dụng vừa đủ với khí clo, sau phản ứng thu được m gam HCl. Giá trị của m là
A. 10,9 gam
B. 12,8 gam
C. 13,5 gam
D. 14,6 gam
Câu 2: Để phân biệt CO2 và SO2 người ta dùng dịch nào sau đây?
A. Nước brom
B. Dung dịch HCl
C. Dung dịch NaOH
D. Dung dịch Ca(OH)2
Câu 3: Chất nào sau đây là muối cacbonat trung hòa?
A. NaHCO3
B. Ca(HCO3)2
C. Ba(HCO3)2
D. CaCO3
Câu 4: Đốt cháy 24,8 gam photpho bình chứa khí oxi, thu được m gam điphotpho pentaoxit. Giá trị của m là
A. 56,8 gam
B. 57,2 gam
C. 54,4 gam
D. 55,4 gam
Câu 5: Phương trình phản ứng nào sau đây đúng?
A. K2CO3 + Ca(OH)2 → 2KOH + CaCO3
B. K2CO3 + Ca(OH)2 → 2K2O + CaCO3
C. K2CO3 + Ca(OH)2 → 2KOH + CaO +CO2
D. K2CO3 + Ca(OH)2 → 2K2O + CaCO3 +H2O
Câu 6: Cho 34,8 gam MnO2 tác dụng với dung dịch HCl đặc, nóng, dư. Thể tích khí ở đktc thu được là
A. 6,56 lít
B. 4,48 lít
C. 8,96 lít
D. 17,92 lít
Câu 7: Để có thể khắc chữ và hình trên thuỷ tinh người ta dùng dung dịch nào dưới đây?
A. Dung dịch HF
B. Dung dịch HCl
C. Dung dịch HBr
D. Dung dịch HI
Câu 8: Công đoạn chính để sản xuất thủy tinh theo thứ tự lần lượt là
A. Trộn, nung, làm nguội, ép, thổi
B. Trộn, ép, thổi, làm nguội, nung
C. Trộn, thổi, làm nguội, nung, ép
D. Nung, thổi, trộn, làm nguội, ép
Câu 9: Cho 16,8 gam NaHCO3 vào lượng dư dung dịch HCl, sau phản ứng thu được V lít khí CO2 ở đktc. Giá trị của V là
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 5,60 lít
Câu 10: Dãy kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần
A. K, Na, Li, Rb
B. Li, K, Rb, Na
C. Na, Li, Rb, K
D. Li, Na, K, Rb
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
Lý thuyết Bài 35: Cấu tạo phân tử hợp chất hữu cơ
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
