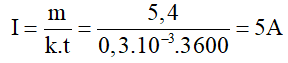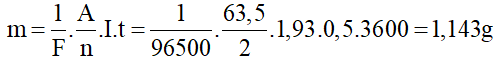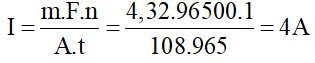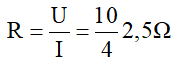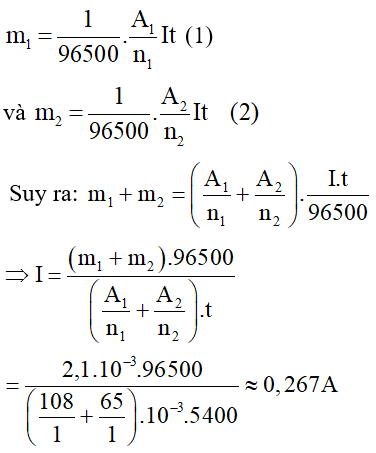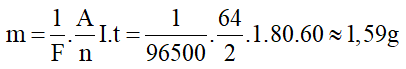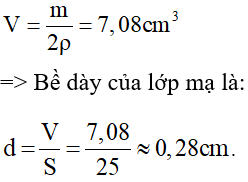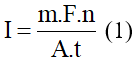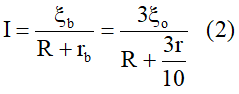TOP 40 câu Trắc nghiệm Dòng điện trong chất điện phân (có đáp án 2023) – Vật lí 11
Bộ 40 bài tập trắc nghiệm Vật lí lớp 11 Bài 14: Dòng điện trong chất điện phân có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Vật lí 11 Bài 14.
Trắc nghiệm Vật lí 11 Bài 14: Dòng điện trong chất điện phân
Bài giảng Trắc nghiệm Vật lí 11 Bài 14: Dòng điện trong chất điện phân
Câu 1. Hạt tải điện trong chất điện phân là
A. ion dương và ion âm.
B. electron tự do.
C. ion âm và electron.
D. ion dương và electron tự do.
Đáp án: A
Giải thích:
Dòng điện trong chất điện phân là dòng ion dương và dòng ion âm chuyển động có hướng theo hai chiều ngược nhau dưới tác dụng của điện trường.
Hạt tải điện trong chất điện phân là ion dương và ion âm.
Câu 2. Bản chất dòng điện trong chất điện phân là
A. dòng ion dương và dòng electron dịch chuyển ngược chiều điện trường.
B. dòng electron chuyển động hỗn loạn.
C. dòng ion dương và dòng ion âm chuyển động có hướng theo hai chiều ngược nhau.
D. dòng ion dương và dòng ion âm chuyển động cùng chiều nhau.
Đáp án: C
Giải thích:
Dòng điện trong chất điện phân là dòng ion dương và dòng ion âm chuyển động có hướng theo hai chiều ngược nhau dưới tác dụng của điện trường.
Câu 3. Câu nào sau đây là không đúng khi nói về dòng điện trong chất điện phân.
A. Chất điện phân dẫn điện không tốt bằng kim loại.
B. Chất điện phân dẫn điện tốt hơn kim loại.
C. Mật độ hạt tải điện tự do trong chất điện phân nhỏ hơn trong kim loại, môi trường dung dịch rất mất trật tự.
D. Khối lượng và kích thước ion lớn hơn của electron.
Đáp án: B
Giải thích:
Dòng điện trong chất điện phân dẫn điện không tốt bằng kim loại do: mật độ electron tự do trong chất điện phân nhỏ hơn trong kim loại, môi trường dung dịch rất mất trật tự và khối lượng, kích thước ion lớn hơn của electron.
Câu 4. Trong các chất sau, chất nào là chất điện phân?
A. Nước nguyên chất.
B. Dung dịch NaOH.
C. Ca.
D. CO2.
Đáp án: B
Giải thích:
Trong dung dịch, các hợp chất hóa học như axit, bazơ và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
Trong các chất trên thì chất điện phân là dung dịch NaOH (trong dung dịch NaOH phân li thành ion Na+ và ion OH-).
Câu 5. Trong các chất sau, chất nào không phải là chất điện phân?
A. Nước nguyên chất.
B. Dung dịch NaOH.
C. Dung dịch CuSO4.
D. Dung dịch NaCl.
Đáp án: A
Giải thích:
Trong dung dịch, các hợp chất hóa học như axit, bazơ và muối bị phân li (một phần hoặc toàn bộ) thành các nguyên tử (hoặc nhóm nguyên tử) tích điện gọi là ion; ion có thể chuyển động tự do trong dung dịch và trở thành hạt tải điện.
Các chất điện phân là dung dịch NaOH, CuSO4, NaCl.
Nước nguyên chất không phải là chất điện phân.
Câu 6. Khối lượng chất giải phóng ở điện cực của bình điện phân được xác định bằng biểu thức nào sau đây?
A.
B.
C.
D.
Đáp án: C
Giải thích:
Khối lượng chất giải phóng ở điện cực của bình điện phân được xác định bởi biểu thức:
Câu 7. Đơn vị của hằng số Fa - ra - đây là
A. C.mol.
B. C/mol.
C. N.
D. F.
Đáp án: B
Giải thích:
Hằng số Fa-ra-đây là F = 96494 C/mol (thường lấy là 96500 C/mol).
Đơn vị của hằng số Fa - ra - đây là: C/mol.
Câu 8. Đơn vị của đương lượng điện hóa là
A. kg/C.
B. C/mol.
C. N/m.
D. N.
Đáp án: B
Giải thích:
Đơn vị của đương lượng điện hóa là: kg/C.
Câu 9. Câu nào sau đây là đúng khi nói về khối lượng chất được giải phóng ở điện cực của bình điện phân?
A. Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó.
B. Khối lượng chất giải phóng ở điện cực của bình điện phân tỉ lệ với khối lượng dung dịch trong bình.
C. Khối lượng chất giải phóng ở điện cực của bình điện phân tỉ lệ với thể tích của dung dịch trong bình.
D. Khối lượng chất giải phóng ở điện cực của bình điện phân tỉ lệ với khối lượng chất điện phân.
Đáp án: A
Giải thích:
Định luật Fa – ra – đây thứ nhất: khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó m = k.q.
Câu 10. Khối lượng chất giải phóng ở điện cực của bình điện phân tỉ lệ với
A. khối lượng dung dịch trong bình.
B. khối lượng chất điện phân.
C. điện lượng chuyển qua bình.
D. thể tích của dung dịch trong bình.
Đáp án: C
Giải thích:
Định luật Fa – ra – đây thứ nhất: Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó m = k.q.
Câu 11. Câu nào sau đây không đúng?
A. Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó.
B. Đương lượng hóa học của nguyên tố tỉ lệ với đương lượng gam của nguyên tố đó.
C. Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ hóa trị của của chất được giải phóng.
D. Đơn vị của đương lượng điện hóa là: kg/C.
Đáp án: C
Giải thích:
Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó. Đương lượng hóa học của nguyên tố tỉ lệ với đương lượng gam của nguyên tố đó. Đơn vị của đương lượng điện hóa là: kg/C.
Câu 12. Đương lượng hóa học của nguyên tố tỉ lệ với
A. đương lượng gam của nguyên tố đó.
B. khối lượng chất điện phân.
C. điện lượng chuyển qua bình.
D. thể tích của dung dịch trong bình.
Đáp án: A
Giải thích:
Đương lượng hóa học của nguyên tố tỉ lệ với đương lượng gam của nguyên tố đó.
Câu 13. Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với
A. đương lượng gam của nguyên tố đó.
B. cường độ dòng điện chạy qua bình điện phân.
C. thời gian dòng điện chạy qua bình điện phân.
D. cả 3 đại lượng trên.
Đáp án: D
Giải thích:
Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với:
+ đương lượng gam của nguyên tố đó;
+ cường độ dòng điện chạy qua bình điện phân (I);
+ thời gian dòng điện chạy qua bình điện phân (t).
Câu 14. Trong hiện tượng điện phân dương cực tan một muối xác định, muốn tăng khối lượng chất giải phóng ở điện cực thì cần phải tăng
A. khối lượng mol của chất được giải phóng.
B. hóa trị của chất được giải phóng.
C. thời gian lượng chất được giải phóng.
D. cả 3 đại lượng trên.
Đáp án: C
Giải thích:
Khối lượng chất giải phóng ở điện cực của bình điện phân được xác định bởi biểu thức:
Đối với một muối xác định, thì khối lượng mol (A) và hóa trị (n) đã xác định, nên muốn tăng khối lượng chất giải phóng ở điện cực thì cần phải tăng thời gian lượng chất được giải phóng.
Câu 15. Hiện tượng điện phân không ứng dụng để
A. đúc điện.
B. sơn tĩnh điện.
C. luyện nhôm.
D. điều chế clo.
Đáp án: B
Giải thích:
Hiện tượng điện phân được ứng dụng để: luyện nhôm, tinh luyện đồng, điều chế clo, xút, mạ điện, đúc điện.
Hiện tượng điện phân không ứng dụng để sơn tĩnh điện.
Câu 16. Hiện tượng điện phân được ứng dụng để
A. sơn tĩnh điện.
B. hàn điện.
C. mạ điện.
D. tạo ra hồ quang điện.
Đáp án: C
Giải thích:
Hiện tượng điện phân ứng dụng để: luyện nhôm, tinh luyện đồng, điều chế clo, mạ điện, đúc điện.
Câu 17. Khi điện phân dương cực tan, nếu giữ nguyên cường độ dòng điện và tăng thời gian điện phân lên 2 lần thì khối lượng chất giải phóng ra ở điện cực.
A. không đổi.
B. tăng 2 lần.
C. tăng 4 lần.
D. giảm 4 lần.
Đáp án: B
Giải thích:
Khối lượng chất giải phóng ở điện cực của bình điện phân được xác định bởi biểu thức:
Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với thời gian dòng điện chạy qua bình điện phân (t).
Do đó tăng thời gian điện phân lên 2 lần thì khối lượng chất giải phóng ra ở điện cực cũng tăng 2 lần.
Câu 18. Khi điện phân dương cực tan, nếu giảm cường độ dòng điện đi 2 lần và tăng thời gian điện phân lên 2 lần thì khối lượng chất giải phóng ra ở điện cực.
A. không đổi.
B. tăng 2 lần.
C. tăng 4 lần.
D. giảm 4 lần.
Đáp án: A
Giải thích:
Khối lượng chất giải phóng ở điện cực của bình điện phân được xác định bởi biểu thức:
Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với thời gian dòng điện chạy qua bình điện phân (t) và cường độ dòng điện chạy qua bình điện phân I.
Do đó tăng thời gian điện phân lên 2 lần; giảm cường độ dòng điện đi 2 lần thì khối lượng chất giải phóng ra ở điện cực không thay đổi.
Câu 19. Khi điện phân dương cực tan, nếu tăng cả cường độ dòng điện và tăng thời gian điện phân lên gấp đôi thì khối lượng chất giải phóng ra ở điện cực.
A. không đổi.
B. tăng 2 lần.
C. tăng 4 lần.
D. giảm 4 lần.
Đáp án: C
Giải thích:
Khối lượng chất giải phóng ở điện cực của bình điện phân được xác định bởi biểu thức:
Khối lượng chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với thời gian dòng điện chạy qua bình điện phân (t) và cường độ dòng điện chạy qua bình điện phân I;
Do đó tăng thời gian điện phân lên 2 lần và cường độ dòng điện lên 2 lần thì khối lượng chất giải phóng ra ở điện cực tăng 4 lần.
Câu 20. Một bình điện phân đựng dung dịch AgNO3 với cực dương là Ag biết khối lượng mol của bạc là 108 g/mol. Cường độ dòng điện chạy qua bình điện phân là I = 1,2 A. Tính lượng Ag bám vào catot trong thời gian 30 phút là:
A. 0,04 (g).
B. 2,42 (g).
C. 2,42 (kg).
D. 0,04 (kg).
Đáp án: B
Giải thích:
Đổi 30 phút = 1800s.
Lượng Ag bám vào catot trong thời gian 30 phút là:
= 2,42 g
Câu 21. Khi điện phân dung dịch AgNO3 với cực dương là Ag biết khối lượng mol của bạc là 108 g/mol. Cường độ dòng điện chạy qua bình điện phân để trong 30 phút để có 2,41 g Ag bám ở cực âm là
A. 1,2 A.
B. 71,8 A.
C. 120 A.
D. 0,718 A.
Đáp án: A
Giải thích:
Đổi 30 phút = 1800s
Áp dụng công thức:
= 1,2 A.
Câu 22. Một bình điện phân đựng dung dịch AgNO3 với cực dương là Ag biết khối lượng mol của bạc là 108 g/mol. Cường độ dòng điện chạy qua bình điện phân là I = 1,2 A. Thời gian để có 2,5 g Ag bám vào catot là:
A. 2233 s.
B. 893 s.
C. 1861 s.
D. 1250 s.
Đáp án: C
Giải thích:
Áp dụng công thức:
= 1861 s.
Câu 23. Cho dòng điện chạy qua bình điện phân chứa dung dịch muối Niken. Với hai điện cực làm bằng Niken. Biết rằng đương lượng hóa của Niken là 0,3.10-3 g/C, Niken hóa trị 2, khối lượng mol của Ni là 58 g/mol, điện tích chuyển qua bình là 1,8.104 C. Tính khối lượng Niken bám vào catot?
A. 5,4 g.
B. 1,5 g.
C. 5,4 mg.
D. 5,4 kg.
Đáp án: A
Giải thích:
Áp dụng định luật Faraday thứ nhất, khối lượng Niken bám vào catot là:
m = k.q = 0,3.10-3. 1,8.104 = 5,4 g.
Câu 24. Cho dòng điện chạy qua bình điện phân chứa dung dịch muối Niken. Với hai điện cực làm bằng Niken. Biết đương lượng hóa của Niken là 3.10-4 g/C, Niken hóa trị 2, khối lượng mol của Ni là 58 g/mol, khối lượng Niken bám vào catot là 3.10-3 g. Tính điện tích chuyển qua bình?
A. 0,1 C.
B. 3.10-4 C.
C. 10 C.
D. 3 C.
Đáp án: C
Giải thích:
Áp dụng công thức định luật Faraday thứ nhất :
m = k.q = 10 C.
Câu 25. Để xác định đương lượng điện hoá của đồng (Cu), một học sinh đã cho dòng điện có cường độ 1,2 A chạy qua bình điện phân chứa dung dịch đồng sunphat (CuSO4) trong khoảng thời gian 5,0 phút và thu được 120 mg đồng bám vào catôt. Hỏi giá trị đương lượng điện hoá của đồng tính theo kết quả của thí nghiệm này bằng bao nhiêu? Biết khối lượng mol của đồng A = 63,5 g/mol và đồng hoá trị n = 2.
A. 3,33 g/C.
B. 3,33.10-4 g/C.
C. 0,33 g/C.
D. 3,33.104 g/C.
Đáp án: B
Giải thích:
Đổi 5 phút = 300 giây
120 mg = 120.10-3 g
Áp dụng công thức:
m = k.q = k.I.t = 3,33.10-4 g/C.
Câu 26. Cho dòng điện chạy qua bình diện phân chứa dung dịch CuSO4 có anot bằng Cu. Biết rằng đương lượng hóa của đồng 3,3.10-4 g/C. Để trên catot xuất hiện 660g đồng, thì điện tích chuyển qua bình phải bằng:
A. 105 C.
B. 2.106 C.
C. 104 C.
D. 2.108 C.
Đáp án: B
Giải thích:
Áp dụng công thức: m = k.q = 2.106 C.
Câu 27. Một bình điện phân đựng dung dịch CuSO4 với anot bằng Cu. Điện trở của bình điện phân là R = 2 Ω. Hiệu điện thế đặt vào hai cực là U = 10 V. Cho A = 64 g/mol và n = 2. Khối lượng Cu bám vào cực âm sau 1 giờ là
A. 5,9 g.
B. 5,9 kg.
C. 11,8 g.
D. 11,8 kg.
Đáp án: A
Giải thích:
Cường độ dòng điện chạy qua bình điện phân là:= 5A.
Khối lượng Cu bám vào cực âm sau 1 giờ ( đổi 1 h = 3600 s ) là:
= 5,9 g
Câu 28. Chiều dày của lớp Niken phủ lên một tấm kim loại là d = 0,05 mm sau khi điện phân trong 1 giờ. Diện tích mặt phủ của tấm kim loại là 60 cm2. Cho biết Niken có khối lượng riêng là ρ = 8,9.103 kg/m3, nguyên tử khối A = 58 g/mol và hoá trị n = 2. Cường độ dòng điện qua bình điện phân là:
A. I = 2,5 (μA).
B. I = 2,5 (mA).
C. I = 250 (A).
D. I = 2,5 (A).
Đáp án: D
Giải thích:
Khối lượng Ni giải phóng ra ở điện cực:
= 2,5 A
Câu 29. Một vật kim loại được mạ Niken có diện tích 60 cm2. Cường độ dòng điện qua bình điện phân là 2,5 A. Thời gian mạ là 1 giờ. Cho biết Niken có khối lượng riêng là ρ = 8,9.103 kg/m3, nguyên tử khối A = 58 g/mol và hoá trị n = 2. Tính độ dày của lớp Niken phủ đều trên mặt của vật được mạ?
A. 0,05 m.
B. 0,05 mm.
C. 0,5 cm.
D. 5 mm.
Đáp án: B
Giải thích:
Khối lượng Ni giải phóng ra ở điện cực:
= 0,05.10-3 m = 0,05 mm.
Câu 30. Chiều dày của lớp Niken phủ lên một tấm kim loại là d = 0,05(mm) sau khi điện phân trong t giờ. Diện tích mặt phủ của tấm kim loại là 60 cm2. Cho biết Niken có khối lượng riêng là ρ = 8,9.103 kg/m3, nguyên tử khối A = 58 g/mol và hoá trị n = 2. Cường độ dòng điện qua bình điện phân là 2,5 A. Tính thời gian mạ tấm kim loại trên?
A. 600 s.
B. 1800 s.
C. 3553 s.
D. 7200 s.
Đáp án: C
Giải thích:
Khối lượng Ni giải phóng ra ở điện cực:
= 3553,86 s.
Câu 31. Tìm phát biểu sai
A. Trong chất điện phân, các chuyển động nhiệt của ion dương và ion âm có thể va chạm vào nhau và xảy ra quá trình tái hợp
B. Số ion dương và âm được tạo ra trong chất điện phân phụ thuộc vào nồng độ của dung dịch.
C. Điện trở của bình điện phân tăng khi nhiệt độ tăng
D. Số ion dương và âm được tạo ra trong chất điện phân phụ thuộc vào nhiệt độ của dung dịch.
Đáp án: C
Giải thích:
Bản chất dòng điện trong chất điện phân là dòng dịch chuyển có hướng của các ion dượng theo chiều điện trường và các ion âm ngược chiều điện trường. Khi nhiệt độ tăng, số lượng phân tử phân li tăng dẫn đến số lượng các cặp ion được tạo thành tăng. Chính điều này làm tăng khả năng dẫn điện của dung dịch điện phân, do vậy mà điện trở của dung dịch điện phân giảm khi nhiệt độ tăng.
Câu 32. Tìm phát biểu sai
A. Dòng điện trong chất điện phân là dòng của các electron tự do và dương khi có điện trường
B. Dòng điện trong chất điện phân là dòng chuyển dời có hướng của các ion dương cùng chiều điện trường và ion âm theo theo chiều ngược với chiều điện trường
C. Khi có điện trường đặt vào chất điện phân, các ion dương và âm vãn chuyển động hỗn loạn nhưng có định hướng theo phương của điện trường. tính định hướng phụ thuộc vào cường độ điện trường
D. Trong chất điện phân, khi có dòng điện tác dụng bởi điện trường ngoài sẽ có phản ứng phụ tại các điện cực
Đáp án: A
Giải thích:
Các dung dịch muối, các muối nóng chảy, axit, bazo được gọi là các chất điện phân Dòng điện trong chất điện phân là dòng dịch chuyển có hướng của các ion dương theo chiều điện trường và các ion âm ngược chiều điện trường.
A. Mạ điện dựa trên nguyên lí của hiện tượng dương cực tan trong quá trình điện phân
B. Acquy hoạt động dựa trên nguyên lí hoạt động của bình điện phân
C. Tụ điện hoá học có nguyên lí làm việc dựa trên nguyên lí của hiện tượng dương cực tan
D. Pin điện dựa trên nguyên lí của hiện tượng dương cực tan
Đáp án: A
Giải thích:
Hiện dương cực tan xảy ra khi điện phân một dung dịch muối kim loại mà anot làm bằng chính kim loại ấy. Mạ điện dựa trên nguyên lí của hiện tượng dương cực tan trong quá trình điện phân.
A. 0,3.10-4g
B. 3.10-3g
C. 0,3.10-3g
D. 10,3.10-4g
Đáp án: B
Giải thích:
Khối lượng niken bám vào catot là: m = k.q = 3.10-4.10 = 3.10-3g
Câu 35. Một bình điện phân chứa dung dịch muối niken với hai điện cực bằng niken. Biết đương lượng điện hoá của niken là 0,3.10-3g/C và khối lượng niken bám vào catot trong 1 giờ khi cho dòng điện có cường độ I chạy qua bình này là 5,4g. Cường độ dòng điện chạy qua bình bằng
A. 0,5A
B. 5A
C. 15A
D. 1,5A
Đáp án: B
Giải thích:
Cường độ dòng điện chạy qua bình bằng:
Câu 36. Một bình điện phân chứa dung dịch đồng sunphat (CuSO4 ) có anot bằng đồng. Biết khối lượng mol nguyên tử của đồng (Cu) là A = 63,5g/mol và hoá trị n = 2. Nếu cường độ dòng điện chạy qua bình này là 1,93A thì trong 0,5 giờ, khối lượng của catot tăng thêm là
A. 11,43g
B. 11430g
C. 1,143g
D. 0,1143g
Đáp án: C
Giải thích:
Khối lượng của catot tăng thêm là:
Câu 37. Một bình điện phân chứa dung dịch bạc nitrat (AgNO3) có anot bằng bạc. Biết bạc (Ag) có khối lượng mol nguyên tử A = 108g/mol và hoá trị n = 1. Nếu hiệu điện thế giữa hai cực của bình là 10V và sau 16 phút 5 giây có 4,32g bạc bám vào anot thì điện trở của bình là
A. 2,5Ω
B. 25Ω
C. 5Ω
D. 50Ω
Đáp án: A
Giải thích:
Cường độ dòng điện chạy qua bình là:
Điện trở của bình là:
Câu 38. Bình điện phân thứ nhất có anot bằng bạc nhúng trong dung dịch AgNO3, bình điện phân thứ hai có anot bằng đồng nhúng trong dung dịch CuSO4. Hai bình được mắc nối tiếp nhau vào một mạch điện. Sau 1,5 giờ, tổng khối lượng của hai catot tăng lên 2,1g. Cho biết AAg = 108; nAg = 1; ACu = 64; nCu = 2. Khối lượng m1 bạc bám vào bình thứ nhất và khối lượng m2 đồng bám vào bình thứ hai lần lượt là
A. 1,62g; 0,48g
B. 10,48g; 1,62g
C. 32,4g ; 9,6g
D. 9,6g; 32,4g
Đáp án: A
Giải thích:
Khối lượng m1 bạc bám vào bình thứ nhất và khối lượng m2 đồng bám vào bình thứ hai lần lượt là:
Thay I vào (1) và (2) ta có: m1 = 1,62g; m2 = 0,48g.
Câu 39. Để mạ đồng hai mặt của một tấm sắt có diện tích mỗi mặt là 25cm2, người ta dung nó làm catot của một bình điện phân có anot bằng đồng nhúng trong dung dịch CuSO4 rồi cho dòng điện có cường độ I = 1A chạy qua trong thời gian 1 giờ 20 phút. Biết ACu = 64, nCu = 2 và khối lượng riêng của đồng là ρCu = 8,9g/cm3. Bề dày của lớp mạ là
A.10,56cm
B. 0,28cm
C. 2,8cm
D. 0,28cm
Đáp án: B
Giải thích:
Khối lượng chất thoát ta ở điện cực:
Thể tích của lớp đồng bám trên mỗi mặt của tấm sắt:
Câu 40. Một bộ nguồn điện gồm 30 pin mắc thành ba nhóm nối tiếp, mỗi nhóm có 10 pin mắc song song; mỗi pin có suất điện động E0 và điện trở trong r = 0,6Ω. Mắc một bình điện phân đựng dung dịch CuSO4 có điện trở R = 205Ω vào hai cực của bộ nguồn nói trên. Biết anot của bình điện phân bằng đồng và sau 50 phút có 0,013g đồng bám vào catot. Suất điện động E0 bằng
A. 9V
B. 30V
C. 0,9V
D. 27V
Đáp án: C
Giải thích:
Ta có:
Mặt khác
Từ (1) và (2) ta xác định được ?0 = 0,9V.
Các câu hỏi trắc nghiệm Vật lí lớp 11 có đáp án, chọn lọc khác:
Trắc nghiệm Dòng điện trong chất khí có đáp án
Trắc nghiệm Dòng điện trong chân không có đáp án
Trắc nghiệm Dòng điện trong chất bán dẫn có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án