Lý thuyết KHTN 8 Bài 12 (Cánh diều): Muối
Tóm tắt lý thuyết Khoa học tự nhiên lớp 8 Bài 12: Muối đầy đủ, chi tiết sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt KHTN 8.
Lý thuyết KHTN 8 Bài 12: Muối
A. Kiến thức trọng tâm KHTN 8 Bài 12: Muối
I. Khái niệm muối
Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ: NaCl, K2SO4, Ca3(PO4)2, NH4NO3 …
II. Tên gọi của muối
Tên gọi muối của một số acid được trình bày trong bảng sau:
|
Acid |
Muối |
Ví dụ |
|
Hydrochloric acid (HCl) |
Muối chloride |
Sodium chloride: NaCl |
|
Sulfuric acid (H2SO4) |
Muối sulfate |
Copper(II) sulfate: CuSO4 |
|
Phosphoric acid (H3PO4) |
Muối phosphate |
Potassium phosphate: K3PO4 |
|
Carbonic acid (H2CO3) |
Muối carbonate |
Calcium carbonate: CaCO3 |
|
Nitric acid (HNO3) |
Muối nitrate |
Magnesium nitrate: Mg(NO3)2 |
III. Tính tan của muối
- Có muối tan tốt trong nước như: NaCl, CuSO4, Ca(NO3)2, …
- Có muối ít tan trong nước như: CaSO4, PbCl2, …
- Có muối không tan trong nước như: CaCO3, BaSO4, AgCl, …
- Tính tan của một số muối được trình bày trong bảng tính tan sau:
Bảng tính tan trong nước của một số muối
|
Gốc acid |
Các kim loại |
|||||||||||
|
K I |
Na I |
Ag I |
Mg II |
Ca II |
Ba II |
Zn II |
Pb II |
Cu II |
Fe II |
Fe III |
Al III |
|
|
− Cl |
t |
t |
k |
t |
t |
t |
t |
i |
t |
t |
t |
t |
|
− NO3 |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
t |
|
= SO4 |
t |
t |
i |
t |
i |
k |
t |
k |
t |
t |
t |
t |
|
= CO3 |
t |
t |
k |
k |
k |
k |
k |
k |
- |
k |
- |
- |
|
≡ PO4 |
t |
t |
k |
k |
k |
k |
k |
k |
k |
k |
k |
k |
t: chất dễ tan trong nước
k: chất không tan (độ tan nhỏ hơn 0,01 g/100 g nước).
i: chất ít tan (độ tan nhỏ hơn 1 g/100 g nước).
(-): chất không tồn tại hoặc bị nước phân huỷ.
IV. Tính chất hoá học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
Fe(NO3)2 + Cu → Cu(NO3)2 + Fe
2. Tác dụng với acid
Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
Ví dụ:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với base
Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
Ví dụ:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
4. Tác dụng với muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
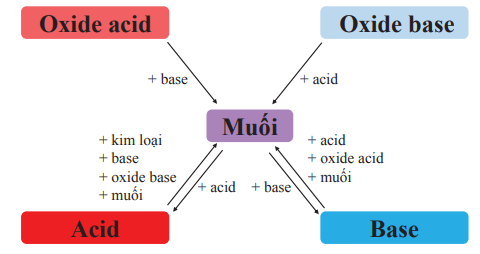
V. Mối quan hệ giữa acid, base, oxide và muối
Mối quan hệ giữa acid, base, oxide và muối được tóm tắt trong sơ đồ sau:
VI. Một số phương pháp điều chế muối
Muối có thể được tạo ra bằng các phương pháp sau:
- Cho dung dịch acid tác dụng với base. Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
- Cho dung dịch acid tác dụng với oxide base. Ví dụ:
3H2SO4 + Al2O3 → Al2(SO4)3 + 3H2O
- Cho dung dịch acid tác dụng với muối. Ví dụ:
2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
- Cho dung dịch base tác dụng với oxide acid. Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O
- Cho hai dung dịch muối tác dụng với nhau. Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
B. Bài tập KHTN 8 Bài 12: Muối
Câu 1: Cặp chất nào sau đây có thể cùng tồn tại trong một dung dịch ?
A. BaCl2 và CuSO4
B. NaOH và H2SO4
C. KCl và NaNO3
D. Na2CO3 và HCl.
Đáp án đúng: C
Câu 2: Trộn 2 dung dịch nào sau đây sẽ không xuất hiện kết tủa ?
A. BaCl2, Na2SO4
B. Na2CO3, Ba(OH)2
C. BaCl2, AgNO3
D. NaCl, K2SO4
Đáp án đúng: D
Giải thích:
(1) BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
=> Có xuất hiện kết tủa BaSO4
(2) Na2CO3 + Ba(OH)2 → BaCO3↓ + 2NaOH
=> Có xuất hiện kết tủa BaCO3
(3) BaCl2 + 2AgNO3 → 2AgCl↓ + Ba(NO3)2
=> Có xuất hiện kết tủa AgCl
Câu 3: Nhiệt phân hoàn toàn 73,5 gam KClO3 sau phản ứng thấy thoát ra V lít khí oxi ở đktc. Giá trị của V là
A. 22,04 lít
B. 19,69 lít
C. 21,04 lít
D. 20,16 lít
Đáp án đúng: D
Giải thích:
Theo bài ra, ta có:
nKClO3=73,5/122= 0,6 mol
PTHH: 2KClO3 → 2KCl + 3O2
0,6 → 0,9 (mol)
Với nO2 = 0,9 (mol) => VO2 = 22,4 x 0,9 = 20,16 lít
Vậy sau phản ứng sẽ thấy thoát ra 20,16 lít khí O2
Câu 4: Cho các phát biểu sau:
(1) Muối tác dụng với axit tạo thành muối mới và axit mới.
(2) Hai dung dịch muối tác dụng với nhau tạo thành hai muối mới.
(3) Phản ứng trao đổi là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
(4) Phản ứng trung hòa không thuộc loại phản ứng trao đổi.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Đáp án đúng: C
Câu 5: Cho dung dịch Sulfuric acid loãng tác dụng với muối natri sunfit, sau phản ứng thu được chất khí nào?
A. H2
B. CO2
C. SO2
D. NO2
Đáp án đúng: C
Giải thích:
Ta có: H2SO4 + NaSO3 → Na2SO4 + SO2 +H2O
Theo PTHH trên ta thấy sau phản ứng ta thu được chất khí SO2
Xem thêm các bài lý thuyết KHTN 8 sách Cánh diều hay, chi tiết tại:
Lý thuyết Bài 13: Phân bón hóa học
Lý thuyết Bài 14: Khối lượng riêng
Lý thuyết Bài 15: Tác dụng của chất lỏng lên vật đặt trong nó
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Cánh diều (hay nhất)
- Văn mẫu lớp 8 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 8 – Cánh diều
- Bố cục tác phẩm Ngữ văn lớp 8 – Cánh diều
- Tác giả tác phẩm Ngữ văn lớp 8 - Cánh diều
- Giải SBT Ngữ văn 8 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Cánh diều
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 – Cánh diều
- Lý thuyết Toán 8 – Cánh diều
- Giải sbt Toán 8 – Cánh diều
- Giải sgk Tiếng Anh 8 – iLearn Smart World
- Giải sbt Tiếng Anh 8 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 8 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 8 ilearn Smart World
- Bài tập Tiếng Anh 8 iLearn Smart World theo Unit có đáp án
- Giải sgk Lịch sử 8 – Cánh diều
- Lý thuyết Lịch sử 8 - Cánh diều
- Giải sbt Lịch sử 8 – Cánh diều
- Giải sgk Địa lí 8 – Cánh diều
- Lý thuyết Địa lí 8 - Cánh diều
- Giải sbt Địa lí 8 – Cánh diều
- Giải sgk Giáo dục công dân 8 – Cánh diều
- Lý thuyết Giáo dục công dân 8 – Cánh diều
- Giải sbt Giáo dục công dân 8 – Cánh diều
- Giải sgk Công nghệ 8 – Cánh diều
- Lý thuyết Công nghệ 8 - Cánh diều
- Giải sbt Công nghệ 8 – Cánh diều
- Giải sgk Tin học 8 – Cánh diều
- Lý thuyết Tin học 8 - Cánh diều
- Giải sbt Tin học 8 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 – Cánh diều