Lý thuyết Hóa 9 Axit cacbonic và muối cacbonat (mới 2024 + Bài Tập) - Hóa học 9
Tóm tắt lý thuyết Hóa 9 Bài 29: Axit cacbonic và muối cacbonat ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 9 Bài 29.
Lý thuyết Hóa 9 Bài 29: Axit cacbonic và muối cacbonat
Bài giảng Hóa 9 Bài 29: Axit cacbonic và muối cacbonat
I. Axit cacbonic (Công thức hóa học H2CO3)
1. Trạng thái tự nhiên và tính chất vật lí
- Trong nước tự nhiên và nước mưa có hòa tan khí cacbonic: 1000 m3 nước hòa tan được 90 m3 khí CO2.
- Một phần khí CO2 tác dụng với nước tạo thành dung dịch axit cacbonic, phần lớn vẫn tồn tại ở dạng phân tử CO2
2. Tính chất hóa học
- H2CO3 là một axit yếu: dung dịch H2CO3 chỉ làm quỳ tím chuyển thành màu đỏ nhạt, bị axit mạnh đẩy ra khỏi muối.
- H2CO3 là một axit không bền: H2CO3 tạo thành trong các phản ứng hóa học bị phân hủy ngay thành CO2 và H2O.
II. Muối cacbonat
1. Phân loại
Có hai loại muối cacbonat:
- Muối cacbonat trung hòa (hay muối cacbonat), không còn nguyên tố H trong thành phần gốc axit.
Ví dụ: Na2CO3, CaCO3,..
- Muối cacbonat axit (hay muối hiđrocacbonat), có nguyên tố H trong thành phần gốc axit.
Ví dụ: NaHCO3, Ca(HCO3)2...
2. Tính chất
a. Tính tan
- Đa số muối cacbonat không tan trong nước, trừ một số muối cacbonat của kim loại kiềm như Na2CO3, K2CO3...
- Hầu hết các muối hiđrocacbonat tan trong nước như Ca(HCO3)2; Mg(HCO3)2 …
b. Tính chất hóa học
- Tác dụng với axit:
+ Muối cacbonat tác dụng với dung dịch axit mạnh hơn axit cacbonic (như HCl, HNO3, H,SO4,...) tạo thành muối mới và giải phóng CO2.
+ Ví dụ:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
CaCO3 + H2SO4 → CaSO4 + CO2 ↑+ H2O

Hình 1: NaHCO3 tác dụng với HCl
- Tác dụng với dung dịch bazơ
+ Một số dung dịch muối cacbonat tác dụng với dung dịch bazơ tạo thành muối cacbonat không tan và bazơ mới.
+ Ví dụ:
K2CO3 + Ca(OH)2 → 2KOH + CaCO3 ↓
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3 ↓

Hình 2: K2CO3 tác dụng với Ba(OH)2
+ Muối hiđrocacbonat tác dụng với dung dịch kiềm tạo thành muối trung hòa và nước
Ví dụ:
KHCO3 + KOH → K2CO3 + H2O
Ba(HCO3)2 + Ba(OH)2 → 2BaCO3↓ + 2H2O
-Tác dụng với dung dịch muối
- Dung dịch muối cacbonat tác dụng với một số dung dịch muối tạo thành 2 muối mới
Ví dụ:
Na2CO3 + CaCl2 → 2NaCl + CaCO3↓
- Muối cacbonat bị nhiệt phân hủy
Nhiều muối cacbonat (trừ muối cacbonat trung hòa của kim loại kiềm) dễ bị nhiệt phân hủy giải phóng khí CO2
Ví dụ:
CaCO3 CaO + CO2
2NaHCO3 Na2CO3 + CO2 + H2O
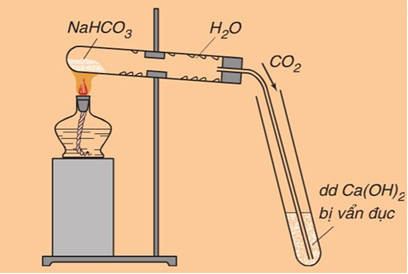
Hình 3: Nhiệt phân muối NaHCO3
3. Ứng dụng
- CaCO3 là thành phần chính của đá vôi, được dùng để sản xuất vôi, xi măng…
- Na2CO3 được dùng để nấu xà phòng, sản xuất thủy tinh,..
- NaHCO3 được dùng làm dược phẩm, hóa chất trong bình cứu hỏa,...
III. Chu trình cacbon trong tự nhiên
Trong tự nhiên luôn có sự chuyển hóa cacbon tự dạng này sang dạng khác. Sự chuyển hóa này diễn ra thường xuyên, liên tục và tạo thành chu trình khép kín.
Hình 4: Chu trình cacbon trong tự nhiên
Trắc nghiệm Hóa học 9 Bài 29: Axit cacbonic và muối cacbonat
Câu 1: Khi nhiệt phân muối cacbonat, khí sinh ra là
A. CO2
B. SO3
C. SO2
D. O2
Câu 2: Cho dung dịch K2CO3 tác dụng với dung dịch Ca(OH)2 hiện tượng của phản ứng là
A. Sủi bọt khí
B. Kết tủa trắng
C. Không có hiện tượng
D. Dung dịch chuyển sang màu xanh
Câu 3: Cho 6 gam CaCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là
A. 0,02 lít
B. 0,04 lít
C. 0,06 lít
D. 0,08 lít
Câu 4: Chọn đáp án đúng nhất. Tất cả muối cacbonat đều
A. Không tan trong nước
B. Tan trong nước
C. Bị nhiệt phân tạo ra oxit kim loại và cacbon dioxit
D. Bị nhiệt phân trừ muối cacbonat trung hòa của kim loại kiềm
Câu 5: Ứng dụng của muối cacbonat là
A. CaCO3 là thành phần chính của đá vôi, được dùng để sản xuất vôi, xi măng, …
B. Na2CO3 được dùng để nấu xà phòng, sản xuất thủy tinh, …
C. NaHCO3 được dùng làm dược phẩm, hóa chất trong bình cứu hỏa, …
D. Cả A, B, C đều đúng
Câu 6: Nung hoàn toàn hỗn hợp 2 muối CaCO3 và MgCO3 thu được 3,8 gam hai oxit và 1,68 lít CO2 (đktc). Khối lượng hỗn hợp muối ban đầu là
A. 8,2 gam
B. 5,9 gam
C. 6,8 gam
D. 7,1 gam
Câu 7: Tính chất hóa học của muối cacbonat là
A. Tác dụng với axit, với dung dịch bazơ
B. Tác dụng với dung dịch muối
C. Muối cacbonat bị nhiệt phân hủy
D. Cả A, B, C đều đúng
Câu 8: Trong các muối sau, muối nào là muối hidrocacbonat?
A. NaHSO3
B. MgCO3
C. Na2CO3
D. Ca(HCO3)2
Câu 9: Nhiệt phân 40 gam CaCO3 thu được V lít khí CO2 ở đktc. Giá trị của V là
A. 5,60 lít
B. 7,04 lít
C. 8,96 lít
D. 9,08 lít
Câu 10: Phương trình hóa học nào sau đây đúng?
A. 2NaHCO3 Na2CO3 + CO2 + H2O
B. 2NaHCO3 Na2CO3 + H2O
C. NaHCO3 Na2CO3 + O2 + H2O
D. 2NaHCO3 NaOH + CO2 + H2O
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 30: Silic. Công nghiệp silicat
Lý thuyết Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Bài 32: Luyện tập chương 3: phi kim – Sơ lược về bảng tuần hoàn
Lý thuyết Bài 34: Khái niệm về hợp chất hữu cơ và hóa học hữu cơ
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
