Lý thuyết Clo (mới 2024 + Bài Tập) - Hóa học 9
Tóm tắt lý thuyết Hóa 9 Bài 26: Clo ngắn gọn, chi tiết sẽ giúp học sinh nắm vững kiến thức trọng tâm Hóa 9 Bài 26.
Lý thuyết Hóa 9 Bài 26: Clo
Bài giảng Hóa 9 Bài 26: Clo
I. Tính chất vật lí
- Clo là chất khí, màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí
( ) và tan được trong nước.
- Ở 20oC, một thể tích nước hòa tan được 20 thể tích khí clo.
- Tác dụng sinh lí: Clo là một khí độc.

Hình 1: Bình chứa khí clo
II. Tính chất hoá học
1. Clo có những tính chất hóa học của phi kim
a. Tác dụng kim loại → muối clorua
- Clo phản ứng với với hầu hết kim loại tạo thành muối clorua
- Ví dụ:
2Fe + 3Cl2 2FeCl3 (sắt(III) clorua)
2Na + Cl2 2NaCl (natri clorua)

Hình 2: Sắt tác dụng với clo
b. Tác dụng hiđro → khí hiđro clorua
- Phương trình hóa học:
H2 (k) + Cl2 (k) 2HCl (k) (khí hiđro clorua)
- Khí hiđro clorua tan nhiều trong nước tạo thành dung dịch axit clohiđric.
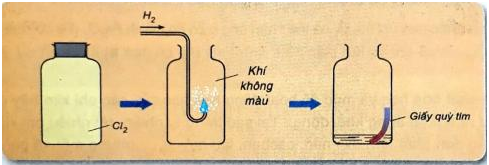
Hình 3: Khí hiđro tác dụng với khí clo.
Chú ý: Clo không phản ứng trực tiếp với oxi.
2. Tính chất hóa học khác của clo
a. Tác dụng với nước
- Phương trình hóa học:
Cl2 (k) + H2O (l) HCl (dd) + HClO (dd)
- Nước clo là dung dịch hỗn hợp các chất Cl2, HCl, HClO có màu vàng lục, mùi hắc.
- Khi cho quỳ tím vào nước clo, lúc đầu dung dịch làm quỳ tím hóa đỏ, sau đó nhanh chóng mất màu do tác dụng oxi hóa mạnh của axit hipoclorơ HClO.
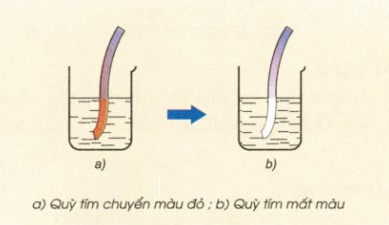
Hình 4: Nhúng giấy quỳ tím vào nước clo
- Nước clo có tính tẩy màu, sát trùng.
b. Tác dụng với dung dịch kiềm (NaOH, KOH, …)
- Khí clo có thể tác dụng với dung dịch kiềm.
Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
- Dung dịch hỗn hợp hai muối natri clorua (NaCl) và natri hipoclorit (NaClO) được gọi là nước Gia - ven. Dung dịch này có tính tẩy màu tương tự nước clo, vì NaClO cũng là chất oxi hóa mạnh tương tự HClO.
III. Ứng dụng của clo
- Nước clo dùng khử trùng nước sinh hoạt.
- Tẩy trắng vải sợi, bột giấy....
- Điều chế nước Gia - ven, clorua vôi...
- Điều chế nhựa PVC, chất dẻo, chất màu...
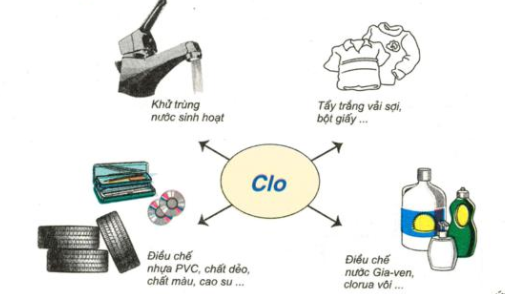
Hình 5: Sơ đồ về một số ứng dụng của khí clo
IV. Điều chế khí Clo
1. Trong phòng thí nghiệm
- Phương pháp Đun nóng nhẹ dung dịch HCl đậm đặc với các chất oxi hóa mạnh như MnO2, KMnO4,...
- Ví dụ:
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
- Thu khí clo bằng cách đẩy không khí.
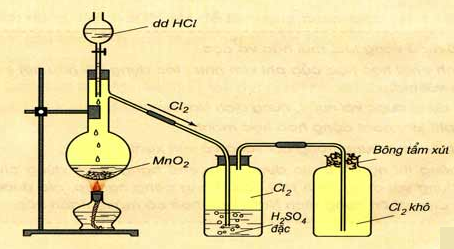
Hình 6: Điều chế clo trong phòng thí nghiệm
2. Trong công nghiệp
Phương pháp Điện phân dung dịch NaCl bão hòa (có màng ngăn xốp ngăn không cho khí Cl2 thoát ra tác dụng với NaOH tạo thành nước Gia-ven)
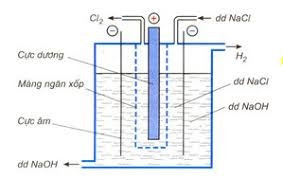
Hình 7: Sơ đồ thùng điện phân dung dịch NaCl
Trắc nghiệm Hóa học 9 Bài 26: Clo
Câu 1: Dung dịch nước clo có màu gì?
A. Vàng lục
B. Xanh lục
C. Hồng
D. Tím
Câu 2: Tính chất hóa học của clo là
A. Tác dụng với hầu hết kim loại
B. Tác dụng với hiđro
C. Tác dụng với nước, với dung dịch kiềm
D. A, B, C đều đúng
Câu 3: Đốt cháy 12 gam magie trong khí clo thu được 19 gam magie clorua. Hiệu suất của phản ứng trên là
A. 25%
B. 30%
C. 35%
D. 40%
Câu 4: Ứng dụng của clo là
A. Nước clo dùng khử trùng nước sinh hoạt
B. Điều chế nước Gia – ven, clorua vôi, tẩy trắng vải sợi, bột giấy
C. Điều chế nhựa PVC, chất dẻo, chất màu…
D. A, B, C đều đúng
Câu 5: Axit được dùng để điều chế khí clo trong phòng thí nghiệm là
A. H2SO3
B. HNO3
C. HCl đặc
D. H2SO4
Câu 6: Đốt cháy hoàn toàn 20,4 gam hỗn hợp X gồm Al, Zn trong khí clo dư, thu được 41,7 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 6,72 lít
B. 4,48 lít
C. 5,60 lít
D. 3,36 lít
Câu 7: Khí clo không tác dụng với
A. Dung dịch NaOH
B. Khí O2
C. Dung dịch Ca(OH)2
D. H2O
Câu 8: Trong công nghiệp, clo được điều chế bằng phương pháp gì?
A. Chưng cất phân đoạn không khí.
B. Nhiệt phân
C. Thủy phân
D. Điện phân dung dịch
Câu 9: Cho dung dịch NaOH 1M để tác dụng vừa đủ với 2,24 lít khí clo (đktc). Nồng độ mol của muối natri clorua thu được là
A. 2M
B. 1M
C. 0,5M
D. 1,5M
Câu 10: Chất được dùng để làm khô khí clo ẩm là
A. NaOH khan
B. CaO
C. Na2SO3 khan
D. Dung dịch H2SO4 đặc
Xem thêm các bài tổng hợp lý thuyết Hóa lớp 9 đầy đủ, chi tiết khác:
Lý thuyết Bài 28: Các oxit của cacbon
Lý thuyết Bài 29: Axit cacbonic và muối cacbonat
Lý thuyết Bài 30: Silic. Công nghiệp silicat
Lý thuyết Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9
