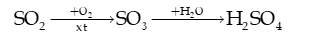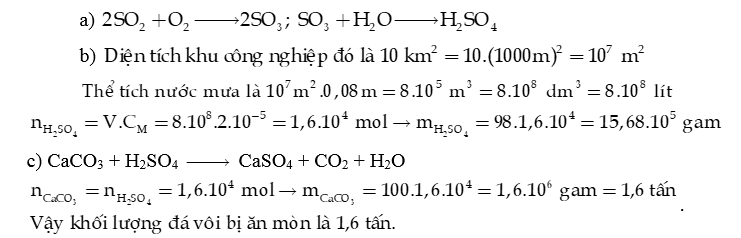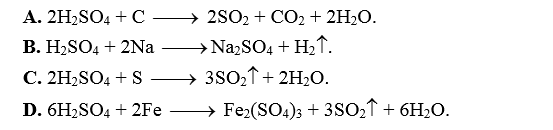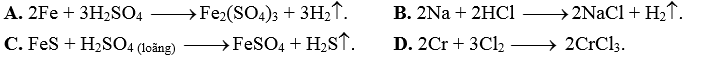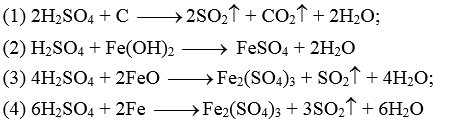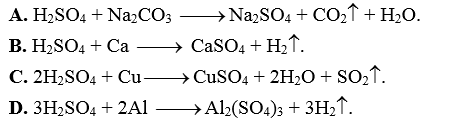Ôn tập Sulfur và hợp chất của Sulfur | Chuyên đề dạy thêm Hoá học 11
Tài liệu Ôn tập Sulfur và hợp chất của Sulfur gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
A. CÁC DẠNG CÂU HỎI TỰ LUẬN.
Câu 1: Hoàn thành các phương trình hóa học sau:
|
1 |
H2 + S |
|
CuO + H2SO4 |
|
2 |
H2S + SO2 |
|
Fe + H2SO4 đặc |
|
3 |
Fe + S |
|
FeS2 + O2 |
|
4 |
S + O2 |
|
H2SO4 đặc + C |
|
5 |
S + F2 |
|
H2SO4 đặc + KBr |
|
6 |
SO2 + O2 |
|
H2SO4 + K2CO3 |
|
7 |
SO2 + H2S |
|
H2SO4 (đặc) + Fe2O3 |
|
8 |
SO2 + H2O + Br2 |
|
H2SO4 + Mg(OH)2 |
|
9 |
SO2 + H2O + KMnO4 |
|
H2SO4 + SO3 |
|
10 |
Fe + H2SO4 loãng |
|
H2SO4.nSO3 + H2O |
Câu 2: Mưa acid gây phá hủy rộng lớn cho rừng cây khắp nơi trên thế giới. Mưa acid xảy ra chủ yếu do sự phóng thích SO2 từ sự nung quặng sunfua và sự đốt cháy các nhiên liệu. Trong không khí, một phần SO2 chuyển thành SO3 được hấp thụ trong nước mưa chuyển thành sunfuric acid. Giả sử rằng cứ 8.104 phân tử nước (chứa trong 5,4.104 lít nước của một trận mưa) hấp thụ một phân tử SO3 và toàn bộ sunfuric acid đều tan trong lượng mưa nêu trên.
Cho H = 1,008; O = 16,00; S = 32,06; NA = 6,022x1023
Giả sử khối lượng riêng của nước (lỏng) là 1,00 g/mL
Hướng dẫn giải
Khối lượng nước là 5,4.104.1000 = 5,4.107 gam
Câu 3: Hiện nay, mưa acid, hiệu ứng nhà kính và thủng tầng ozone là ba thảm hoạ môi trường toàn cầu. Mưa acid tàn phá nhiều rừng cây, các công trình kiến trúc bằng đá và kim loại. Tác nhân chủ yếu gây ra mưa acid là sulfur dioxide.
a) Trong khí quyển, SO2 chuyển hoá thành H2SO4 trong nước mưa theo sơ đồ sau:
Viết các phương trình hoá học.
b) Một cơn mưa acid xuất hiện tại một khu công nghiệp diện tích 10 km2 với lượng mưa trung bình 80 mm (lượng nước mưa trên 1 m2). Hãy tính:
- Thể tích nước mưa đã rơi xuống khu công nghiệp.
- Khối lượng H2SO4 trong lượng nước mưa, biết nồng độ H2SO4 trong nước mưa là .
c) Lượng acid trong nước mưa có thể ăn mòn các công trình bằng đá vôi.
- Viết 1 phương trình hoá học minh hoạ.
- Khối lượng tối đa bị ăn mòn bởi lượng acid trên.
d) Em hãy tìm hiểu về nguyên nhân phát sinh các khí gây mưa acid và đề xuất giải pháp hạn chế.
Hướng dẫn giải:
B. CÁC DẠNG CÂU HỎI TRẮC NGHIỆM.
Câu 4: Kim loại nào sau đây tác dụng với sulfur ở nhiệt độ thường?
A. Al.
B. Fe.
C. Hg.
D. Cu.
Câu 5: Dung dịch sulfuric acid loãng tác dụng với Fe tạo thành khí H2 và:
A. FeSO4.
B. Fe2(SO4)3.
C. Fe(OH)2.
D. Fe(OH)3.
Câu 6: Số oxi hóa có thể có của sulfur trong hợp chất là
A. 0, 2, 4, 6.
B. -2, 0, +4, +6.
C. 1, 3, 5, 7.
D. -2, +4, +6.
Câu 7: Thuốc thử để nhận biết sulfuric acid và dung dịch muối sulfate là
A. AgNO3.
B. NaCl.
C. BaCl2.
D. KNO3.
Câu 8: Cho vài giọt dung dịch BaCl2 vào dung dịch nào sau đây sẽ tạo kết tủa trắng?
A. NaCl.
B. Na2SO4.
C. NaNO3.
D. NaOH.
Câu 9: Dung dịch H2SO4 loãng phản ứng được với tất cả các kim loại thuộc dãy nào sau đây?
A. Cu, Na.
B. Ag, Zn.
C. Mg, Al.
D. Au, Pt.
Câu 10: Acid H2SO4 loãng tác dụng với Fe tạo thành sản phẩm là
A. Fe2(SO4)3 và H2.
B. FeSO4 và H2.
C. FeSO4 và SO2.
D. Fe2(SO4)3 và SO2.
Câu 11: Chất X tan trong nước và tác dụng được với dung dịch H2SO4 loãng. Chất X là chất nào sau đây?
A. FeS.
B. PbS.
C. Na2S.
D. CuS.
Câu 12: Kim loại nào sau đây tác dụng với dung dịch H2SO4 loãng và dung dịch H2SO4 đặc nóng cho 2 loại muối khác nhau?
A. Fe.
B. Mg.
C. Cu.
D. Ag.
Câu 13: Phản ứng nào sau đây sulfur đóng vai trò là chất oxi hóa?
A. S + O2 SO2
B. S + 2Na Na2S
C. S + 2H2SO4 (đ) 3SO2 + 2H2O
D. S + 6HNO3 (đ) H2SO4 + 6NO2 + 2H2O
Câu 14: Oleum có công thức tổng quát là
A. H2SO4.nSO2.
B. H2SO4.nH2O.
C. H2SO4.nSO3.
D. H2SO4 đặc.
Câu 15: Người ta nung nóng Cu với dung dịch H2SO4 đặc, nóng. Khí sinh ra có tên gọi là
A. Khí oxygen.
B. Khí hydrogen.
C. Khí cacbonic.
D. Khí sunfurơ.
Câu 16: Trường hợp nào sau đây có phản ứng?
A. H2SO4 loãng + Cu.
B. H2SO4 loãng + S.
C. H2SO4 đặc, nguội + Al.
D. H2SO4 đặc + Na2CO3.
Câu 17: Nhóm gồm tất cả các kim loại tan trong dung dịch H2SO4 đặc nóng nhưng không tan trong dung dịch H2SO4 loãng là
A. Hg, Ag, Cu.
B. Al, Fe, Cr.
C. Ag, Fe, Pt.
D. Al, Cu, Au.
Câu 18: Cho chất rắn nào sau đây vào dung dịch H2SO4 đặc thì xảy ra phản ứng oxi hoá khử?
A. KBr.
B. NaCl.
C. CaF2.
D. CaCO3.
Câu 19: Khi pha loãng dung dịch sulfuric acid đặc cần tuân thủ thao tác nào sau đậy để đảm bảo an toàn?
A. Rót từ từ acid vào nước.
B. Rót nhanh acid vào nước.
C. Rót từ từ nước vào acid.
D. Rót nhanh nước vào acid.
Câu 20: Phản ứng điều chế xảy ra ở điều kiện nào sau đây?
A. Nhiệt độ phòng.
B. Đun nóng đến .
C. Đun nóng đến và có mặt chất xúc tác V2O5.
D. Nhiệt độ phòng và có mặt chất xúc tác V2O5.
Câu 21: Dãy gồm tất cả các chất đều tác dụng với dung dịch H2SO4 loãng là
A. Fe3O4, BaCl2, NaCl, Al, Cu(OH)2.
B. Fe(OH)2, Na2CO3, Fe, CuO, NH3.
C. CaCO3, Cu, Al(OH)3, MgO, Zn.
D. Zn(OH)2, CaCO3, CuS, Al, Fe2O3.
Câu 22: H2SO4 đặc, nguội không tác dụng được với tất cả các kim loại thuộc nhóm nào?
A. Al, Mg, Fe.
B. Fe, Al, Cr.
C. Ag, Cu, Au.
D. Ag, Cu, Fe.
Câu 23: H2SO4 đặc nóng không tác dụng với chất nào sau đây?
A. Fe.
B. NaCl rắn.
C. Ag.
D. Au.
Câu 24: Dãy chất nào sau đây phản ứng được với dung dịch sulfuric acid đặc nguội?
A. Au,.
B. Mg, Fe.
C. Zn, NaOH.
D. Al, S.
Câu 25: Cho phản ứng Al + H2SO4 đặc Al2(SO4)3 + SO2↑ + H2O. Hệ số cân bằng của H2SO4 là
A. 4.
B. 8.
C. 6.
D. 3.
Câu 26: Trong số những tính chất sau, tính chất nào không là tính chất của Acid H2SO4 đặc nguội?
A. Tan trong nước, tỏa nhiệt.
B. Làm hóa than vải, giấy, đường.
C. Hòa tan được kim loại Al và Fe.
D. Háo nước.
Câu 27: Cho FeCO3 tác dụng với H2SO4 đặc nóng dư. Sản phẩm khí thu được là
A. CO2.
B. H2 và CO2.
C. SO2 và CO2.
B. SO2.
Câu 28: Ở điều kiện thường, chất nào sau đây không có khả năng phản ứng với dung dịch H2SO4 loãng?
A. FeCl3.
B. Fe2O3.
C. Fe3O4.
D. Fe(OH)3.
Câu 29: Acid sunfuric đặc được sử dụng để làm khô các chất khí ẩm. Loại khí nào sau đây có thể được làm khô nhờ sulfuric acid?
A. Khí cacbonic.
B. Khí oxygen.
C. Khí ammonia.
D. A và B .
Câu 30: Có thể dùng H2SO4 đặc để làm khô tất cả các khí trong dãy nào?
A. CO2, NH3, Cl2, N2.
B. CO2, H2S, N2, O2.
C. CO2, N2, SO2, O2.
D. CO2, H2S, O2, N2.
Câu 31: Trong các phản ứng sau đây, ở phản ứng nào acid H2SO4 là acid loãng?
Câu 32: Dãy chất nào sau đây gồm những chất đều tác dụng được với dung dịch H2SO4 loãng?
A. Cu, ZnO, NaOH.
B. CuO, Fe(OH)2, NaCl.
C. Mg, ZnO, CaCO3.
D. CaCO3, Mg(OH)2, BaSO4.
Câu 33: Kim loại nào sau đây khi tác dụng với lượng dư dung dịch H2SO4 loãng và dung dịch H2SO4 đặc, đun nóng thu được một loại muối?
A. Cu.
B. Cr.
C. Fe.
D. Mg.
Câu 34: Phương trình hóa học nào sau đây là sai?
Câu 35: Trong điều kiện thích hợp, xảy ra các phản ứng sau:
Trong các phản ứng trên, phản ứng xảy ra với dung dịch H2SO4 loãng là
A. (1).
B. (3).
C. (2).
D. (4).
Câu 36: Cho phản ứng hóa học: S + H2SO4 đặc X + H2O. Vậy X là chất nào sau đây?
A. SO2.
B. H2S.
C. H2SO3.
D. SO3.
Câu 37: Oxide X là chất khí, mùi hắc, độc (gây ho, viêm đường hô hấp). Trong công nghiệp, X được dùng làm chất tẩy trắng bột gỗ, sản xuất sulfuric acid. Công thức của X là
Câu 38: Nhỏ 1 giọt dung dịch acid đặc nào sau đây lên tờ giấy trắng thì tờ giấy bị hoá đen ở chỗ tiếp xúc với acid?
Câu 39: Trong công nghiệp, quặng pyrite sắt được dùng làm nguyên liệu để
A. luyện gang.
B. sản xuất sulfuric acid.
C. chế tạo nam châm điện.
D. tổng hợp dược phẩm.
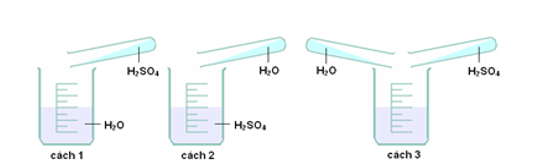
Câu 40: Để pha loãng H2SO4 đặc cách làm nào sau đây đúng?
A. cách 1.
B. cách 2.
C. cách 3.
D. cách 1 và 2.
Câu 41: Trong các phản ứng sau đây, phản ứng nào dung dịch H2SO4 là acid đặc?
Câu 42: Cho các chất: Cu, CuO, BaSO4, Mg, KOH, C, Na2CO3. Tổng số chất tác dụng với dung dịch H2SO4 đặc, nóng là
A. 4.
B. 5.
C. 6.
D. 7.
Câu 43: Cho các chất sau: O2 (1), HCl (2), H2S (3), H2SO4 đặc (4), SO2 (5). Số chất có khả năng làm mất màu dung dịch nước bromine?
A. 1.
B. 2.
C. 4.
D. 3.
Câu 44: Cho các chất: C, Cu, ZnS, Fe2O3, CuO, NaCl rắn, Mg(OH)2. Có bao nhiêu chất tác dụng với H2SO4 đặc, nóng, tạo khí là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 45: Xét sơ đồ phản ứng giữa Mg và dung dịch H2SO4 đặc nóng: Mg + H2SO4 MgSO4 + S + H2O. Tổng hệ số cân bằng (số nguyên, tối giản) của các chất trong phản ứng trên là
A. 15.
B. 12.
C. 14.
D. 13.
Câu 46: Cho phương trình hoá học: P + H2SO4 H3PO4 + SO2↑ + H2O. Hệ số của chất oxi hoá và hệ số của chất khử lần lượt là
A. 5 và 2.
B. 2 và 5.
C. 7 và 9.
D. 7 và 7.
Câu 47: Nhận biết các chất sau: NH4NO3; (NH4)2SO4; NaCl; Na2SO4; AlCl3 bằng:
A. dung dịch AgNO3.
B. dung dịch BaCl2.
C. dung dịch Ba(OH)2.
D. dung dịch KOH.
Câu 48: Có 3 dung dịch: NaOH, HCl, H2SO4. Thuốc thử duy nhất để phân biệt 3 dung dịch là
A. Na2CO3.
B. CaCO3.
C. Al.
D. Quỳ tím.
Câu 49: Hai chất nào sau đây khi trộn với nhau có thể xảy ra phản ứng hóa học?
A. S + H2SO4 đặc.
B. CO2 + BaCl2.
C. FeCl2 + H2S.
D. HNO3+ Na2SO4.
Câu 50: Dãy chất gồm những chất chỉ thể hiện tính oxi hóa trong các phản ứng oxi - hóa khử là
A. H2SO4 đặc nóng, F2.
B. SO2, H2SO4 đặc nóng.
C. F2, SO2.
D. S, SO2.
Câu 51: Khi làm thí nghiệm với H2SO4 đặc, nóng thường sinh ra khí SO2. Để hạn chế tốt nhất khí SO2 thoát ra gây ô nhiễm môi trường, người ta nút ống nghiệm bằng bông tẩm dung dịch nào sau đây?
A. Giấm ăn.
B. Muối ăn.
C. Cồn.
D. Xút.
Câu 52: Trong công nghiệp, để sản xuất H2SO4 đặc, người ta thu khí SO3 trong tháp hấp thụ bằng
A. H2O.
B. H2SO4 98%.
C. H2SO4 loãng.
D. BaCl2 loãng.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Chủ đề 5: Sulfur và Sulfur dioxide
Chủ đề 6: Sulfuric acid và muối Sulfate
Chủ đề 7: Một số dạng bài tập về Sulfuric acid loãng
Chủ đề 8: Một số dạng bài tập về Sulfuric acid đặc
Ôn tập Nitrogen và hợp chất của nitrogen
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức