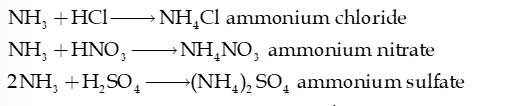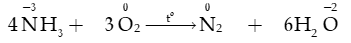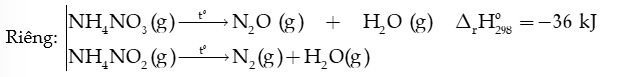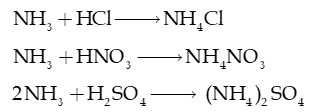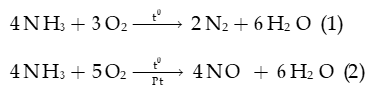Chủ đề 2: Ammonia muối ammonium | Chuyên đề dạy thêm Hoá học 11
Tài liệu Chủ đề 2: Ammonia muối ammonium gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
I. AMMONIA
1) Cấu tạo phân tử
- Phân tử ammonia (NH3) có dạng hình chóp tam giác
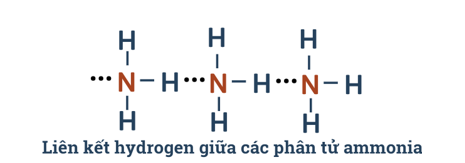
- Nguyên tử N còn một cặp electron không liên kết, tạo ra vùng có mật độ điện tích âm trên nguyên tử N.
- Liên kết N – H tương đối bền với mặt năng lượng liên kết là 386 kJ/mol.
2) Tính chất vật lí
- Ở điều kiện thường, ammonia tồn tại ở thể khí, không màu, nhẹ hơn không khí, mùi khai và xốc và độc.
- Ammonia tan nhiều trong nước (ở điều kiện thường, 1 lít nước hòa tan được 700 lít khí ammonia.
3) Tính chất hóa học
a) Tính base
- Cặp electron hóa trị riêng trên nguyên tử nitrogen (N) gây nên tính base của ammonia (NH3).
- Khi tan trong nước NH3 nhận H+ của nước tạo uon ammonium (NH3)
→ Theo brønted – Lowry, NH3 là một base (nhận H+):
- Dung dịch NH3 có tính base yếu, làm quỳ tím hóa xanh.
- Ammonia (dạng khí cũng như dung dịch) tác dụng với acid tạo thành muối ammonium.
- Ammonia tác dụng với dung dịch muối
Ví dụ: 2NH3 (aq) + 2H2O (l) + MgCl2 (aq) Mg(OH)2 (s) + 2NH4Cl (aq)
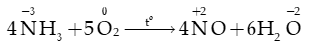
b) Tính khử
Trong phân tử ammonia (NH3), nguyên tử nitrogen (N) có số oxi hóa -3 (số oxi hóa thấp nhất của N) nên NH3 thể hiện tính khử
- Ammonia cháy với ngọn lửa màu vàng:
- Trong công nghiệp, khi có xúc tác Pt, ở nhiệt độ 800 – 900oC:
4) Ứng dụng
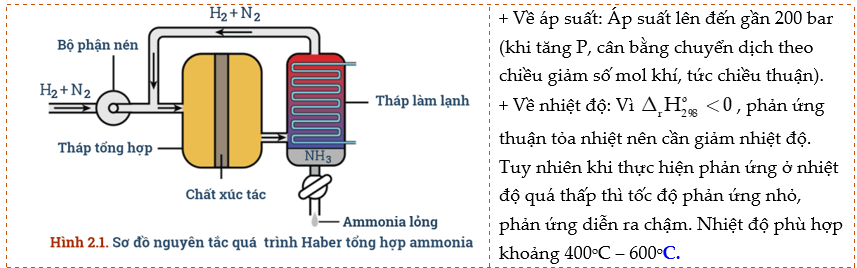
5) Tổng hợp ammonia
- Tổng hợp NH3 thường thực hiện ở nhiệt độ 380 – 450oC
II. MUỐI AMMONIUM
1) Tính tan, sự điện li
- Các muối ammonium: NH4Cl, NH4NO3, NH4ClO4, (NH4)2SO4, NH4H2PO4, (NH4)2HPO4, NH4HCO3, (NH4)2CO3,…
- Hầu hết các muối ammonium đều dễ tan trong nước và phân li hoàn toàn.
Ví dụ: ;
2) Tác dụng với dung dịch kiềm – nhận biết ion ammonium ()
- Muối ammonium tác dụng với dung dịch kiềm (khi đun nóng), tạo khí ammonia (NH3) có mùi khai.
- Ví dụ:
3) Tính chất kém bền nhiệt
Các muối ammonium dễ bị nhiệt phân hủy khi đun nóng tạo khí ammonia (NH3)
Nhận xét: 2 khí khi bay lên gặp nhiệt độ thấp hơn, chúng lại kết hợp với nhau tạo lại tinh thể NH4Cl dạng khói trắng.
4) Ứng dụng của muối ammonium
- Làm phân bón hóa học, chất phụ gia thực phẩm, thuốc long đờm, thuốc bổ sung chất điện giải, chất đánh sạch bề mặt kim loại,…
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
Câu 1: Hoàn thành các phương trình hóa học sau:
Câu 2: a) Viết cấu hình electron của các nguyên tử H (Z = 1) và N (Z = 7).
b) Trình bày các bước lập công thức Lewis của phân tử ammonia.
Câu 3: Trong công nghiệp, phản ứng giữa ammonia với acid được dùng để sản xuất phân bón:
Xác định chất cho, chất nhận proton trong mỗi phản ứng trên. Dùng mũi tên để biểu diễn sự cho, nhận đó.
Câu 4: Hãy giải thích tại sao ammonia tan tốt trong nước.
Câu 5: Trong hai phản ứng oxi hóa ammonia bằng oxygen:
a) Xác định các nguyên tử có sự thay đổi số oxi hóa.
b) Viết quá trình oxi hóa, quá trình khử.
Câu 6: Vận dụng kiến thức về cân bằng hóa học, tốc độ phản ứng, biến thiên enthalpy để giải thích các điều kiện của phản ứng sản xuất ammonia:
a) Nếu tăng hoặc giảm nhiệt độ sẽ ảnh hưởng đến sự chuyển dịch cân bằng và tốc độ phản ứng như thế nào?
b) Nếu giảm áp suất, cân bằng chuyển dịch theo chiều nào? Tại sao không thực hiện ở áp suất cao hơn?
c) Vai trò của chất xúc tác trong phản ứng là gì?
Câu 7: Từ đặc điểm cấu tạo của phân tử ammonia, hãy giải thích tại sao các phân tử ammonia có khả năng tạo liên kết hydrogen mạnh với nhau.
Câu 8: a) Viết phương trình hoá học xảy ra khi cho dung dịch lần lượt tác dụng với lượng dư các dung dịch: HCl, .
b) Trình bày phương pháp hoá học phân biệt ba dung dịch: .
Câu 9: Cho 0,34 gam ammonia phản ứng với oxygen (không dùng chất xúc tác) thu được 0,405 gam H2O và thể tích khí O2 còn dư là 0,37185 mL (đkc).
a) Tính khối lượng O2 phản ứng.
b) Tính hiệu suất phản ứng.
Câu 10: Sục từ từ V lít khí NH3 (đkc) vào 200 mL dung dịch Al2(SO4)3 đến khi được kết tủa lớn nhất. Lọc kết tủa. Để hòa tan lượng kết tủa này cần vừa đủ 500 mL dung dịch NaOH 3M. Tính nồng độ mol của dung dịch Al2(SO4)3 và tính V.
Câu 11: Hấp thụ V lít khí NH3 (đkc) vào dung dịch Al2(SO4)3 dư thu được kết tủa X. Nung kết tủa X đến khối lượng không đổi thu được 1,08 gam chất rắn khan. Tính giá trị của V.
Câu 12: Xét cân bằng của dung dịch NH3 0,1M ở 25oC :
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Câu 13: Xét cân bằng trong dung dịch gồm ở 25oC :
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
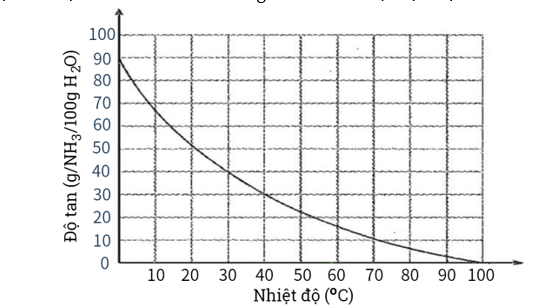
Câu 14: Sự phụ thuộc của độ tan khí ammonia trong nước vào nhiệt độ được mô tả ở hình bên.
Dựa vào đồ thị ở hình bên, hãy xác định:
a) Độ tan của ammonia ở 30oC. Nhận xét về tính tan của ammonia ở nhiệt độ này.
b) Nồng độ phần trăm của dung dịch ammonia bão hoà ở 30oC.
c) Độ tan của ammonia ở 60oC. So sánh với độ tan của ammonia ở 30oC. Giải thích.
Câu 15: a) So sánh phân tử ammonia và ion ammonium về dạng hình học, số liên kết cộng hóa trị, số oxi hóa của nguyên tử nitrogen.
b) Viết phương trình hóa học minh họa tính acid/base của ammonia và ammonium.
PHẦN B. CÁC DẠNG BÀI TẬP TRẮC NGHIỆM
Câu 16: Khi tác dụng với nước và hydrochloric acid, ammonia đóng vai trò là
A. acid.
B. base.
C. chất oxi hoá.
D. chất khử?.
Câu 17: Dung dịch nào sau đây không làm đổi màu quì tím?
A. NaOH.
B. HCl.
C. KCl.
D. NH3.
Câu 18: Hiện tượng xảy ra khi cho giấy quì tím tẩm ướt vào bình đựng khí NH3 thì giấy quỳ tím chuyển thành màu
A. đỏ.
B. xanh.
C. vàng.
D. nâu.
Câu 19: Ở trạng thái lỏng nguyên chất, phân tự chất nào sau đây tạo được liên kết hydrogen với nhau?
A. Nitrogen.
B. Ammonia.
C. Oxygen.
D. Hydrogen.
Câu 20: Khí nào sau đây dễ tan trong nước do tạo được liên kết hydrogen với nước?
A. Nitrogen.
B. Hydrogen.
C. Ammonia.
D. Oxygen.
Câu 21: Trong nước, phân tử/ion nào sau đây thể hiện vai trò là acid Bronsted?
Câu 22: Trong phương pháp Ostwald, ammonia bị oxi hoá bởi oxygen không khí tạo thành sản phẩm chính là
Câu 23: Cho dung dịch NH3 vào dung dịch chất nào sau đây thu được kết tủa trắng?
Câu 24: Cho vài giọt dung dịch phenolphthalein vào dung dịch NH3 , phenolphthalein chuyển sang màu nào sau đây?
A. Hồng.
B. Xanh.
C. Không màu.
D. Vàng.
Câu 25: Nhiệt phân hoàn toàn muối nào sau đây thu được sản phẩm chỉ gồm khí và hơi?
Câu 26: Phân biệt được đung dịch và NaCl bằng thuốc thử là dung dịch
Câu 27: Dùng chất nào sau đây để trung hòa amoniac bị đổ:
A. Giấm ăn.
B. Muối ăn.
C. xà phòng.
D. vôi.
Câu 28: Chất có thể dùng để làm khô khí NH3 là
A. H2SO4 đặc.
B. P2O5.
C. CuSO4 khan.
D. KOH rắn.
Câu 29: Nhận định nào sau đây về phân tử ammonia không đúng?
A. Phân cực mạnh.
B. Có một cặp electron không liên kết.
C. Có độ bền nhiệt rất cao.
D. Có khả năng nhận proton.
Câu 30: Tính base của NH3 do
A. trên N còn cặp e tự do.
B. phân tử có 3 liên kết cộng hóa trị phân cực.
C. NH3 tan được nhiều trong nước.
D. NH3 tác dụng với nước tạo NH4OH.
Câu 31: Muối có trong bột khai sử dụng làm bánh là
A. NH4HCO3.
B. Na2CO3.
C. NH4HSO3.
D. NH4Cl.
Câu 32: Trong các phản ứng dưới đây, phản ứng nào NH3 thể hiện tính base?
A. 8NH3 + 3Cl2 6NH4Cl + N2.
B. 4NH3 + 5O2 4NO + 6H2O.
C. 2NH3 + 3CuO 3Cu + N2 + 3H2O.
D. NH3 + CO2 + H2O NH4HCO3.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Chủ đề 3: Một số hợp chất của nitrogen với oxygen
Chủ đề 5: Sulfur và Sulfur dioxide
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức