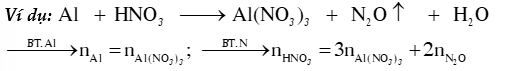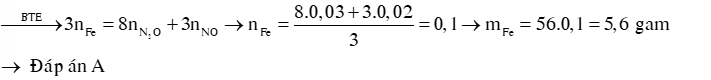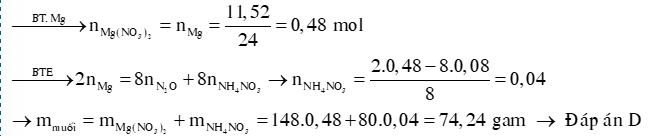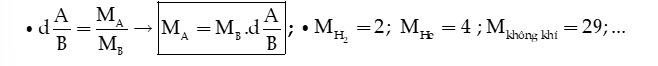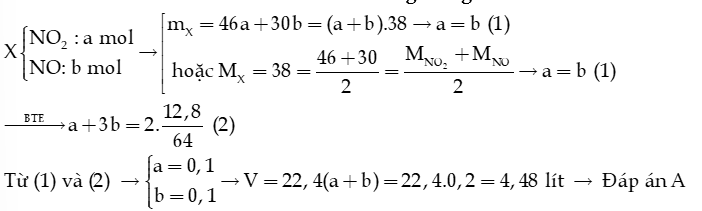Chủ đề 4: Bài tập về HNO3 | Chuyên đề dạy thêm Hoá học 11
Tài liệu Chủ đề 4: Bài tập về HNO3 gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
1) BẢO TOÀN NGUYÊN TỐ
- Bảo toàn nguyên tố trong 1 chất ta có:
Ví dụ: Trong
- Bảo toàn nguyên tố cho 1 phản ứng
Tổng số mol nguyên tử của một nguyên tố trước và sau phản ứng luôn bằng nhau.
2) BẢO TOÀN ELECTRON (BTE)
- Các dấu hiệu có muối NH4NO3 tạo ra:
+ Hỗn hợp X chứa Mg, Al, Zn khi tác dụng với HNO3 thu được khí và dung dịch Y, cô cạn dung dịch Y thu được m gam muối khan → Thường có tạo ra.
+ Kim loại tác dụng với HNO3 không có khí tạo ra → Sản phẩm khử là NH4NO3.
- Các dấu hiệu không có NH4NO3 tạo ra:
+ Kim loại bài cho không chứa kim loại từ K đến Al.
+ Sản phẩm khử chỉ có khí.
+ Dung dịch sản phẩm tác dụng với dung dịch base không có khí bay ra.
- Dung dịch sản phẩm chứa Fe2+, không chứa Fe3+ khi:
+ Bài cho HNO3 tối thiểu cần dùng; + Dung dịch thu được hoà tan tối đa kim loại.
+ Bài cho sản phẩm thu được chứa kim loại dư.
Ví dụ 1: Hòa tan hết một lượng bột sắt vào dung dịch HNO3 loãng,dư thu được hỗn hợp khí gồm 0,03 mol N2O và 0,02 mol NO. Khối lượng sắt đã bị hòa tan là bao nhiêu (trong các giá trị sau).
A. 5,6g. B. 1,5g. C. 2,8g. D. 4,6g.
Hướng dẫn giải:
Ví dụ 2: Cho 11,52 gam Mg vào dung dịch HNO3 loãng dư,kết thúc phản ứng thu được dung dịch X và 0,08 mol khí N2O duy nhất. Cô cạn dung dịch X,thu được lượng muối khan là.
A. 73,44 gam. B. 71,04 gam. C. 72,64 gam. D. 74,24 gam
Hướng dẫn giải:
Dạng 1: MỘT KIM LOẠI TÁC DỤNG VỚI HNO3
Câu 1: Hòa tan 16,8 gam Fe bằng dung dịch HNO3 loãng dư, sinh ra V lít khí NO (sản phẩm khử duy nhất,ở đkc). Giá trị của V là
A. 3,7185.
B. 2,479.
C. 7,41.
D. 4,958.
Câu 2: Hòa tan hoàn toàn 2,4 gam kim loại Mg vào dung dịch HNO3 loãng,chỉ thu được V lít khí N2 sản phẩm khử duy nhất (đkc). Giá trị của V là
A. 0,7437 lít.
B. 7,437 lít.
C. 0,4958 lít.
D. 4,958 lít.
Câu 3: Hoàn tan hoàn toàn 1,92 gam Cu bằng dung dịch HNO3, thu được x mol NO2 (là sản phẩm khử duy nhất của N+5). Giá tri của x là
A. 0,06.
B. 0,18.
C. 0,30.
D. 0,12.
Câu 4: Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng,thu được 0,015 mol khí N2O (sản phẩm khử duy nhất) và dung dịch X. Số mol acid HNO3 đã tham gia phản ứng là
A. 0,17.
B. 0,15.
C. 0,19.
D. 0,12.
Câu 5: Cho m gam Al phản ứng hoàn toàn với dung dịch HNO3 loãng (dư),thu được 4,958 lít khí NO (đkc, sản phẩm khử duy nhất). Giá trị của m là
A. 4,05.
B. 8,10.
C. 2,70.
D. 5,40.
Câu 6: Hoà tan hoàn toàn m gam sắt bằng dung dịch HNO3, sau phản ứng thu được 3,7185 lít NO2 (đkc) là sản phẩm khử duy nhất,dung dịch X và 2,8 gam chất rắn không tan. Giá trị của m là
A. 2,8 gam.
B. 5,6 gam.
C. 7,0 gam.
D. 8,4 gam.
Câu 7: Hoà tan hoàn toàn 4,8 gam Mg bằng dung dịch HNO3 loãng, dư, sau phản ứng chỉ thu được dung dịch X và không thấy xuất hiện khí. Khối lượng muối có trong X là
A. 29,6 gam.
B. 33,6 gam.
C. 44,4 gam.
D. 59,2 gam.
Câu 8: Hòa tan hoàn toàn 14,58 gam Al trong dung dịch HNO3 loãng,đun nóng thì có 2,0 mol HNO3,đã phản ứng,đồng thời có V lít khí N2 thoát ra (đkc). Giá trị của V là
A. 2,479.
B. 3,09875.
C. 0,12395.
D. 1,85925.
Câu 9: Cho 1,68 gam bột Mg tác dụng vừa đủ với 500 mL dung dịch HNO3 nồng độ x mol/L thu được dung dịch Y và 0,4958 lít khí NO (đkc). Giá trị của X là
A. 0,373.
B. 0,36.
C. 0,32.
D. 0,16.
Câu 10: Cho 2,16 gam Al tan hoàn toàn trong dung dịch chứa HNO3 vừa đủ (không thấy khí thoát ra)thu được dung dịch X có chứa m gam muối. Giá trị của m là
A. 17,04.
B. 19,44.
C. 11,19.
D. 13,64.
XÁC ĐỊNH KIM LOẠI, XÁC ĐỊNH SẢN PHẨM KHỬ
Câu 11: Cho 19,2 gam kim loại M tan hết trong dung dịch HNO3 dư thu được 4,958 lít khí NO duy nhất (đkc). Kim loại M là
A. Fe.
B. Mg.
C. Al.
D. Cu.
Câu 12: Hoà tan hết 16,2gam kim loại M bằng dung dịch HNO3 được 6,1975 lít khí X gồm NO và N2 có khối lượng là 7,2g.Biết rằng N+2 và N0 là sản phẩm khử của N+5.Kim loại M là
A. Fe.
B. Al.
C. Zn.
D. Mg.
Câu 13: Hoà tan hết 2,4g kim loại M bằng dung dịch HNO3 dư được 0,4958 lít khí N2 là sản phẩm khử duy nhất đkc. Kim loại M là
A. Zn.
B. Mg.
C. Al.
D. Ca.
Câu 14: Cho 0,04 mol Mg tan hết trong dung dịch HNO3 thấy thoát ra 0,01 mol khí X là sản phẩm khử duy nhất (đkc). Khí X là
A. N2.
B. NH3.
C. NO.
D. N2O.
Câu 15: Cho 13,92 gam Fe3O4 tác dụng hết trong dung dịch HNO3 thấy thoát ra 0,4958 lít khí NxOy (đkc). Khí NxOy là
A. NO.
B. N2O.
C. NO2.
D. N2.
Câu 16: Hoà tan 11,2 gam Fe trong HNO3 dư tạo thành 7,437 lít (đkc)hỗn hợp khí gồm NO và khí X có tỉ lệ thể tích 1:1. Khí X là
A. N2O5.
B. N2O.
C. NO2.
D. N2.
Câu 17: Hoà tan hết 2,16 gam FeO trong 0,1 mol HNO3 vừa đủ thấy thoát ra khí X là sản phẩm khử duy nhất.Khí X là
A. NO2.
B. N2.
C. N2O.
D. NO.
Câu 18: Cho 3,6 gam Mg tác dụng hết với dung dịch HNO3 (dư), sinh ra 0,7437 lít khí X (sản phẩm khử duy nhất, ở đkc). Khí X là
A. N2O.
B. NO2.
C. N2.
D. NO.
Câu 19: Cho 0,05 mol Mg phản ứng vừa đủ với 0,12 mol HNO3 giải phóng ra khí X là sản phẩm khử duy nhất. Khí X là
A. NH3.
B. NO.
C. N2.
D. N2O
Dạng 2: Hỗn hợp kim loại tác dụng với HNO3
Câu 20: Cho m gam Cu tác dụng hết với dung dịch HNO3 thu được 9,916 lít hỗn hợp NO và NO2 có khối lượng 15,2 gam. Giá trị của m là
A. 25,6 g.
B. 16,0 g.
C. 19,2 g.
D. 12,8 g.
Câu 21: Hoà tan hoàn toàn m gam Al vào dung dịch HNO3 rất loãng thu được hỗn hợp gồm 0,015 mol N2O và 0,01 mol NO (không có sản phẩm NH4NO3). Giá trị của m là
A. 1,35 g.
B. 0,81 g.
C. 1,92 g.
D. 1,08 g.
Câu 22: Cho 11g hỗn hợp gồm Al và Fe vào dung dịch HNO3 dư được 7,437 lít NO đkc là sản phẩm khử duy nhất. Khối lượng của Al và Fe lần lượt là
A. 5,6g và 5,4g.
B. 5,4g và 5,6g.
C. 4,4g và 6,6g.
D. 4,6g và 6,4g.
Câu 23: Hoà tan hết 1,84 gam hỗn hợp Mg và Fe trong dung dịch HNO3 dư thấy thoát ra 0,04 mol khí NO duy nhất. Số mol Mg và Fe lần lượt là
A. 0,02 và 0,03 mol.
B. 0,03 và 0,03 mol.
C. 0,03 và 0,02 mol.
D. 0,01 và 0,01 mol.
Câu 24: Cho hỗn hợp Al, Fe vào dung dịch HNO3 loãng,dư thu được 7,437 lít NO (là sản phẩm khử duy nhất của N+5 ở đkc). Số mol acid đã phản ứng là
A. 0,3 mol.
B. 0,6 mol.
C. 1,2 mol.
D. 2,4 mol.
Câu 25: Hoà tan hết hỗn hợp gồm 0,05 mol Fe và 0,03 mol Ag vào dung dịch HNO3 thoát ra V lít hỗn hợp khí A (đkc) gồm NO và NO2 có tỉ lệ mol tương ứng là 2:3. Giá trị của V là
A. 3,7185.
B. 14,874.
C. 4,958.
D. 2,479.
Câu 26: Hòa tan hoàn toàn 19,2 gam kim loại M trong dung dịch HNO3 dư thu được 9,916 lít (đkc) hỗn hợp khí gồm NO2 và NO có tỉ lệ thể tích là 3: 1. Kim loại M là
A. Ag.
B. Cu.
C. Fe.
D. Al.
Câu 27: Hoà tan hết 35,4 gam hỗn hợp Ag và Cu trong dung dịch HNO3 loãng thu được 6,1975 lít khí duy nhất không màu hoá nâu trong không khí. Khối lượng Ag trong hỗn hợp là
A. 16,2 gam.
B. 19,2 gam.
C. 32,4 gam.
D. 35,4 gam.
Câu 28: Hoà tan hoàn toàn 3,6 gam Mg bằng dung dịch chứa 0,42 mol HNO3 (vừa đủ).Sau phản ứng thu được dung dịch X và 0,61975 lít hỗn hợp khí Y gồm N2O và N2 (đkc). Khối lượng muối trong X là
A. 22,20 gam.
B. 25,16 gam.
C. 29,36 gam.
D. 25,00 gam.
Câu 29: Hòa tan 5,95 gam hỗn hợp Zn, Al tỉ lệ mol 1:2 bằng dung dịch HNO3 loãng dư thu được 0,9916 lít một sản phẩm khử X duy nhất chứa nitrogen.X là
A. N2O.
B. N2.
C. NO.
D. NH4NO3.
Câu 30: Hòa tan hoàn toàn hỗn hợp X gồm 7,8 gam Zn và 4,05 gam Al trong dung dịch HNO3 vừa đủ,thu được dung dịch Y chứa 57,03 gam muối và thoát ra 1,3944375 lít (đkc) khí Z duy nhất. Khí Z là
A. NO.
B. NO2.
C. N2.
D. N2O.
Câu 31: Hòa tan hoàn toàn 7,5 gam hỗn hợp gồm Mg và Al bằng lượng vừa đủ V lít dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 0,7437 lít N2 (ở đkc) duy nhất và dung dịch chứa 54,9 gam muối. Giá trị của V là
A. 0,72.
B. 0,65.
C. 0,70.
D. 0,86.
BẢO TOÀN ELECTRON + PP TRUNG BÌNH
3) PHƯƠNG PHÁP TRUNG BÌNH
Với bài toán vô cơ,ta thường áp dụng cho khối lượng mol trung bình:
2)Tỉ khối hơi của khí A so với khí B (kí hiệu là: )
Ví dụ: Hòa tan hoàn toàn 12,8 gam Cu trong dung dịch HNO3 thu được V lít hổn hợp khí X (đkc) gồm NO2 và NO.Biết tỉ khối của X so với H2 là 19. Giá trị của V là
A. 4,958.
B. 2,479.
C. 3,7185.
D. 7,437.
Hướng dẫn giải:
Câu 32: Hoà tan hoàn toàn m gam Cu trong dung dịch HNO3 thu được 1,2395 lít hỗn hợp khí NO và NO2 (đkc) có tỉ khối hơi đối với H2 là 16,6. Giá trị của m là
A. 8,32.
B. 3,90.
C. 4,16.
D. 6,40.
Câu 33: Hoà tan hoàn toàn 24,3g Al vào dung dịch HNO3 loãng dư thu được V lít hỗn hợp khí (đkc) gồm NO và N2O có tỉ khối hơi so với H2 là 20,25. Giá trị của V là
A. 7,437.
B. 2,479.
C. 9,916.
D. 12,395.
Câu 34: Cho a gam Al phản ứng hết với acid HNO3 thu được 9,916 lít (đkc) hỗn hợp khí NO và N2O có tỉ khối hơi so với hydrogen bằng 16,75. Giá trị của a là
A. 17,5.
B. 13,5.
C. 15,3.
D. Có kết quả khác.
Câu 35: Hòa tan hết 10,8 gam Al trong dung dịch acid HNO3 thu được hỗn hợp A gồm NO và NO2 có tỉ khối hơi so với H2 là 19. Thể tích mỗi khí trong hỗn hợp A (đkc) là
A. 3,7185 lít và 4,958 lít.
B. 7,437 lít và 7,437 lít.
C. 3,7185 lít và 7,437 lít.
D. 4,958 lít và 6,1975 lít.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Chủ đề 5: Sulfur và Sulfur dioxide
Chủ đề 6: Sulfuric acid và muối Sulfate
Chủ đề 7: Một số dạng bài tập về Sulfuric acid loãng
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức