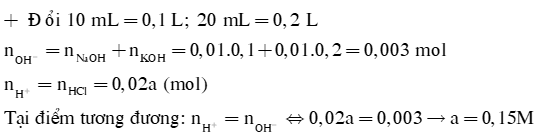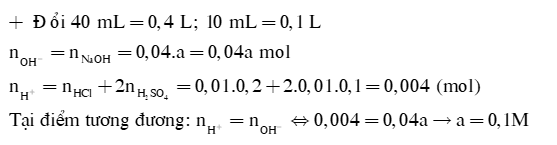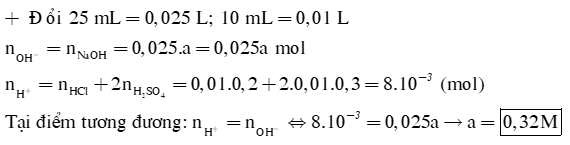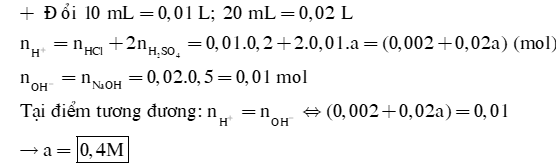Chủ đề 5: Chuẩn độ Acid - Base | Chuyên đề dạy thêm Hoá học 11
Tài liệu Chủ đề 5: Chuẩn độ Acid - Base gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
1) Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
+ Dựa vào thể tích của các dung dịch khi phản ứng vừa đủ với nhau, xác định được nồng độ dung dịch chất cần chuẩn độ.
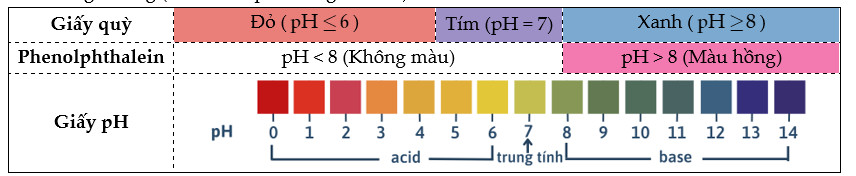
+ Dùng chất chỉ thị acid – base như (giấy quỳ tím, giấy pH, phenolphathlein,…) để xác định pH ở thời điểm tương đương (thời điểm phản ứng vừa đủ).
- Chuẩn độ dung dịch acid
+ Dung dịch chuẩn đã biết nồng độ là dung dịch base.
+ Cho dung dịch base đã biết nồng độ phản ứng vừa đủ với dung dịch acid (cần chuẩn độ).
- Chuẩn độ dung dịch base
+ Dung dịch chuẩn đã biết nồng độ là dung dịch acid.
+ Cho dung dịch acid đã biết nồng độ phản ứng vừa đủ với dung dịch base (cần chuẩn độ).
2) Tiến hành chuẩn độ
Thí nghiệm: Chuẩn độ base mạnh bằng dung dịch chuẩn acid mạnh
Chuẩn bị:
- Dung dịch HCl 0,1M; dung dịch NaOH chưa biết nồng độ (khoảng 0,1M); dung dịch phenolphthalein.
- Pipette 10 mL; Burette 25 mL; bình tam giác 100 mL; bình tia nước cất; giá đỡ; kẹp burete.
Tiến hành:
+ Bước 1: Tráng sạch burette bằng nước cất, sau đó tráng lại bằng một ít dung dịch NaOH. Lắp dụng cụ như hình 2.2, xoay vạch đọc thể tích về phía mắt. Cho dung dịch NaOH vào cốc thủy tinh, sau đó rót vào burette (đã khóa) và chỉnh về vạch 0.
+ Bước 2: Dùng pipette lấy dung dịch HCl 0,1M cho vào ba bình tam giác, mỗi bình 10,00 mL. Dùng ống hút nhỏ giọt để lấy chất chỉ thị, nhỏ 1 – 2 giọt phenolphthalein vào các bình tam giác.
+ Bước 3: Vặn khóa burette để dung dịch NaOH trong burette chảy từ từ vào bình tam giác. Quan sát đến khi dung dịch trong bình xuất hiện màu hồng nhạt bền trong khoảng 30 giây thì dừng lại.
+ Bước 4: Đọc thể tích dung dịch NaOH trên vạch của burette.
+ Bước 5: Lặp lại ít nhất 3 lần. Lấy giá trị trung bình của 3 lần chuẩn độ.
Phần I. Đề bài
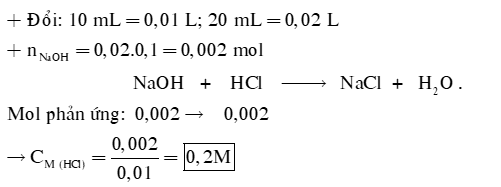
Câu 1: Để xác định nồng độ của một dung dịch HCl, người ta đã tiến hành chuẩn độ bằng dung dịch NaOH 0,1M. Để chuẩn độ 10 mL dung dịch HCl này cần 20 mL dung dịch NaOH. Xác định nồng độ của dung dịch HCl trên.
Câu 2: Tính nồng độ, thể tích dung dịch chuẩn độ.
|
STT |
Chuẩn độ dung dịch |
Tính nồng độ, thể tích dung dịch chuẩn độ |
|
1 |
Dùng 10mL dung dịch X gồm NaOH 0,1M và KOH 0,2M để chuẩn độ 20mL dung dịch HCl aM. Tính a |
|
|
2 |
Cho 20 mL dung dịch X gồm NaOH 0,1M và Ba(OH)2 0,15M dùng để chuẩn độ 20 mL dung dịch HCl aM. Tính a |
|
|
3 |
Để chuẩn độ 40mL dung dịch NaOH aM cần dùng 10mL dung dịch X gồm HCl 0,2M và H2SO4 0,1M. Tính a |
|
|
4 |
Để chuẩn độ 25 mL dung dịch NaOH aM cần dùng 10 mL dung dịch X gồm HCl 0,2M và H2SO4 0,3M. Tính a |
|
|
5 |
Để chuẩn độ 10 mL dung dịch X gồm HCl 0,2M và H2SO4 aM cần dùng 20 mL dung dịch NaOH 0,5M. Tính a. |
|
Câu 3: Một mẫu dung dịch H2SO4 (gọi là mẫu X) được phân tích bằng cách thêm 10,0 mL dung dịch NaOH 0,5 M vào 20 mL dung dịch mẫu X rồi lắc đều. Sau khi phản ứng xảy ra, người ta thấy trong hỗn hợp dung dịch còn dư ion . Phần ion dư này cần 10 mL HCl 0,1M để trung hòa. Tính nồng độ mol/L của mẫu X.
Câu 4: a) Lan thực hiện phép chuẩn độ 10,00 mL dung dịch acid nồng độ 0,10 M bằng dung dịch NaOH cùng nồng độ 0,10 M, Lan rất ngạc nhiên khi thấy phải cần 20 mL dung dịch NaOH để đạt tới điểm tương đương. Em hãy giải thích thắc mắc cho Lan.
b) Trong một thí nghiệm khác, Lan thực hiện chuẩn độ 10,00 mL HCl 0,020M. Một lần nữa, Lan rất ngạc nhiên khi chỉ cần 5,00 mL một base mạnh cùng nồng độ 0,020 M để phản ứng hoàn toàn với 10,00 mL HCl đó. Em hãy giải thích cho Lan vì sao không cần một lượng tương đương là 10,00 mL base mà chỉ cần 5,00 mL?
Câu 5: a) 10 mL dung dịch sulfuric acid 5.10-3 M được cho vào một bình định mức dung tích 100 mL.
a1) Tính pH của dung dịch sulfuric acid (cho rằng H2SO4 là acid mạnh phân li trong nước hoàn toàn cả hai proton H+).
a2) Thêm nước vào đến vạch của bình định mức thu được 100 mL dung dịch. Xác định pH của dung dịch pha loãng.
b) Viết phương trình hóa học của phản ứng giữa sulfuric acid với dung dịch sodium hydroxide.
c) Dung dịch pha loãng ở phần a2 được dùng để chuẩn độ 25,0 mL dung dịch sodium hydroxide .
c1) Dự đoán hiện tượng quan sát được khi chuẩn độ đạt đến điểm tương đương nếu dùng phenolphthalein làm chất chỉ thị cho phép chuẩn độ trên.
c2) Xác định thể tích acid cần dùng khi phép chuẩn độ kết thúc.
Câu 6: Cho ba dung dịch có cùng nồng độ: hydrochloric acid (HCl), ethanoic acid (acetic acid, CH3COOH) và sodium hydroxide (NaOH). Khi chuẩn độ riêng một thể tích như nhau của dung dịch HCl và dung dịch CH3COOH bằng dung dịch NaOH, phát biểu nào sau đây đúng?
A. Trước khi chuẩn độ, pH của hai acid bằng nhau.
B. Tại các điểm tương đương, dung dịch của cả hai phép chuẩn độ đều có giá trị pH bằng 7.
C. Cần dùng một thể tích sodium hydroxide để đạt đến điểm tương đương.
D. Giá trị pH của hai acid tăng như nhau cho đến khi đạt điểm tương đương.
Câu 7: Chuẩn độ 20 mL dung dịch hỗn hợp HCl 0,1M + HNO3 a mol/L cần dùng hết 16,5 mL dung dịch hỗn hợp KOH 0,1M và Ba(OH)2 0,05M. Giá trị của a là
A. 0,07.
B. 0,08.
C. 0,065.
D. 0,068.
Câu 8: Chuẩn độ 20 mL dung dịch HCl chưa biết nồng độ đã dùng hết 17 mL dung dịch NaOH 0,12M. Xác định nồng độ mol của dung dịch HCl.
A. 0,102M.
B. 0,12M.
C. 0.08M.
D. 0,112M.
Câu 9: Cho 10 mL dung dịch X gồm hỗn hợp HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để chuẩn độ dung dịch X là
A. 10mL.
B. 15mL.
C. 20mL.
D. 25mL.
Câu 10: Thể tích dung dịch HCl 0,3M cần để chuẩn độ 10mL dung dịch hỗn hợp NaOH 0,1M và Ba(OH)2 0,1M là
A. 10mL.
B. 15mL.
C. 20mL.
D. 25mL.
Câu 11: Để chuẩn độ 20 mL dung dịch HCl 0,1M cần 10 mL dung dịch NaOH nồng độ x mol/L. Giá trị của x là
A. 0,1.
B. 0,3.
C. 0,2.
D. 0,4.
Câu 12: Để chuẩn độ 20 mL dung dịch H2SO4 0,25M cần 25 mL dung dịch NaOH nồng độ x mol/L. Giá trị của x là
A. 0,1.
B. 0,2.
C. 0,3.
D. 0,4.
Câu 13: Khi cho 10 mL dung dịch KOH 1M vào để chuẩn độ 10 mL dung dịch HCl thì phản ứng xảy ra vừa đủ. Nồng độ mol của HCl trong dung dịch đã dùng là
A. 1,0M.
B. 0,25M.
C. 0,5M.
D. 0,75M.
Câu 14: Để chuẩn độ dung dịch chứa 0,002 mol NaOH và 0,001 mol Ba(OH)2 thì cần bao nhiêu mL dung dịch chứa HCl 0,2M và H2SO4 0,1M?
A. 40.
B. 10.
C. 30.
D. 20.
Câu 15: Đổ 10 mL dung dịch KOH vào 15 mL dung dịch H2SO4 0,5M, dung dịch vẫn dư axit. Thêm 3 mL dung dịch NaOH 1M vào để chuẩn độ lượng acid dư. Nồng độ mol của dung dịch KOH là
A. 1,2M.
B. 0,6M.
C. 0,75M.
D. 0,9M.
Câu 16: Để chuẩn độ 20mL dung dịch hỗn hợp HCl 0,1M và H2SO4 0,3M cần bao nhiêu mL dung dịch hỗn hợp gồm NaOH 0,3M và Ba(OH)2 0,2M?
A. 10mL.
B. 20mL.
C. 5mL.
D. 15mL.
Câu 17: Để trung hòa hoàn toàn dung dịch chứa 0,001 mol NaOH và 0,0015 mol Ba(OH)2 thì cần bao nhiêu mL dung dịch chứa HCl 0,1M và H2SO4 0,05M?
A. 40.
B. 10.
C. 30.
D. 20.
Câu 18: Cốc A chứa 10 mL dung dịch KOH 0,10M được chuẩn độ với dung dịch HNO3 0,10M. Sau khi thêm 15 mL dung dịch HNO3 vào, pH của dung dịch trong cốc A là
A. 1,80.
B. 1,70.
C. 2,40.
D. 3,10.
Câu 19: Chuẩn độ 10,0 mL dung dịch NaOH 0,1M bằng dung dịch HCl 1,0 M. Thể tích dung dịch HCl cần thêm để dung dịch thu được có pH = 11 là
A. 8,91 mL.
B. 8,52 mL.
C. 9,01 mL.
D. 8,72 mL.
Câu 20: Để xác định nồng đội dung dịch NaOH người ta tiến hành như sau: cân 1,26 gam axit oxalic ngậm nước (H2C2O4.2H2O) hòa tan hoàn toàn vào nước, định mức thành 100 mL. Lấy 10 mL dung dịch này thêm vào đó vài giọt phenolphthalein, đem chuẩn độ bằng dung dịch NaOH đến xuất hiện màu hồng (ở pH = 9) thì hết 17,5 mL dung dịch NaOH. Nồng độ dung dịch NaOH đã dùng là
A. 0,114M.
B. 0,26M.
C. 0,124M.
D. 0,16M.
Phần II. Đáp án và hướng dẫn giải
Câu 1:
Câu 2:
|
STT |
Chuẩn độ dung dịch |
Tính nồng độ, thể tích dung dịch chuẩn độ |
|
1 |
Dùng 10mL dung dịch X gồm NaOH 0,1M và KOH 0,2M để chuẩn độ 20mL dung dịch HCl aM. Tính a |
|
|
2 |
Cho 20 mL dung dịch X gồm NaOH 0,1M và Ba(OH)2 0,15M dùng để chuẩn độ 20 mL dung dịch HCl aM. Tính a |
|
|
3 |
Để chuẩn độ 40mL dung dịch NaOH aM cần dùng 10mL dung dịch X gồm HCl 0,2M và H2SO4 0,1M. Tính a |
|
|
4 |
Để chuẩn độ 25 mL dung dịch NaOH aM cần dùng 10 mL dung dịch X gồm HCl 0,2M và H2SO4 0,3M. Tính a |
|
|
5 |
Để chuẩn độ 10 mL dung dịch X gồm HCl 0,2M và H2SO4 aM cần dùng 20 mL dung dịch NaOH 0,5M. Tính a. |
|
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức