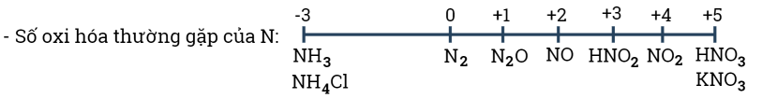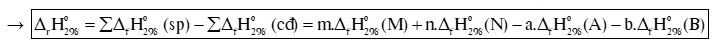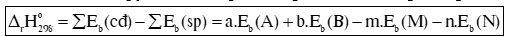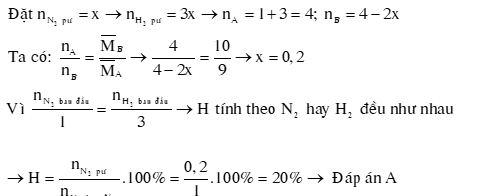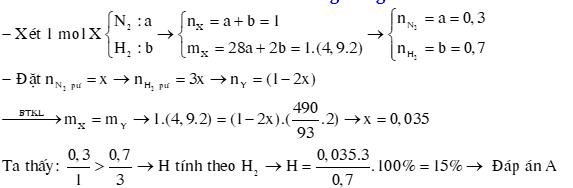Chủ đề 1: Nitrogen | Chuyên đề dạy thêm Hoá học 11
Tài liệu Chủ đề 1: Nitrogen gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
I. TRẠNG THÁI TỰ NHIÊN CỦA NITROGEN
- Dạng đơn chất: Nitrogen chiếm khoảng 78% thể tích không khí. Nitrogen trong tự nhiên có 2 đồng vị bền: .
- Dạng hợp chất: Có nhiều trong sodium nitrate (NaNO3), diêm tiêu natri. Trong cơ thể người và động vật, là thành phần cấu tạo nên nucleic acid, protein,…
II. CẤU TẠO NGUYÊN TỬ, PHÂN TỬ
1) Cấu tạo nguyên tử
- Nguyên tố N thuộc ô số 7, nhóm VA, chu kì 2 trong bảng tuần hoàn.
- Độ âm điện lớn (3,04); là phi kim điển hình.
- Nitrogen tạo ra nhiều hợp chất với các số oxi hóa khác nhau từ - 3 đến +5.
2) Cấu tạo phân tử
- Công thức cấu tạo:
- Phân tử nitrogen (N2) có năng lượng liên kết lớn (945 kJ/mol) và không có cực.
→ Liên kết ba trong phân tử N2 có năng lượng liên kết rất lớn (khó bị phá vỡ) nên ở nhiệt độ và áp suất thường, nitrogen rất khó tham gia phản ứng (tính trơ của đơn chất nitrogen).
III. TÍNH CHẤT VẬT LÍ
|
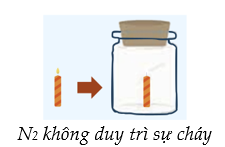
- Ở điều kiện thường, nitrogen (N2) là chất khí, không màu, không mùi, không vị - Khó hóa lỏng (hóa lỏng ở -196oC); hóa rắn -210oC. - Tan rất ít trong nước. - Không duy trì sự cháy và sự hô hấp. |
|
|
- Ở dạng đơn chất, tương tác van der Waals giữa các phân tử nitrogen rất yếu nên nhiệt độ sôi thấp. - Tương tác van der Waals giữa các phân tử nitrogen nước phân tử nước rất yếu nên nitrogen rất ít tan trong nước. |
|
IV. TÍNH CHẤT HÓA HỌC
- Nitrogen khá trơ ở nhiệt độ thường, ở nhiệt độ cao, nitrogen trở nên hoạt động hơn. Nitrogen thể hiện được cả tính oxi hóa và tính khử.
1) Tác dụng với hydrogen
Ở nhiệt độ cao (380oC – 450oC), áp suất cao khoảng 200 bar, xúc tác Fe.
2) Tác dụng với oxygen
- Ở nhiệt độ khoảng 3000oC hoặc có tia lửa điện, nitrogen tác dụng với oxygen tạo thành nitrogen monoxide
|
- Khi có sấm sét:
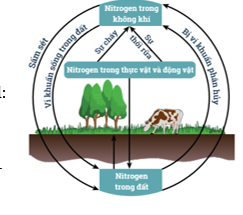
- Trong nước mưa, nitrogen dioxide (NO2) chuyển thành acid: → Quá trình tạo và cung cấp đạm nitrate cho đất từ nước mưa:
|
|
V. ỨNG DỤNG
- Nitrogen hóa lỏng ở nhiệt độ thấp (-196oC) nên ứng dụng làm lạnh nhanh.
- Trong lĩnh vực sinh học và y học, các mẫu sinh vật học (máu, mô, tế bào, bộ phận cơ thể,…) được bảo quản trong bình nitrogen lỏng.
- Tổng hợp ammonia (NH3), từ đó sản xuất phân đạm, nitric acid.
- Bảo quản thực phẩm.
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
Câu 1: Dựa vào tương tác van der Waals, hãy giải thích tại sao đơn chất N2 khó hóa lỏng và ít tan trong nước.
Câu 2: Trong phương trình hóa học của phản ứng tổng hợp ammonia, hãy xác định các nguyên tử có sự thay đổi số oxi hóa và vai trò của nitrogen.
Câu 3: Trong phương trình hóa học của phản ứng giữa nitrogen và oxygen:
a) Hãy các định các nguyên tử có sự thay đối số oxi hóa.
b) Tại sao thực tế không sử dụng phản ứng để tạo ra NO, một hợp chất trung gian quan trọng trong công nghiệp sản xuất nitric acid?
Câu 4: Viết các phương trình hóa học minh họa quá trình hình thành đạm nitrate trong tự nhiên xuất phát từ nitrogen.
Câu 5: Dựa vào giá trị năng lượng liên kết (Eb), hãy dự đoán ở điều kiện thường, chất nào (nitrogen, hydrogen, oxygen, chlorine) khó và dễ tham gia phản ứng hóa học nhất. Vì sao?
a) N2 (g) 2N (g) Eb = 945 kJ/mol; b) H2 (g) 2H (g) Eb = 432 kJ/mol
c) O2 (g) 2O (g) Eb = 498 kJ/mol; d) Cl2 (g) 2Cl (g) Eb = 243 kJ/mol.
Câu 6: a) Tại sao nitrogen lỏng được dùng để bảo quản mẫu vật phẩm trong y học?
b) Tại sao dùng khí nitrogen để làm căng vỏ bao bì thực phẩm mà không dùng không khí?
Câu 7: Dựa vào các giá trị năng lượng liên kết, hãy dự đoán ở nhiệt độ thường thì đơn chất nitrogen hay chlorine dễ phản ứng với hydrogen hơn. Cho biết năng lượng liên kết Cl−Cl trong phân tử chlorine là 243 kJ/mol; năng lượng liên kết N ≡ N trong phân tử nitrogen là 946 kJ/mol.
Câu 8: Viết phương trình hoá học của phản ứng giữa nitrogen với hydrogen và với oxygen. Nêu ứng dụng của mỗi phản ứng này trong thực tế.
Câu 9: Trong công nghiệp, ammonia được sản xuất dựa vào phản ứng thuận nghịch giữa nitrogen và hydrogen trong thiết bị kín.
a) Khi phản ứng đạt trạng thái cân bằng thì trong thiết bị sẽ có các khí nào?
b) Hãy tìm hiểu về nhiệt độ hoá lỏng của mỗi khí có trong thiết bị. Từ đó cho biết, nếu giữ nguyên áp suất và làm lạnh thiết bị thì khí nào sẽ hoá lỏng đầu tiên.
Câu 10: Tính phân tử khối trung bình của không khí, giả thiết thành phần không khí: 78% nitrogen, 21% oxygen và 1% argon.
Câu 11: Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định. Ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng KC của phản ứng xảy ra trong bình.
DẠNG 1: BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG
Cho phản ứng: aA + bB mM + nN
Biến thiên enthalpy chuẩn của phản ứng, tính theo nhiệt tạo thành :
Biến thiên enthalpy chuẩn của phản ứng, tính theo năng lượng liên kết:
Trong đó: Eb (A), Eb (B), Eb (M), Eb (N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong phân tử A, B, M, N.
Câu 12: Cho phản ứng: 3H2 (g) + N2 (g)⇌ 2NH3. Tính biến thiên enthalpy của phản ứng tạo thành ammonia (NH3), biết năng lượng liên kết Eb (H – H) = 432 kJ/mol; Eb (N≡N) = 945 kJ/mol; Eb (N – H) = 391 kJ/mol. Cho biết phản ứng thu nhiệt hay tỏa nhiệt.
Câu 13: Tính biến thiên enthapy theo các phương trình phản ứng sau, biết nhiệt sinh của NH3 bằng -46 kJ/mol.
N2(g) + 3H2(g) 2NH3(g) (1)
(2)
So sánh (1) và (2). Khi tổng hợp được 1 tấn NH3 thì nhiệt lượng toả ra hay thu vào là bao nhiêu? Tính theo hai phương trình phản ứng trên thì kết quả thu được giống nhau hay khác nhau.
Câu 14: Dựa vào năng lượng liên kết ở bảng:
|
Liên kết |
N≡N |
O = O |
N = O |
|
Eb (kJ/mol) |
945 |
498 |
607 |
Tính biến thiên enthalpy của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide (N=O).
N2(g) + O2(g) 2NO(g)
Câu 15: Cho hai phương trình hoá học sau:
N2(g) + O2(g) 2NO(g) (1)
2NO(g) + O2(g) 2NO2(g) (2)
Những phát biểu nào sau đây về hai phương trình hoá học trên là đúng?
a) Xác định phản ứng nào là phản ứng tỏa nhiệt, phản ứng thu nhiệt?
b) Trong 2 phản ứng trên, phản ứng nào thuận lợi về mặt năng lượng, phản ứng nào không thuận lợi về mặt năng lượng?
c) Xác định enthalpy tạo thành chuẩn của NO2.
d) Từ giá trị biến thiên enthalpy chuẩn của phản ứng (1) và năng lượng liên kết trong phân tử O2, N2 lần lượt là 498 kJ/mol và 946 kJ/mol, tính được năng lượng liên kết trong phân tử NO ở cùng điều kiện.
Câu 16: Cho bảng giá trị năng lượng của một số liên kết ở điều kiện chuẩn sau:
|
Liên kết |
H – H |
N – H |
N ≡ N |
|
Năng lượng liên kết (kJ/mol) |
436 |
389 |
946 |
a) Tính giá trị biến thiên enthalpy chuẩn của phản ứng sau theo năng lượng liên kết: N2(g) + 3H2(g) 2NH3(g)
b) Từ kết quả tính ở a) thì có thể suy ra giá trị enthalpy tạo thành chuẩn của khí ammonia là bao nhiêu kJ/mol?
c) Kết quả thực nghiệm xác nhận giá trị enthalpy tạo thành chuẩn của khí ammonia là -45,9 kJ/mol. Hãy cho biết vì sao có sự khác biệt về giá trị enthalpy tạo thành chuẩn của khí ammonia theo kết quả tính ở b) và kết quả thực nghiệm.
Câu 17: * Tại sao ở điều kiện thường (25°C, 1 bar), nitrogen tồn tại ở dạng phân tử N2, trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
– Năng lượng liên kết ba N≡N là 941 kJ/mol.
– Năng lượng liên kết ba P≡P là 490 kJ/mol.
– Năng lượng liên kết đơn N- N là 160 kJ/mol.
– Năng lượng liên kết đơn P-P là 209 kJ/mol.
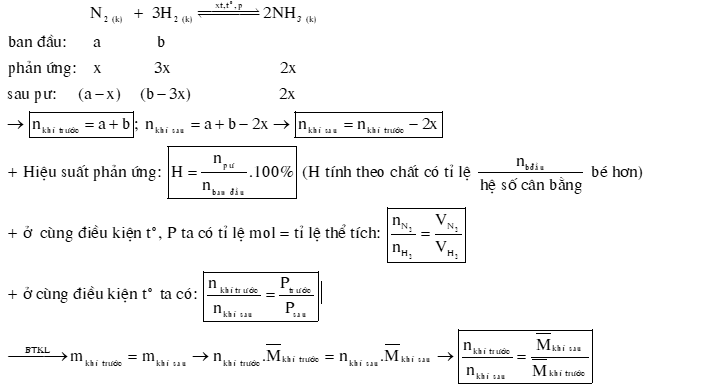
DẠNG 2: BÀI TẬP HIỆU SUẤT PHẢN ỨNG TỔNG HỢP NH3
Ví dụ 1: Hỗn hợp A gồm N2 và H2 theo tỉ lệ thể tích 1:3, phản ứng giữa N2 và H2 sinh ra NH3. Sau phản ứng được hỗn hợp khí B có tỉ khối so với khí A là 10/9. Hiệu suất phản ứng là
A. 20%.
B. 25%.
C. 30%.
D. 15%
Hướng dẫn giải:
Ví dụ 2: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với hydrogen bằng 4,9. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác),thu được hỗn hợp khí Y có tỉ khối so với hydrogen bằng . Hiệu suất của phản ứng tổng hợp NH3 là
A. 15%.
B. 12,5%.
C. 10%.
D. 20%.
Hướng dẫn giải:
Câu 18: Hỗn hợp X gồm và có tỉ lệ mol tương ứng là 1:3. Nung nóng X trong bình kín (450oC, xúc tác Fe) một thời gian, thu được hỗn hợp khí có số mol giảm 5 % so với ban đầu. Tính hiệu suất của phản ứng tổng hợp .
Câu 19: Cho cân bằng ở . Thực hiện phản ứng trên với một hỗn hợp nitrogen và oxygen có tỉ lệ mol tương ứng là 4:1. Tính hiệu suất của phản ứng khi hệ cân bằng ở .
PHẦN B. CÁC DẠNG BÀI TẬP TRẮC NGHIỆM
Câu 20: Nguyên tố hóa học nào sau đây thuộc nhóm VA?
A. Nitrogen.
B. Chlorine.
C. carbon.
D. Oxygen.
Câu 21: Cấu hình electron nguyên tử của nitrogen là
A. 1s22s22p1.
B. 1s22s22p5.
C. 1s22s22p1.
D. 1s22s22p3.
Câu 22: Khí nào phổ biến nhất trong khí quyển Trái Đất?
A. Oxygen.
B. Nitrogen.
C. Ozone.
D. Argon.
Câu 23: Công thức hoá học của diêm tiêu Chile là
A. Ca(NO3)2.
B. .
C. .
D. .
Câu 24: Tính chất nào sau đây của nitrogen không đúng?
A. Ở điều kiện thường, nitrogen là chất khí.
B. Nitrogen tan rất ít trong nước.
C. Nitrogen không duy trì sự cháy và sự hô hấp.
D. Nitrogen nặng hơn không khí.
Câu 25: Vị trí của nitrogen (N) trong bảng hệ thống tuần hoàn là
A. ô 14, chu kì 2,nhóm VA.
B. ô 14, chu kì 3,nhóm IIIA.
C. ô 7, chu kì 2, nhóm VA.
D. ô 7, chu kì 3,nhóm IIIA.
Câu 26: Trong các phản ứng sau, phản ứng nào nitrogen đóng vai trò chất khử?
Câu 27: Số oxi hoá thấp nhất và cao nhất của nguyên tử nitrogen lần lượt là
A. 0 và +5.
B. -3 và 0.
C. -3 và +5.
D. -2 và +4.
Câu 28: Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị nào sau đây?
A. .
B. .
C. .
D. .
Câu 29: Trong phản ứng tổng hợp ammonia từ nitrogen và hydrogen, nitrogen đóng vai trò là
A. chất khử.
B. chất oxi hoá.
C. acid.
D. base.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Chủ đề 2: Ammonia muối ammonium
Chủ đề 3: Một số hợp chất của nitrogen với oxygen
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức