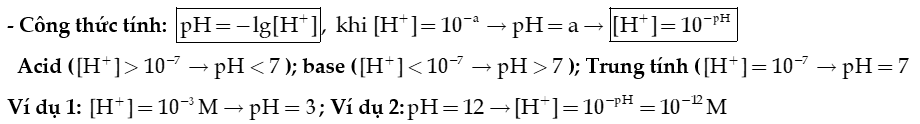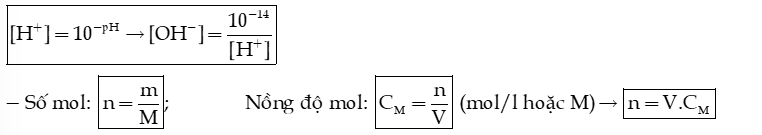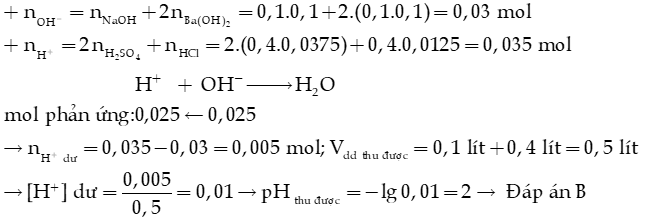Chủ đề 4: pH của dung dịch. Chất chỉ thị acid- base | Chuyên đề dạy thêm Hoá học 11
Tài liệu Chủ đề 4: pH của dung dịch. Chất chỉ thị acid- base gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
1) Tích số ion của nước
- Nước là chất điện li rất yếu: .
Ở 25oC, nồng độ H+ và OH- trong nước là vô cùng nhỏ: [] = []= M .
→ Tích số ion của nước: .
2) pH của dung dịch
- Khái niệm:
pH là đại lượng đặc trưng cho mức độ acid, base của một dung dịch.
+ pH càng nhỏ hơn 7, dung dịch có tính acid càng mạnh.
+ pH càng lớn hơn 7, dung dịch có tính base (tính kiềm) càng mạnh.
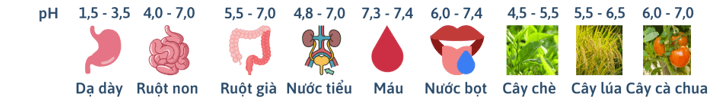
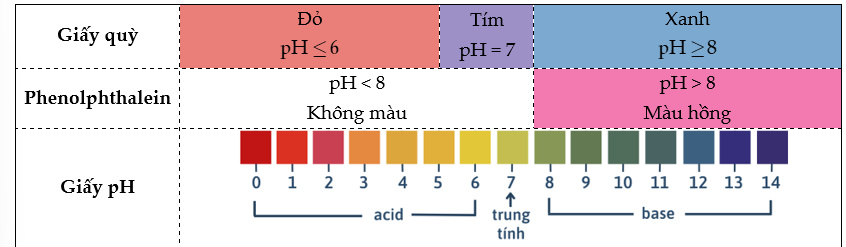
- Thang pH:
- Ý nghĩa của pH trong thực tiễn:
- Xác định pH bằng chất chỉ thị:
Một số chất như: quỳ tím, phenolphthalein, methyl da cam,… có màu sắc khác nhau trong môi trường acid và môi trường base. Những chất như vậy được gọi là chất chỉ thị acid – base.
Phần I. Đề bài
DẠNG 1. TÍNH pH CỦA MỘT DUNG DỊCH
1) Tính pH của một dung dịch
- Với một dung dịch chứa các axit ta có:
- Với một dung dịch chứa một hay nhiều bazơ ta có:
2) Biết pH, tính nồng độ mol của ion
- Khi pH < 7 → dung dịch có môi trường acid, ta cần tính nồng độ ion
- Khi pH > 7 → dung dịch có môi trường base ta cần tính nồng độ ion
- Khi trộn 2 dung dịch với nhau ta tính mol ion; tính thể tích dung dịch; Tính nồng độ ion theo thể tích thu được; Sau đó tính pH.
Ví dụ 1: Dung dịch H2SO4 nồng độ 0,05M có pH là bao nhiêu?
Hướng dẫn giải:
Ta có:
Ví dụ 2: Dung dịch X gồm NaOH 0,004M và Ba(OH)2 0,003M. Tính pH của dung dịch X.
Hướng dẫn giải:
Ví dụ 3: Trộn 100 mL dung dịch HCl 0,1M với 100 mL dung dịch H2SO4 0,005M thu được dung dịch X.
Tính pH của dung dịch X.
Hướng dẫn giải:
Câu 1: (KNTT – SGK) Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo được giá trị pH là 4,52.
a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp giảm độ chua, tăng độ pH của đất.
Câu 2: (CD - SGK) Bình thường, chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm. Sỏi thận là khối chất khoáng nhỏ có thể tích tụ trong thận, gây đau khi ngăn cản dòng nước tiểu từ thận xuống niệu quản. Một trong các dấu hiệu của bệnh sỏi thận là nước tiểu bị dư acid hoặc dư kiềm. Đề xuất cách làm đơn giản để có thể tiên lượng (dự đoán có tính khoa học) bệnh sỏi thận.
Câu 3: (CTST-SGK) Một dung dịch có Tính pH và xác định môi trường của dung dịch này.
Câu 4: Hoàn thành bảng sau:
|
STT |
Dung dịch X |
Nồng độ ion H+ |
pH |
|
1 |
HCl 0,01M |
|
|
|
2 |
H2SO4 0,0005M |
|
|
|
3 |
Dung dịch X gồm HCl 0,005M và H2SO4 0,0025M |
|
|
|
4 |
Dung dịch X gồm HNO3 0,04M và HCl 0,06M |
|
|
|
5 |
Dung dịch X gồm H2SO4 0,02M và HCl 0,06M |
|
|
|
6 |
NaOH 0,001M |
|
|
|
7 |
Ba(OH)2 0,005M |
|
|
|
8 |
Dung dịch X gồm KOH 0,005M và Ba(OH)2 0,0025M |
|
|
|
9 |
Dung dịch X gồm NaOH 0,04M và KOH 0,06M |
|
|
|
10 |
Dung dịch X gồm Ba(OH)2 0,02M và NaOH 0,06M |
|
|
Câu 5: Dung dịch H2SO4 0,005 M có pH là
A. 3.
B. 2.
C. 5.
D. 4.
Câu 6: Dung dịch KOH 0,001M có pH là
A. 3.
B. 11.
C. 2.
D. 12.
Câu 7: Hòa tan 0,04gam NaOH vào nước để được 1lit dung dịch. pH của dung dịch bazơ này là
A. 4.
B. 3.
C. 11.
D. 12.
Câu 8: Hoà tan 4,9 g H2SO4 vào nước để được 10 lít dung dịchA . Dung dịch A có pH là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 9: pH của dung dịch A chứa là
A. 3,3.
B. 10,7.
C. 3,0.
D. 11,0.
Câu 10: pH của dung dịch HCl 2.10-4M và H2SO4 4.10-4M là
A. 3.
B. 4.
C. 3,7.
D. 3,1.
Câu 11: Hòa tan 4,9 gam H2SO4 vào nước để được 1 lit dung dịch. pH của dung dịch axit này là
A. 4.
B. 1.
C. 3.
D. 2.
Câu 12: pH dung dịch X gồm HCl 0,01M và H2SO4 0,02M là
A. 4,3.
B. 1,3.
C. 2,3.
D. 3,3.
Câu 13: pH của dung dịch KOH 0,06M và NaOH 0,04M là
A. 1.
B. 2.
C. 13.
D. 12,8.
Câu 14: pH của dung dịch KOH 0,004M và Ba(OH)2 0,003M là
A. 12.
B. 2.
C. 13.
D. 11,6.
Câu 15: Nồng độ mol/L của dung dịch H2SO4 có pH = 2 là
A. 0,010 M.
B. 0,020 M.
C. 0,005 M.
D. 0,002 M.
Câu 16: Nồng độ mol/L của dung dịch Ba(OH)2 có pH = 12 là
A. 0,005 M.
B. 0,010 M.
C. 0,050 M.
D. 0,100 M.
Câu 17: Trộn 200 mL dung dịch H2SO4 0,05 M với 300 mL dung dịch HCl 0,1 M thu được dung dịch Y. pH của dung dịch Y là
A. 1.
B. 4.
C. 3.
D. 1,2
Dạng 2: Tính pH khi trộn dung dịch acid với dung dịch base
1) Tính pH của dung dịch thu được
Ví dụ: Trộn 100 mL dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 mL dung dịch (gồm H2SO4 0,0375M và HCl 0,0125M), thu được dung dịch X. Giá trị pH của dung dịch X là
A. 7. B. 2. C. 1. D. 6.
Hướng dẫn giải:
Câu 18: (CTST-SGK) Tính pH của dung dịch thu được sau khi trộn 40 mL dung dịch HCl 0,5M với 60 mL dung dịch NaOH 0,5M.
Câu 19: Tính pH của dung dịch thu được:
|
STT |
Trộn 2 dung dịch |
Tính pH của dung dịch thu được |
|
1 |
Trộn 100 mL dung dịch X gồm NaOH 0,2M và KOH 0,4M với 100 mL dung dịch H2SO4 0,2M thu được dung dịch Z. |
|
|
2 |
Trộn 100 mL dung dịch NaOH 0,2M với 300 mL dung dịch HCl 0,2M thu được dung dịch X |
|
|
3 |
Trộn 100 mL dung dịch NaOH 0,1M với 100 mL dung dịch X gồm HCl 0,1M và H2SO4 0,1M thu được dung dịch X |
|
|
4 |
Trộn 300 mL dung dịch HCl 0,01M với 100 mL dung dịch X gồm NaOH 0,02M và Ba(OH)2 0,007M |
|
|
5 |
Trộn 200 mL dung dịch X gồm HCl 0,15M và H2SO4 0,1M với 300 mL dung dịch Y gồm NaOH 0,2M và KOH 0,15M |
|
Câu 20: Trộn 100mL dung dịch H2SO4 0,1M với 150 mL dung dịch NaOH 0,2M. Dung dịch tạo thành có pH là
A. 13,6.
B. 12,6.
C. 13.
D. 1,3.
Câu 21: Cho 100,0 mL dung dịch H2SO4 0,05M vào 100,0 mL dung dịch NaOH 0,12M thu được dung dịch X. pH của dung dịch X là
A. 7,0.
B. 2,0.
C. 13,0.
D. 12,0.
Câu 22: Cho 40mL dung dịch HCl 0,85M vào 160mL dung dịch gồm Ba(OH)2 0,08M; KOH 0,04M. pH của dung dịch thu được bằng
A. 2.
B. 3.
C. 12.
D. 10.
Câu 23: Trộn 200 mL dung dịch H2SO4 0,05M với 300 mL dung dịch NaOH 0,06M. pH của dung dịch tạo thành là
A. 2,7.
B. 1,6.
C. 1,9.
D. 2,4.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Chủ đề 1: Khái niệm về cân bằng hóa học
Chủ đề 2: Cân bằng trong dung dịch nước
Chủ đề 3: Thuyết BRONSTED – LOWRY về acid- base
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức