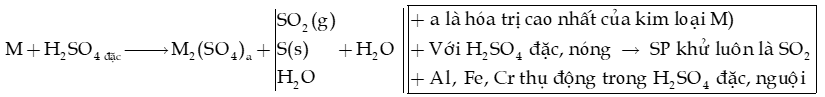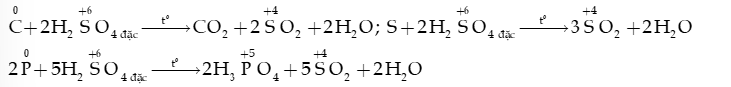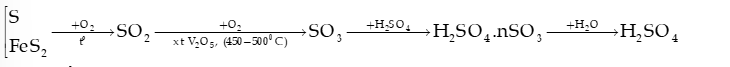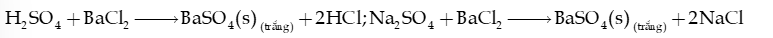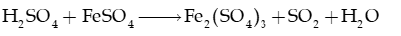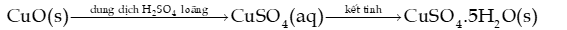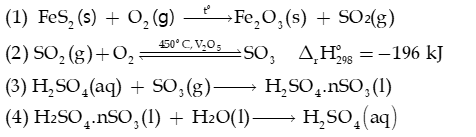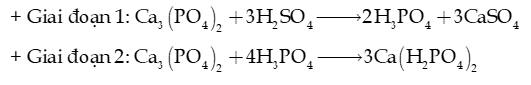Chủ đề 6: Sulfuric acid và muối Sulfate | Chuyên đề dạy thêm Hoá học 11
Tài liệu Chủ đề 6: Sulfuric acid và muối Sulfate gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
I. SULFURIC ACID
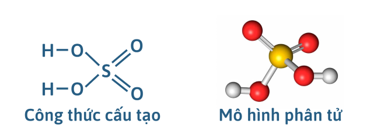
1) Cấu tạo phân tử
2) Tính chất vật lí
- Ở điều kiện thường, sulfuric acid là chất lỏng sánh như dầu, không màu, không bay hơi.
- Dung dịch H2SO4 98% có khối lượng riêng là 1,84g/cm3, nặng gần gấp hai lần nước.
- Tan vô hạn trong nước và tỏa rất nhiều nhiệt.
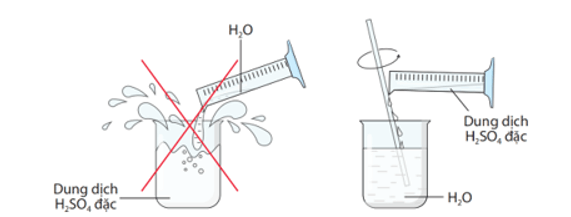
- Khi pha loãng sulfuric acid đặc, ta cho từ từ acid vào nước, vừa rót vừa khuấy đều (không làm ngược lại).
3) TÍNH CHẤT HÓA HỌC
a) Dung dịch sulfuric acid loãng
- Dung dịch H2SO4 loãng có tính acid mạnh.
+ Làm quỳ tím chuyển sang màu đỏ
+ Tác dụng với base, basic oxide tạo muối sulfate và nước
VD: 2NaOH + H2SO4 Na2SO4 + H2O; CuO + H2SO4 CuSO4 + H2O
+ Tác dụng với muối
Điều kiện: Muối sunfat kết tủa hoặc axit mới dễ bay hơi)
Ví dụ: BaCl2 + H2SO4 (loãng) BaSO4 (s) + 2HCl
Na2CO3 + H2SO4 Na2SO4 + CO2 (g) + H2O
+ Tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học Muối sulfate + H2 (g)
VD: Fe + H2SO4 FeSO4 + H2 (g)
b) Tính oxi hóa mạnh của H2SO4 đặc
- Kim loại (K đến Ag) + H2SO4 đặc Muối sulfate + sản phẩm khử + H2O
Ví dụ:
- Phi kim (C, S, P,…) + H2SO4 đặc SO2
- Hợp chất + H2SO4 đặc: Ví dụ: 2KBr +
c) Tính háo nước của H2SO4 đặc
- Sulfuric acid đặc hấp thụ mạnh nước, nó cũng hấp thụ mạnh các hợp chất carbohydrate Cn(H2O)m, như đường saccharose, glucose và tinh bột…
+ H2SO4 đặc hấp thụ nước của đường saccharose: .
+ Một phần C bị H2SO4 đặc oxi hóa thành CO2:
- Acid H2SO4 đặc có thể dùng làm khô các chất khi không xảy ra phản ứng.
- Khi bị dính dung dịch sulfuric acid đặc, cơ thể người sẽ bị tổn thương nặng do tế bào bị mất nước, bị đốt nóng từ lượng nhiệt phát ra và bị oxi hóa mạnh. Cần thận trọng khi sử dụng dung dịch H2SO4 đặc.
4) Ứng dụng
- Sản xuất phân bón, thuốc nhuộm, giấy, chất dẻo, tơ sợi, chất tẩy rửa, thuốc nổ, chế biến dầu mỏ,.…
5) Cách bảo quản, sử dụng và nguyên tắc xử lí sơ bộ khi bỏng acid.
- Cách bảo quản: đựng trong bình kín, đặt nơi khô ráo, thoáng mát, không đặt gần chất khử, kim loại nhẹ.
- Sử dụng đồ bảo hộ như: áo bảo hộ, găng tay bảo hộ, kính chống thấm,…
- Nguyên tắc xử lí sơ bộ khi bỏng acid: Nhanh chóng bỏ quần áo bị dính acid, sau đó rửa ngay nước sạch khoảng 20 phút. Sau đó nhanh chóng chuyển người bị bỏng đến cơ sở ý tế gần nhất để theo dõi và điều trị.
6) Quy trình sản xuất sulfuric acid trong công nghiệp theo phương pháp tiếp xúc
II. MUỐI SULFATE
1) Ứng dụng của một số muối sulfate
- Calcium sulfate (CaSO4) dùng trong vật liệu xây dưng, chất phụ gia,…
- Barium sulfate (BaSO4) dùng làm phụ gia pha màu cho công nghiệp sơn, thủy tinh, gốm sứ,…
- Magnesium sulfate (MgSO4) sản xuất muối tắm, bổ sung magnesium cho tôm, cá, động vật thủy sinh,…
- Ammonium sulfate (NH4)2SO4 là thành phần của thuốc trừ sâu hòa tan, thuốc diệt nấm, phân bón,…
2) Nhận biết sulfate ion
Thuốc thử là ion Ba2+ (trong dung dịch muối barium hoặc dung dịch Ba(OH)2).
Hiện tượng: xuất hiện kết tủa trắng barium sulfate (BaSO4), không tan trong các dung dịch acid và các dung dịch base.
Phần A. BÀI TẬP TỰ LUẬN
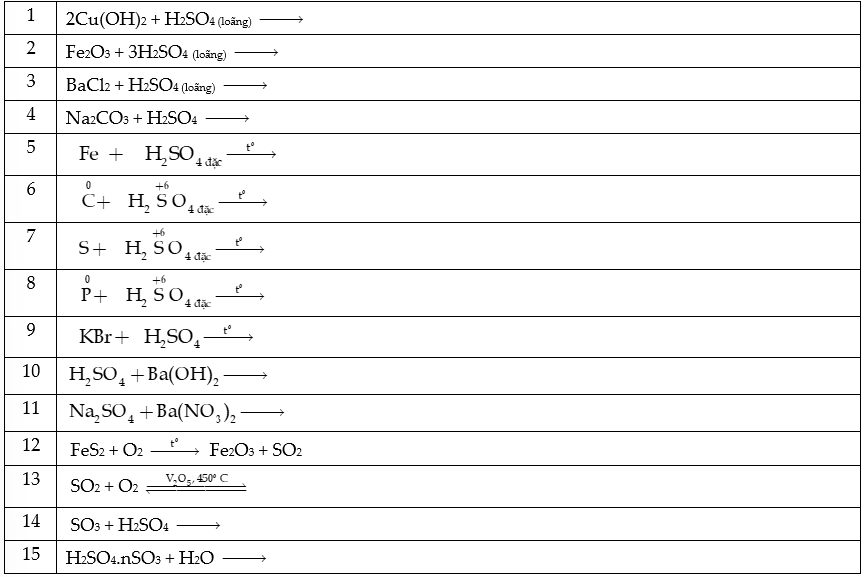
Câu 1: Hoàn thành các PTHH sau:
Câu 2: Dung dịch sulfuric acid đặc được dùng làm khô khí ẩm nào trong số các khí sau: CO, H2, CO2, SO2, O2 và NH3? Giải thích?
Câu 3: Trong công nghiệp, copper(II) sulfate được sản xuất bằng cách ngâm đồng phế liệu trong sulfuric acid loãng và sục không khí: (1)
a) Lập phương trình hoá học của phản ứng (1).
b) Tại sao thực tế không sản xuất từ đồng phế liệu theo sơ đồ phản ứng:
Câu 4: Trình bày phương pháp hóa học để phân biệt các cặp dung dịch sau:
a) và NaCl
b) loãng và HCl
Câu 5: Cho các dung dịch không màu của mỗi chất sau: K2CO3, Na2SO4, Ba(NO3)2. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hóa học. Viết các phương trình hóa học xảy ra.
Câu 6: Cho các dung dịch không màu của mỗi chất sau đây chứa trong các lọ mất nhãn riêng biệt: Na2CO3, MgSO4, KNO3, NaOH, HCl. Hãy trình bày cách phân biệt các dung dịch đã cho bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng xảy ra.
Câu 7: Hãy mô tả hiện tượng xảy ra và hoàn thành phương trình hóa học của phản ứng xảy ra khi sulfuric acid loãng:
a) Tiếp xúc với lá kim loại hoạt động bị phủ bởi lớp oxide kim loại (chẳng hạn lá kẽm (zinc) bị phủ bởi lớp zinc oxide).
b) Tiếp xúc với mẩu đá vôi hay mẩu phấn viết bảng.
c) Tiếp xúc với bột baking soda (sodium hydrogencarbonate).
d) Được cho vào nước vôi trong, Ca(OH)2.
Câu 8: Dưới đây là một số phản ứng minh họa tính oxi hóa của sulfuric acid và sulfur dioxide. Đa số các phản ứng này có ứng dụng trong phòng thí nghiệm. Hãy cân bằng phương trình hóa học các phản ứng bằng phương pháp thăng bằng electron.
a) Sulfuric acid đặc phản ứng với carbon trong than:
b) Sulfur dioxide làm mất màu dung dịch bromine (Br2):
c) Sulfur dioxide làm mất màu dung dịch thuốc tím:
d) Sulfuric acid đặc oxi hóa hợp chất Fe(II) thành hợp chất Fe(III):
e) Phản ứng dùng để xác định nồng độ hợp chất Fe(II) bằng thuốc tím trong môi trường acid:
Câu 9: Trong công nghiệp, chất rắn copper(II) sulfate pentahydrate ( ) có thể được sản xuất từ copper(II) oxide theo hai giai đoạn của quá trình:
a) Từ 1 tấn nguyên liệu chứa 96% copper(II) oxide theo khối lượng (còn lại là tạp chất trơ) sẽ thu được bao nhiêu kilôgam copper(II) sulfate pentahydrate rắn? Cho hiệu suất của quá trình là 85%.
b) Một ao nuôi thuỷ sản có diện tích bề mặt nước là 2 000 m2, độ sâu trung bình của nước trong ao là 0,7m đang có hiện tượng phú dưỡng. Để xử lí tảo xanh có trong ao, người dân cho copper(II) sulfate pentahydrate vào ao trong 3 ngày, mỗi ngày một lần, mỗi lần là 0,25 g cho 1 m3 nước trong ao. Hãy cho biết tổng khối lượng (kg) copper(II) sulfate pentahydrate người dân cần sử dụng.
c) Có thể pha chế dung dịch copper(II) sulfate dùng để diệt một số loại vi sinh vật. Tính số mg copper(II) sulfate pentahydrate cần dùng để pha chế thành 1 L dung dịch copper(II) sulfate .
Câu 10: Sulfuric acid là một trong những hoá chất quan trọng nhất được sử dụng trong công nghiệp; được sản xuất hàng trăm triệu tấn mỗi năm, chiếm nhiều nhất trong ngành công nghiệp hoá chất. Phương pháp sản xuất sulfuric acid phổ biến nhất là phương pháp tiếp xúc, theo đó acid có thể được điều chế qua các giai đoạn sau:
a) Cân bằng phương trình hoá học của các phản ứng trên.
b) Theo nguyên lí chuyển dịch cân bằng, phản ứng (2) nên được thực hiện ở nhiệt độ cao hay thấp? Trong thực tế, phản ứng trên được thực hiện ở nhiệt độ khá cao (450°C), hãy giải thích điều này.
d) Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ mỗi 10,0 mL dung dịch acid này bằng dung dịch NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Hãy xác định công thức của oleum trên.
Câu 11: Sulfur dioxide là một trong các tác nhân gây mưa acid, phát thải chủ yếu từ các quá trình đốt cháy nhiên liệu như than đá, xăng, dầu,.
Một nhà máy nhiệt điện than sử dụng hết 6000 tấn than đá/ngày, có thành phần chứa 0,8% lưu huỳnh về khối lượng để làm nhiên liệu.
a) Tính thể tích khí (đkc) tối đa do nhà máy tạo ra trong một ngày.
b) Giả thiết có 1% lượng khí tạo ra khuếch tán vào khí quyển rồi bị chuyển hoá thành sulfuric acid trong nước mưa theo sơ đồ:
Tính thể tích nước mưa bị nhiễm acid, giả thiết nồng độ sulfuric acid trong nước mưa là .
Câu 12: Trong sản xuất phân bón, surpephosphate kép chứa thành phần dinh dưỡng là , được sản xuất từ quặng phosphorite theo hai giai đoạn sau:
Để sản xuất được 1 tấn với hiệu suất của giai đoạn 1 là 80%, giai đoạn 2 là 70% thì cần bao nhiêu tấn dung dịch ?
PHẦN B. BÀI TẬP TRẮC NGHIỆM
Câu 13: Tính chất nào sau đây không phải tính chất của dung dịch sulfuric acid đặc?
A. Tính háo nước.
B. Tính oxi hóa.
C. Tính acid.
D. Tính khử.
Câu 14: Dung dịch acid nào sau đây có khả năng gây bỏng nếu rơi vào da?
Câu 15: Chất nào sau đây không bay hơi ở điều kiện thường do có nhiệt độ sôi rất cao ?
Câu 16: Quá trình pha loãng dung dịch đầm đặc của acid nào sau đây toả rất nhiều nhiệt nên không được tự ý pha loãng?
Câu 17: Ở thể lỏng, chất nào sau đây có dạng sánh như dầu do tồn tại liên kết hydrogen rất mạnh giữa các phân tử?
Câu 18: Để nhận biết anion có trong dung dịch K2CO3, không thể dùng thuốc thử nào sau đây?
A. Ba(OH)2.
B. BaCl2.
C. Ba(NO3)2.
D. MgCl2.
Câu 19: Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
A. Al.
C. Na.
B. Zn.
D. Cu.
Câu 20: Dãy kim loại nào trong các dãy sau đây gồm các kim loại không tác dụng với dung dịch H2SO4 đặc, nguội?
A. Al, Fe, Au, Pt.
B. Zn, Pt, Au, Mg.
C. Al, Fe, Zn, Mg.
D. AI, Fe, Au, Mg.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Chủ đề 5: Sulfur và Sulfur dioxide
Chủ đề 7: Một số dạng bài tập về Sulfuric acid loãng
Chủ đề 8: Một số dạng bài tập về Sulfuric acid đặc
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức