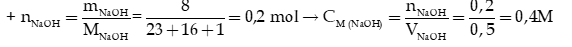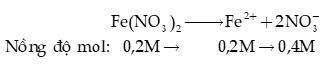Chủ đề 2: Cân bằng trong dung dịch nước | Chuyên đề dạy thêm Hoá học 11
Tài liệu Chủ đề 2: Cân bằng trong dung dịch nước gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
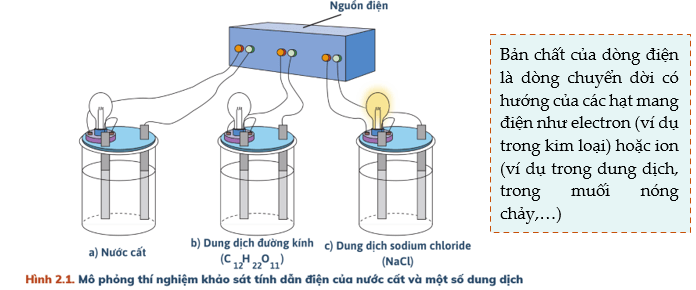
Ta thấy: Cốc đựng nước cất và dung dịch đường kính bóng đèn không sáng → Nước cất, dung dịch đường kính không dẫn điện.
Cốc đựng dung dịch NaCl bóng đèn sáng → Dung dịch NaCl dẫn điện.
|
- Sự điện li là quá trình phân li các chất trong nước tạo thành ion. - Chất điện li là chất khi tan trong nước phân li ra các ion. - Chất không điện li là chất khi tan trong nước không phân li thành các ion - Chất điện li gồm: acid, base, muối. |
1) Chất điện li mạnh
- Là chất khi tan trong nước, các phân tử chất hòa tan đều phân li ra ion
- Gồm: acid mạnh, base mạnh và hầu hết các muối
+ Acid mạnh: HCl, HBr, HI, H2SO4, HNO3, HClO4,…
+ Base mạnh: LiOH, NaOH, KOH, Ca(OH)2,…
+ Hầu hết các muối, trừ HgCl2,.
- Phương trình điện li của chất điện li mạnh, biểu diễn mũi tên 1 chiều “→ ”
Ví dụ: NaCl → Na+ + Cl – ; HCl → H+ + Cl –;NaOH → Na+ + OH –
2) Chất điện li yếu
- Là chất khi tan trong nước chỉ một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch.
- Gồm: Acid yếu (CH3COOH, HClO, HF, H2CO3, H2SO3,.), base yếu (Mg(OH)2, Fe(OH)2, Cu(OH)2, NH3,.), muối HgCl2,.
- Quá trình phân li của chất điện li yếu là một phản ứng thuận nghịch, biểu diễn “⇌ ”
Ví dụ: CH3COOH ⇌ CH3COO – + H+; NH3 + H2O ⇌ NH4+ + OH –
Phần I. Đề bài
PHẦN A. CÁC DẠNG BÀI TẬP TỰ LUẬN
DẠNG 1: CHẤT ĐIỆN LI, PHƯƠNG TRÌNH ĐIỆN LI
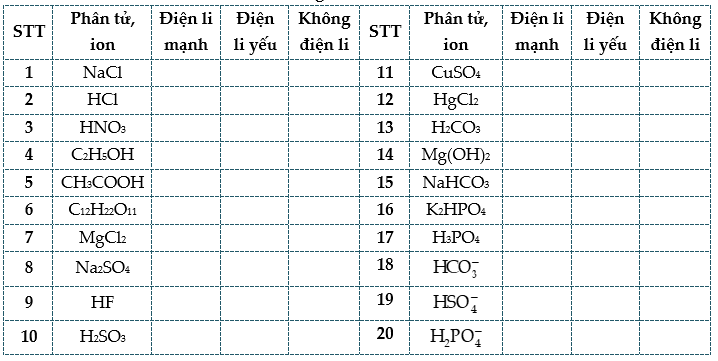
Câu 1: Điền dấu “v” để hoàn thành bảng sau:
Câu 2: Viết các phương trình điện li (nếu có):
|
STT |
Chất |
Phương trình điện li |
|
1 |
HNO3 |
|
|
2 |
HCl |
|
|
3 |
H2SO4 |
|
|
4 |
HClO4 |
|
|
5 |
CH3COOH |
|
|
6 |
H2S |
|
|
7 |
H2CO3 |
|
|
8 |
KOH |
|
|
9 |
NaOH |
|
|
10 |
Ba(OH)2 |
|
|
11 |
NH3+H2O |
|
|
12 |
KHCO3 |
|
|
13 |
KH2PO4 |
|
|
14 |
Na2CO3 |
|
|
15 |
AlCl3 |
|
|
16 |
C2H5OH |
|
|
17 |
FeSO4 |
|
|
18 |
NaHSO4 |
|
|
19 |
Ca(NO3)2 |
|
|
20 |
Fe2(SO4)3 |
|
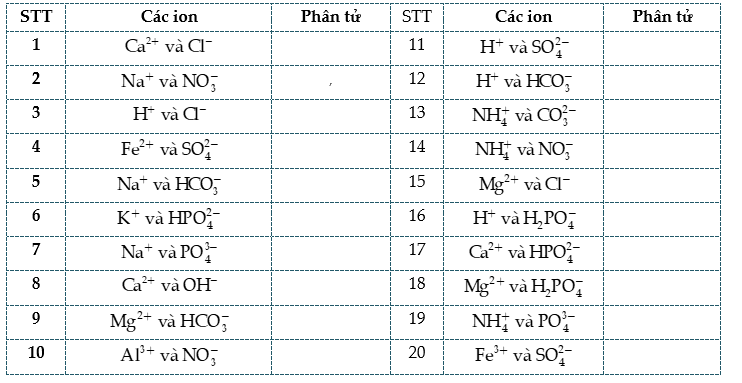
Câu 3: Viết các phân tử mà quá trình phân li của nó phân li ra các ion:
DẠNG 3: TÍNH NỒNG ĐỘ MOL CỦA ION TRONG DUNG DỊCH
Ví dụ 1: Cho 500 mL dung dịch NaOH có khối lượng là 8 gam. Tính nồng độ mol của NaOH
Hướng dẫn giải:
Đổi 500ml = 0,5 lít
Ví dụ 2: Nồng độ mol của anion trong dung dịch Fe(NO3)2 0,20M là
A. 0,20M.
B. 0,40M.
C. 0,60M.
D. 0,80M.
Hướng dẫn giải:
Ví dụ 3: Trộn 100 ml dung dịch Ba(OH)2 0,5M với 100 ml dung dịch KOH 0,5M, thu được dung dịch X. Nồng độ mol/L của ion OH – trong dung dịch X là
A. 0,65M.
B. 0,55M.
C. 0,75M.
D. 1,5M.
Hướng dẫn giải:
Câu 4: Tính nồng độ mol/L của các ion trong dung dịch
|
1 |
0,5 lít dung dịch có hòa tan 4 gam NaOH |
|
|
2 |
2 lít dung dịch có hoàn tan 0,3 mol FeCl3 |
|
|
3 |
Trộn 100 mL dung dịch NaOH 0,4M với 100mL dung dịch Ba(OH)2 0,2M |
|
|
4 |
Trộn 50mL dung dịch NaCl 0,4M với 150mL dung dịch KCl 0,2M |
|
|
5 |
Trộn 100mL dung dịch HCl 0,5M với 300mL dung dịch H2SO4 0,5M |
|
|
6 |
Trộn 100mL dung dịch NaOH có khối lượng là 8 gam với 400mL dung dịch KOH có khối lượng là 5,6 gam. |
|
PHẦN B. CÁC DẠNG BÀI TẬP TRẮC NGHIỆM
KHẢ NĂNG DẪN ĐIỆN
Câu 5: Chất nào sau đây dẫn điện được?
A. KBr trong nước.
B. KBr rắn khan.
C. Br2 lỏng.
D. Hơi Br2.
Câu 6: Dãy gồm các chất mà dung dịch của chúng không dẫn được điện là
A. CH3OH, đường saccarose.
B. CuSO4, HCl.
C. NaOH, Na2CO3.
D. HNO3, NH4Cl.
Câu 7: Dung dịch chất nào sau đây không dẫn điện được?
A. HCl trong C6H6 (benzene).
B. Ca(OH)2 trong nước.
C. CH3COONa trong nước.
D. NaHSO4 trong nước.
Câu 8: Dung dịch nào sau đây có khả năng dẫn điện?
A. Dung dịch đường.
B. Dung dịch rượu.
C. Dung dịch muối ăn.
D. Dung dịch benzene.
Câu 9: Chất nào dưới đây không phân li ra ion khi hòa tan trong nước?
A. MgCl2.
B. HClO3.
C. Ba(OH)2.
D. C6H12O6 (glucose).
Câu 10: Dung dịch glycerine [(C3H5(OH)3] trong nước không dẫn điện, dung dịch sodium hydroxide (NaOH) dẫn điện tốt. Điều này được giải thích:
A. Glycerine là chất hữu cơ, còn NaOH là chất vô cơ.
B. Trong dung dịch, NaOH bị phân li thành các ion, còn glycerine thì không.
C. Glycerine là chất lỏng, NaOH là chất rắn.
D. Phân tử glycerine chứa liên kết cộng hóa trị, còn NaOH là hợp chất ion.
Câu 11: Dung dịch chất điện li dẫn điện được là do trong dung dịch có chứa:
A. Các electron chuyển động tự do.
B. Các cation và anion chuyển động tự do.
C. Các ion H+ và OH− chuyển động tự do.
D. Các ion được gắn cố định tại các nút mạng.
Câu 12: Nước đóng vai trò gì trong quá trình điện li các chất tan trong nước?
A. Môi trường điện li.
B. Dung môi không phân cực.
C. Dung môi phân cực.
D. Tạo liên kết hydrogen với các chất tan.
Câu 13: Chất nào sau đây dẫn điện được?
A. Fe2O3 rắn, khan.
B. Cho CuO vào nước dư, khuấy đều.
C. KNO3 rắn, khan.
D. Cho Na2SO4 vào nước dư, khuấy đều.
Câu 14: Trường hợp nào sau đây không dẫn điện?
A. Dung dịch NaCl trong nước.
B. NaCl khan.
C. NaCl nóng chảy.
D. Dung dịch hỗn hợp NaCl và HCl.
Câu 15: Cho các chất khí: Cl2, SO2, CO2, SO3, HCl, HF, HBr, O2, H2. Số chất khi thêm H2O thu được dung dịch dẫn điện là
A. 1.
B. 10.
C. 9.
D. 7.
Câu 16: Hòa tan các chất sau vào nước để được các dung dịch riêng rẽ: NaCl, CaO, SO3, C6H12O6, CH3COOH, C2H5OH, Al2(SO4)3. Trong các dung dịch tạo ra có bao nhiêu dung dịch có khả năng dẫn điện?
A. 5.
B. 6.
C. 7.
D. 8.
SỰ ĐIỆN LI, CHẤT ĐIỆN LI, CHẤT KHÔNG ĐIỆN LI
Câu 17: Câu nào sau đây đúng khi nói về sự điện li?
A. Sự điện li là sự hoà tan một chất vào nước thành dung dịch.
B. Sự điện li là sự phân li một chất dưới tác dụng của dòng điện.
C. Sự điện li là sự phân li một chất thành ion khi tan trong nước.
D. Sự điện li là quá trình oxi hoá - khử.
Câu 18: Chất điện li là chất tan trong nước
A. phân li ra ion.
B. phân li một phần ra ion.
C. phân li hoàn toàn thành ion.
D. tạo dung dịch dẫn điện tốt.
Câu 19: Trong số các chất sau: HNO2, CH3COOH, KMnO4, C6H6, HCOOH, HCOOCH3, C6H12O6 (glucose), C2H5OH, SO2, Cl2, NaClO, CH4, NaOH, H2S. Số chất thuộc loại chất điện li là
A. 7.
B. 8.
C. 9.
D. 10.
Câu 20: Cho dãy các chất sau: HNO3, SO3, KOH, C3H7OH, Na2SO4, C5H8, HCOOH. Số chất điện li là
A. 5.
B. 4.
C. 7.
D. 6.
Câu 21: Cho dãy các chất: CuSO4.5H2O, C2H5OH, C12H22O11 (saccarose), CH3COOH, Ca(OH)2, CH3COONH4. Số chất điện li là
A. 3.
B. 4.
C. 5.
D. 2.
Câu 22: Hợp chất nào sau đây không phải là chất điện li?
A. Acid.
B. Oxide.
C. Base.
D. Muối.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Chủ đề 1: Khái niệm về cân bằng hóa học
Chủ đề 3: Thuyết BRONSTED – LOWRY về acid- base
Chủ đề 4: pH của dung dịch. Chất chỉ thị acid- base
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức