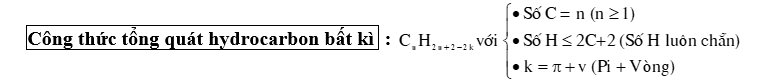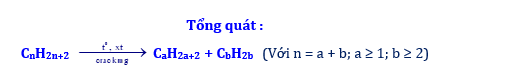Chủ đề 1: Alkane | Chuyên đề dạy thêm Hoá học 11
Tài liệu Chủ đề 1: Alkane gồm các dạng bài tập trắc nghiệm và tự luận từ cơ bản đến nâng cao giúp thầy cô có thêm tài liệu giảng dạy Hoá học lớp 11.
Chỉ từ 450k mua trọn bộ Chuyên đề dạy thêm Hóa 11 (cả 3 sách) bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
PHẦN LÝ THUYẾT
I. KHÁI NIỆM & ĐỒNG ĐẲNG VỀ ALKANE
⦁ Alkane (Paraffin) là các hydrocarbon no, mạch hở, có công thức chung là : CnH2n+2 (n ≥1).
⦁ Trong phân tử alkane chỉ có các liên kết đơn (δ) C – C và C – H.
|
Số nguyên tử carbon |
Tên tiền tố |
Công thức phân tử Alkane |
Công thức cấu tạo Alkane |
Tên Alkane |
|
C1 |
Meth– |
CH4 |
CH4 |
Methane |
|
C2 |
Eth– |
C2H6 |
CH3CH3 |
Ethane |
|
C3 |
Prop– |
C3H8 |
CH3CH2CH3 |
Propane |
|
C4 |
But– |
C4H10 |
CH3[CH2]2CH3 |
Butane |
|
C5 |
Pent– |
C5H12 |
CH3[CH2]3CH3 |
Pentane |
|
C6 |
Hex– |
C6H14 |
CH3[CH2]4CH3 |
Hexane |
|
C7 |
Hept– |
C7H16 |
CH3[CH2]5CH3 |
Heptane |
|
C8 |
Oct– |
C8H18 |
CH3[CH2]6CH3 |
Octane |
|
C9 |
Non– |
C9H20 |
CH3[CH2]7CH3 |
Nonane |
|
C10 |
Dec– |
C10H22 |
CH3[CH2]8CH3 |
Decane |
II. ĐỒNG PHÂN – DANH PHÁP
2.1. Đồng phân: Cùng công thức phân tử nhưng khác công thức cấu tạo.
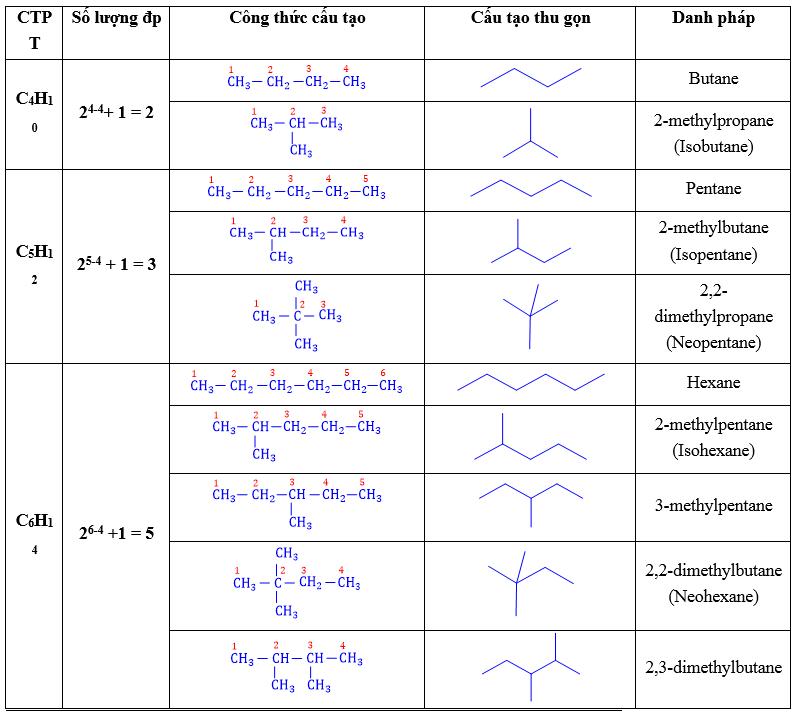
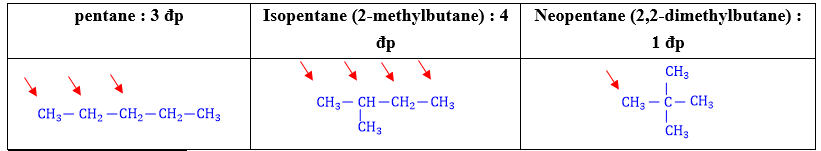
⦁ Các alkane từ C1 ⟶ C3 không có đồng phân. Từ C4 trở đi có đồng phân mạch C ⟶ Công thức nhanh : 2n–4 + 1 (3 < n < 7)
⦁ Số lượng các đồng phân : C4 : 2 đồng phân C5 : 3 đồng phân C6 : 5 đồng phân C7 : 9 đồng phân
2.2. Cách viết đồng phân
+ Bước 1 : Viết đồng phân mạch C thẳng (không nhánh).
+ Bước 2 : Viết đồng phân mạch C phân nhánh :
⦁ Bẻ 1C trên mạch chính làm mạch nhánh, gắn nhánh vào các vị trí khác nhau trên mạch chính. Lưu ý không gắn nhánh vào vị trí C đầu mạch.
⦁ Khi bẻ 1C không còn đồng phân thì bẻ 2C. 2C đó có thể cùng liên kết với 1C hoặc 2C khác nhau trên mạch chính.
⦁ Lần lượt bẻ tiếp các C khác cho đến khi không bẻ được nữa thì dừng lại.
2.3. Bậc của carbon trong alkane ⦁ Bậc của 1 nguyên tử carbon bằng số nguyên tử C liên kết trực tiếp với nó.
2.4 "Tên IUPAC” = “Tên thay thế” = “Tên quốc tế” = “Tên hệ thống” của alkane
⦁ Bước 1 : Chọn mạch carbon chính phải dài nhất (nhiều C nhất).
⦁ Bước 2 : Đánh số thứ tự carbon gần nhánh nhất sao cho tổng số vị trí nhánh là nhỏ nhất.
⦁ Bước 3 : Phải nêu đầy đủ số chỉ vị trí của các nhánh và thêm tiền tố đi (2), tri (3), tetra (4) trước tên các nhánh giống nhau.
⦁ Bước 4 : Giữa số và số phải có dấu phẩy “,”. Giữa số và chữ phải có dấu gạch ngang “–“
⦁ Bước 5 : Nhóm thế cùng loại : Thứ tự đọc theo α, ?,…. Ví dụ trong phân tử có nhóm -CH3- và -C2H5 thì đọc ethyl trước và methyl sau.
⦁ Bước 6 : Gọi tên theo công thức : Tên Alkane = số chỉ vị trí nhánh + tên nhánh + tên mạch chính + ane
Từ tên gọi suy ra công thức cấu tạo :
⦁ Bước 1 : Viết mạch chính, ví dụ : Propane (mạch chính có 3C), Butane (mạch chính có 4C), Pentane (5C),….
⦁ Bước 2 : Viết nhánh dựa vào số chỉ vị trí và tên nhánh, ví dụ : 2-methyl (có 1 nhóm CH3 ở vị trí C số 2),
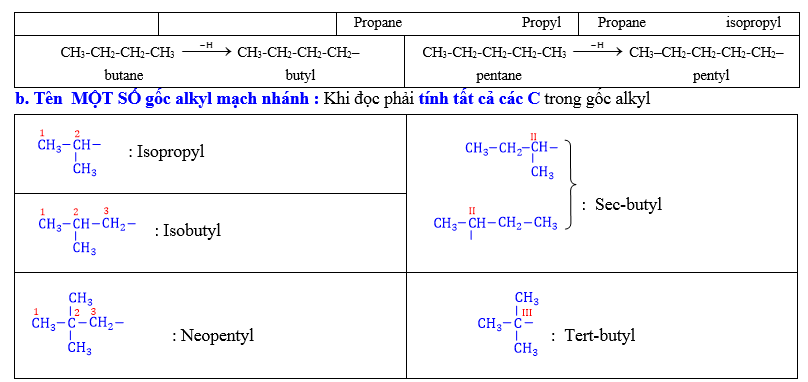
2.5. Tên các nhóm alkyl: Alkane (CnH2n+2) -H→ Alkyl (CnH2n+1–)
a. Tên gốc alkyl mạch thẳng
III. TÍNH CHẤT VẬT LÝ
+ Ở điều kiện thường, alkane :
⦁ Trạng thái khí : C1 ⟶ C4 và neopentane.
⦁ Trạng thái lỏng : C5 ⟶ C17 (trừ neopentane).
⦁ Trạng thái rắn : C18 ⟶ ....
+ Alkane không tan hoặc ít tan trong nước và nhẹ hơn nước, tan tốt trong dung môi hữu cơ.
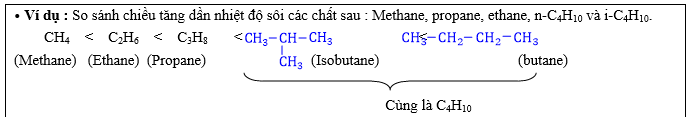
+ So sánh nhiệt độ sôi các alkane :
⦁ Khác số C : Số C càng cao ⟶ tos càng cao.
⦁ Cùng số C : Càng gọn (ít nhánh) thì tos càng cao và ngược lại càng cồng kềnh (nhiều nhánh) thì tos càng thấp.
+ Khi số nguyên tử carbon tăng, phân tử khối và tương tác Van der Waals giữa các phân tử alkane tăng, dẫn đến nhiệt độ sôi của các alkane cũng tăng.
+ Alkane có cùng công thức phân tử, các chất có nhánh sẽ gọn & tròn hơn, các chất không nhánh sẽ dài & cồng kềnh hơn vì vậy diện tích bề mặt chất có nhánh sẽ hơn chất không nhánh dẫn đến lực liên kết giữa các phân tử có nhánh yếu hơn không nhánh ⟶ Chất có nhánh có tos thấp hơn chất không nhánh.
IV. TÍNH CHẤT HOÁ HỌC
⦁ Trong phân tử alkane chỉ có các liên kết s bền & kém phân cực ⟶ phân tử alkane hầu như không phân cực và ở điều kiện thường alkane tương đối trơ về mặt hóa học (không tác dụng với acid, kiềm và 1 số chất oxi hóa như dung dịch Br2, KMnO4,...).
⦁ Phản ứng xảy ra sẽ kèm theo việc thay thế nguyên tử H hoặc bẻ gãy mạch carbon.
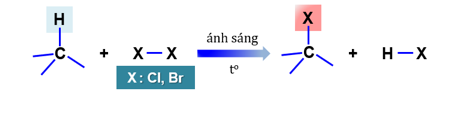
4.1. Phản ứng thế halogen (halogen hóa): Phản ứng đặc trưng của alkane
⦁ Các sản phẩm thế được gọi là dẫn xuất halogen của hydrocarbon.
⦁ Quy tắc thế : Nguyên tử halogen ưu tiên thế vào nguyên tử H của carbon bậc cao (ít H)
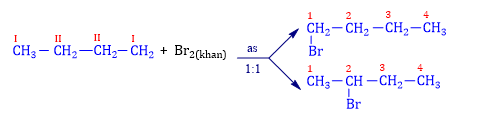
⦁ Ví dụ: Trộn butane và bromine khan với ánh sáng tử ngoại :
Lưu ý : Hexane làm mất màu nước bromine ở điều kiện đun nóng hoặc có ánh sáng.
⦁ Ví dụ: Xét công thức C5H12 + Cl2 as→1:1 C5H11Cl + HCl thì C5H11Cl có 8 đồng phân là
4.2. Phản ứng cracking
Cracking là phản ứng “bẻ gãy” các phân tử alkane mạch dài thành những hydrocarbon mạch ngắn hơn.
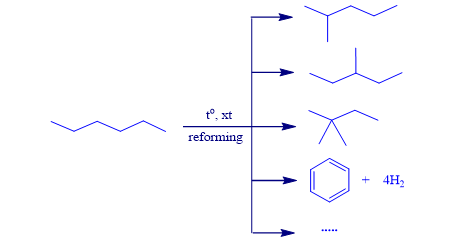
4.3. Phản ứng reforming
⦁ Reforming là phản ứng biến đổi cấu trúc alkane mạch không phân nhánh thành các alkane mạch phân nhánh & các hydrocarbon mạch vòng nhưng không làm thay đổi số C trong phân tử và cũng không làm thay đổi đáng kể nhiệt độ sôi của chúng.
⦁ Quá trình reforming được ứng dụng trong công nghiệp lọc dầu để làm tăng chỉ số xăng octane của xăng & sản xuất các arene (benzene, toluene, xylene) làm nguyên liệu cho công nghiệp tổng hợp hữu cơ.
Ví dụ : Reforming hexane
4.4. Phản ứng oxi hóa
a) Phản ứng oxi hóa hoàn toàn (phản ứng cháy)
Khi tiếp xúc với oxygen và có tia lửa khơi mào, alkane bị đốt cháy tạo thành khí carbon dioxide, hơi nước và giải phóng năng lượng, tỏa nhiều nhiệt nên được dùng làm nhiên liệu để đun nấu, sưởi ấm và cung cấp năng lượng cho các ngành công nghiệp.
Tổng quát: CnH2n+2 + (3n+12)O2 to→ nCO2 + (n+1)H2O
b) Phản ứng oxi hóa không hòan toàn
Ở nhiệt độ cao, có mặt xúc tác, alkane có bị oxi hóa, cắt mạch carbon bởi oxygen tạo thành hỗn hợp carboxyic acid :
2RCH2–CH2R’ + 5O2 to→ RCOOH + R’COOH + H2O
Trong trường hợp thiếu oxygen, phản ứng cháy xảy ra không hoàn toàn, tạo CO và có thể có C, gây ô nhiễm môi trường :
Ví dụ 1 : 2C4H10 + 9O2 (thiếu) to→8CO + 10H2O
Ví dụ 2 : 2C4H10 + 5O2 (thiếu) to→8C + 10H2O
V. ĐIỀU CHẾ, ỨNG DỤNG
1) Điều chế akane ở thể khí trong công nghiệp : Lấy từ khí thiên nhiên & dầu mỏ ⟶ Loại bỏ tạp chất (H2S & CO2) ⟶ Nén lại ở dạng lỏng. Khí dầu mỏ hóa lỏng (LPG) và khí thiên nhiên hóa lỏng (LNG : Liquefied natural gas).
2) Điều chế akane ở thể lỏng, rắn trong công nghiệp : Chưng cất phân đoạn dầu mỏ được các alkane có chiều dài mạch C khác nhau ở nhiệt độ sôi khác nhau sau đó tinh chế rất phức tạp để thu được alkane. Khí ngưng tụ chứa chủ yếu là alkane C5 – C8 thu được khi khai thác dầu mỏ được chế biến thành xăng.
3) Ứng dụng
⦁ Khí thiên nhiên & dầu mỏ (CH4) là nhiên liệu sạch.
⦁ LPG (Liquefied Petroleum Gas) chứa C3H8 và C4H10.
⦁ Alkane lỏng : Làm nhiên liệu xăng, diesel, nhiên liệu phản lực (jet fuel),...
⦁ Các alkane C6, C7, C8 : Sản xuất benzene, toluen, xylene,...
⦁ C11 – C20 (vaseline): Làm kem dương da, sáp nẻ, thuốc mỡ.
⦁ C20 – C35 (paraffin) : Dùng làm nến, sáp.
................................
................................
................................
Xem thử tài liệu tại đây: Link tài liệu
Xem thêm chuyên đề dạy thêm Hoá học 11 các chủ đề hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức