Giải Hóa 11 Bài 38: Hệ thống hóa về hiđrocacbon thiên nhiên
Lời giải bài tập Hóa học lớp 11 Bài 38: Hệ thống hóa về hiđrocacbon thiên nhiên chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa 11 Bài 38. Mời các bạn đón xem:
Mục lục Giải Hóa 11 Bài 38: Hệ thống hóa về hiđrocacbon thiên nhiên
Video giải Hóa 11 Bài 38: Hệ thống hóa về hiđrocacbon thiên nhiên
Bài 1 trang 172 Hóa 11: So sánh tính chất hoá học của:
Lời giải:
a/ So sánh tính chất hóa học anken và ankin:
- Giống nhau:
Cả anken và ankin đều tham gia phản ứng cộng:
+ Cộng hiđro:
Ví dụ: CH2 = CH2 + H2 CH3 – CH3
CH ≡ CH + 2H2 CH3 – CH3
+ Cộng dung dịch brom:
Ví dụ: CH2 = CH2 + Br2 → CH2Br – CH2Br
CH ≡ CH + 2Br2 → CHBr2 – CHBr2
+ Cộng HX đều theo quy tắc Mac-côp-nhi-côp.
Cả anken và ankin đều làm mất màu dung dịch thuốc tím:
Ví dụ:
3CH ≡ CH + 4H2O + 8KMnO4 → 3(COOH)2 + 8MnO2 + 8KOH
3CH2 = CH2 + 2KMnO4 + 4H2O → 3CH2OH – CH2OH + 2MnO2 + 2KOH
- Khác nhau :
+ Anken: Không có phản ứng thế bằng ion kim loại.
+ Ankin: Các Ank-1-in có phản ứng thế bằng ion kim loại:
Ví dụ:
CH ≡ CH + 2AgNO3 + 2NH3 → AgC ≡ CAg + 2NH4NO3
Cả anken và ankin đều bị oxi hóa hoàn toàn tạo ra CO2 và H2O
CnH2n + O2 nCO2 + nH2O
CnH2n - 2 + O2 nCO2 +( n – 1)H2O
b/ So sánh tính chất hóa học ankan và ankylbenzen:
- Giống nhau:
+ Cả ankan và ankylbenzen đều có phản ứng thế bởi halogen:
Ví dụ:
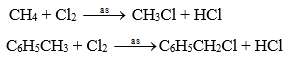
+ Cả ankan và ankylbenzen đều bị oxi hóa hoàn toàn tạo ra CO2 và H2O
Tổng quát:
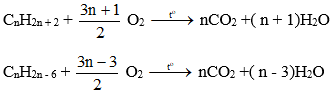
- Khác nhau:
+ Ankylbenzen có phản ứng cộng còn ankan thì không.
Ví dụ:
CnH2n – 6 + 3H2 CnH2n
Bài 2 trang 172 Hóa 11: Trình bày phương pháp hoá học
a. Phân biệt các khí đựng trong các bình riêng biệt không dán nhãn: H2, O2, CH4, C2H4, C2H2
b. Tách riêng khí metan từ hỗn hợp với lượng nhỏ các chất C2H4, C2H2.
Lời giải:
a. Đánh số thứ tự từng bình chứa khí, trích mỗi bình một ít sang lọ đánh số tương ứng.
- Cho que đóm còn tàn đỏ lần lượt vào từng lọ các mẫu khí, mẫu nào làm que đóm bùng cháy thì đó là O2.
- Lần lượt dẫn các khí còn lại qua dung dịch AgNO3/NH3, mẫu khí nào làm dung dịch xuất hiện kết tủa vàng thì đó là C2H2.
CH≡CH + 2AgNO3 + 2NH3 → AgC≡CAg↓ + 2NH4NO3
- Tiếp tục dẫn các mẫu khí còn lại qua dung dịch brom, khí nào làm nhạt màu dung dịch brom thì đó là C2H4.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
- Đốt cháy hai mẫu khí còn lại, dẫn sản phẩm qua bình đựng dung dịch Ca(OH)2 dư, nếu xuất hiện kết tủa trắng thì đó là CH4
2H2 + O2 2H2O
CH4 + 2O2 CO2 + 2H2O
CO2 + Ca(OH)2 dư → CaCO3↓ + H2O
- Khí còn lại là H2
b. Cho hỗn hợp khí đi qua dung dịch Br2 dư, C2H4 và C2H2 phản ứng và bị giữ lại trong bình, khí thoát ra khỏi bình là metan tinh khiết.
CH2=CH2 + Br2 (nâu đỏ) → BrCH2-CH2Br (không màu)
CH≡CH + 2Br2 (nâu đỏ) → Br2CH-CHBr2 (không màu)
b. Metan axetilen vinylaxetilen butađienpolibutađien
Lời giải:
a). CH3 – CH3 CH2 = CH2 + H2
nCH2 = CH2 (-CH2 – CH2 - )n
b). 2CH4 CH ≡ CH + 3H2
2 CH ≡ CHCH ≡ C – CH = CH2
CH ≡ C – CH = CH2 + H2 CH2 = CH – CH = CH2
CH2 = CH – CH = CH2 (-CH2 – CH = CH – CH2 -)n
c). C6H6 + Br2 C6H5Br + HBr
Lời giải:
- Đốt cháy ankan:
CnH2n + 2 + O2 nCO2 +( n + 1)H2O
Có n + 1 > n vậy đốt cháy ankan thu được
- Đốt cháy anken:
CnH2n + O2 nCO2 + nH2O
Đốt cháy anken thu được
- Đốt cháy ankin:
CnH2n - 2 + O2 nCO2 +( n – 1)H2O
Có n – 1 < n vậy đốt cháy ankin thu được .
- Đốt cháy ankylbenzen:
CnH2n - 6 + O2 nCO2 +( n - 3)H2O
Có n – 3 < n vậy đốt cháy ankylbenzen thu được
Lời giải:
- Đáp án C
- Khi đốt cháy X thu được CO2 và H2O có số mol theo tỉ lệ 2 : 1
⇒ X có số C bằng số H
Mà X là chất lỏng ở điều kiện thường nên X chỉ có thể là C6H6
Bài giảng Hóa 11 Bài 38: Hệ thống hóa về hiđrocacbon thiên nhiên
Xem thêm lời giải bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 39: Dẫn xuất halogen của hiđrocacbon
Bài 42: Luyện tập: Dẫn xuất halogen, ancol và phenol
Bài 43: Bài thực hành 5: Tính chất của etanol, glixerol và phenol
Xem thêm tài liệu Hóa học lớp 11 hay, chi tiết khác:
Lý thuyết Hệ thống hóa về hiđrocacbon
Trắc nghiệm Hệ thống hóa về hidrocacbon thiên nhiên có đáp án
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
