Giải Hóa 11 Bài 15: Cacbon
Lời giải bài tập Hóa học lớp 11 Bài 15: Cacbon chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa 11 Bài 15. Mời các bạn đón xem:
Mục lục Giải Hóa 11 Bài 15: Cacbon
Video giải Hóa 11 Bài 15: Cacbon
Bài 1 trang 70 Hóa 11: Tại sao hầu hết các hợp chất của cacbon lại là hợp chất cộng hóa trị?
Lời giải:
Cấu hình electron của C: 1s22s22p2
C có 4 electron lớp ngoài, để bền vững các nguyên tố cần có 8 electron lớp ngoài cùng. Độ âm điện của C là 2,55 (độ âm điện trung bình) nên C khó cho hoặc nhận electron một cách hoàn toàn vì vậy mà chủ yếu C hình thành liên kết với các nguyên tố khác bằng việc dùng chung các electron (liên kết cộng hoá trị).
Bài 2 trang 70 Hóa 11: Tính oxi hóa của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
Lời giải:
Đáp án C.
A. 0C + O2 → +4CO2
Trong phản ứng này số oxi hóa của C tăng từ 0 lên +4
→ C là chất khử.
B. 0C + 2CuO → 2Cu + +4CO2
Trong phản ứng này số oxi hóa của C tăng từ 0 lên +4
→ C là chất khử.
C. 30C +4Al→Al4−4C3
Trong phản ứng này số oxi hóa của C giảm từ 0 về -4.
→ C là chất oxi hóa.
D. 0C +H2O →+2CO +H2
Trong phản ứng này số oxi hóa của C tăng từ 0 lên +2
→ C là chất khử.
C thể hiện tính oxi hoá khi số oxi hoá giảm (tác dụng với chất khử) nên đáp án C đúng.
Bài 3 trang 70 Hóa 11: Tính khử của cacbon thể hiện ở phản ứng nào trong các phản ứng sau?
Lời giải:
Đáp án C.
A. 0C + Ca → Ca−4C2
Trong phản ứng này số oxi hóa của C giảm từ 0 về -4.
→ C là chất oxi hóa.
B. 0C + 2H2 →−4CH4
Trong phản ứng này số oxi hóa của C giảm từ 0 về -4.
→ C là chất oxi hóa.
C. 0C ++4CO2 → 2+2CO
Trong phản ứng này số oxi hóa của C tăng từ 0 (C đơn chất) lên +2 (trong CO)
→ C là chất khử.
Số oxi hóa của C giảm từ +4 (trong CO2) về +2 (trong CO)
→ CO2 là chất oxi hóa.
D. 30C +4Al→Al4−4C3
Trong phản ứng này số oxi hóa của C giảm từ 0 về -4.
→ C là chất oxi hóa.
C thể hiện tính khử khi số oxi hoá tăng (tác dụng với chất oxi hoá) nên đáp án C đúng.
Bài 4 trang 70 Hóa 11: Lập phương trình hóa học của các phản ứng sau đây:
a) H2SO4 (đặc) + C t°→ SO2 + CO2 + ?
b) HNO3 (đặc) + C t°→ NO2 + CO2 + ?
Lời giải:
Lời giải dưới thể hiện đầy đủ cả phần tăng giảm số oxi-hóa và cách cân bằng phương trình hóa hoc:
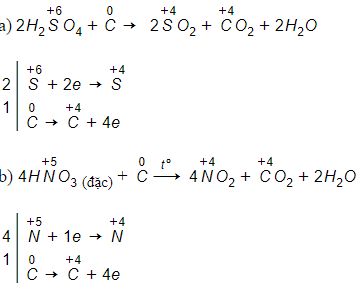
Lời giải:
nCO2=1,06.100022,4 = 47,32 mol
C + O2 → CO247,32 ← 47,32 mol
Theo phương trình:
nC = nCO2 = 47,32 mol
→ mC = 47,32. 12 = 567,84 gam
% mC = 567,840,6.1000.100 = 94,64%
Bài giảng Hóa 11 Bài 15: Cacbon
Xem thêm lời giải bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 17: Silic và hợp chất của silic
Bài 19: Luyện tập tính chất của cacbon, silic và hợp chất của chúng
Bài 20: Mở đầu về hóa học hữu cơ
Xem thêm tài liệu Hóa học lớp 11 hay, chi tiết khác:
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
