Giải Hóa 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
Lời giải bài tập Hóa học lớp 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa 11 Bài 13. Mời các bạn đón xem:
Mục lục Giải Hóa 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
Video giải Hóa 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
Lời giải:
, , , , , ,
Bài 2 trang 61 Hóa 11: Trong các công thức sau đây, chọn công thức hóa học đúng của magie photphua:
Lời giải:
Đáp án C
Magie photphua là hợp chất của Mg và P.
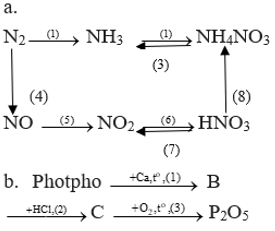
Bài 3 trang 61 Hóa 11: a) Lập các phương trình hóa học sau đây:
Ca(H2PO4)2 và Ca(OH)2 với tỉ lệ mol 1:1 (3)
Lời giải:
a)
2NH3 + 3Cl2 → N2 + 6HCl (1)
8NH3 + 3Cl2 → N2 + 6NH4Cl (2)
NH3 + CH3COOH → CH3COONH4 (3)
(NH4)3PO4 H3PO4 + 3NH3 (4)
Zn(NO3)2 2Zn + 4NO2 + O2 (5)
b)
(1) 2K3PO4 + 3Ba(NO3)2 → Ba3(PO4)2↓ + 6KNO3
3Ba2+ + 2PO43- → Ba3(PO4)2↓
(2) 2Na3PO4 + 3CaCl2 → Ca3(PO4)2↓ + 6NaCl
3Ca2+ + 2PO43- → Ca3(PO4)2↓
(3) Ca(H2PO4)2 + Ca(OH)2 → 2CaHPO4↓ + 2H2O
Phương trình phân tử trùng phương trình ion rút gọn.
(4) 2(NH4)3PO4 + 3Ba(OH)2 → Ba3(PO4)2↓ + 6NH3↑ + 6H2O
6NH4+ + 2PO43- + 3Ba2+ + 6OH- → Ba3(PO4)2↓ + 6NH3↑ + 6H2O
Lời giải:
N2 + 3H2 2NH3
H2 + Cl2 2HCl
NH3 + HCl → NH4Cl (amoni clorua)
Bài 5 trang 62 Hóa 11: Viết phương trình hóa học thực hiện các dãy chuyển hóa sau:
Lời giải:
a)
(1) N2 + 3H2 2NH3
(2) NH3 + HNO3 → NH4NO3
(3) NH4NO3 N2O + 2H2O
(4) N2 + O2 2NO
(5) 2NO + O2 → 2NO2
(6) 4NO2 + O2 + 2H2O → 4HNO3
(7) 4HNO4 4NO2 + O2 + 2H2O
(8) 8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
b)
(1) 2P + 3Ca Ca3P2 (B)
(2) Ca3P2 + 6HCl → 3CaCl2 + 2PH3
(3) 2PH3 + 4O2 P2O5 + 3H2O
Lời giải:
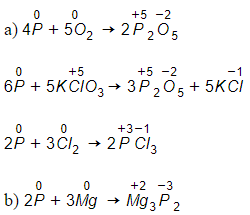
Lời giải:
Gọi nAl = x mol, nCu = y mol;
= 0,2 mol
mAl + mCu = m hỗn hợp
→ 27x + 64y = 3 (1)
Bảo toàn electron:
3.nAl + 2.nCu =
→ 3x + 2y = 0,2 (2)
Từ (1) và (2) suy ra:
x = 0,0492 mol;
y = 0,026 mol
→ %mAl = = 44,5%
%mCu = 100 – 44,5 = 55,5%
Lời giải:
= V. D = 25. 1,03
= 25,75g
ban đầu =
= 1,545 gam
P2O5 + 3H2O → 2H3PO4
Theo phương trình: = 2.
= 2. = mol
→ = .98
= 8,282 gam
(sau phản ứng) = 1,545 + 8,282
= 9,827(g)
Khối lượng dung dịch sau phản ứng
= 25,75 + 6 = 31,75(g)
C%H3PO4 =
= 30,95%
Lời giải:
10 ha khoai tây cần 60.10 = 600 kg nitơ
Bảo toàn nguyên tố Nitơ:
→ 1 mol (80g) NH4NO3 tạo thành 1 mol (28g) N2
Lượng NH4NO3 cần để có 600kg N2 là
= 1714,286 kg
Phân đạm amoni nitrat chứa 97,5% NH4NO3 nên lượng phân đạm cần bón là:
Bài giảng Hóa 11 Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
Xem thêm lời giải bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 14: Bài thực hành 2. Tính chất của một số hợp chất nitơ, photpho
Bài 17: Silic và hợp chất của silic
Xem thêm tài liệu Hóa học lớp 11 hay, chi tiết khác:
Lý thuyết Luyện tập: Tính chất của nitơ, photpho và các hợp chất của chúng
Trắc nghiệm Luyện tập: Tính chất hóa học của nitơ, photpho và hợp chất của chúng có đáp án
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11