Giải Hóa 11 Bài 8: Amoniac và muối amoni
Lời giải bài tập Hóa học lớp 11 Bài 8: Amoniac và muối amoni chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa 11 Bài 8. Mời các bạn đón xem:
Mục lục Giải Hóa 11 Bài 8: Amoniac và muối amoni
Video giải Hóa 11 Bài 8: Amoniac và muối amoni
Lời giải:
- Thí ngiệm:
+ Khí amoniac được nạp vào đầy bình thuỷ tinh, đậy bình bằng nút cao su có ống thuỷ tinh nhọn xuyên qua.
+ Nhúng đầu ống thuỷ tinh vào chậu nước có pha vài giọt phenolphtalein.
- Hiện tượng: Nước dâng lên rất nhanh trong ống thuỷ tinh nhọn sau đó phun lên có tia màu hồng.
- Giải thích: Khí amoniac tan rất nhanh trong nước là giảm áp suất trong bình nên áp suất ngoài không khí nén vào mặt thoáng của chậu nước làm nước phun lên trong ống thuỷ tinh thành dòng. Amoniac tan trong nước tạo thành dung dịch có tính bazơ làm cho phenolphtalein không màu chuyển thành màu hồng.
Bài 2 trang 37 Hóa 11: Hoàn thành sơ đồ chuyển hóa sau và viết các phương trình hóa học:
Khí A +H2O→(1) Dung dịch A +HCl→(2) B +NaOH→(3) Khí A +HNO3→(4)C t°→(5) D + H2O
Biết rằng A là hợp chất của nitơ.
Lời giải:
Sơ đồ:
Khí NH3 +H2O→(1) Dung dịch NH3 +HCl→(2) NH4Cl +NaOH→(3) Khí NH3 +HNO3→(4)NH4NO3 t°→(5) N2O + H2O
Phương trình phản ứng:
(1) NH3 + H2O ⇌ NH4OH
(2) NH3 + HCl → NH4Cl
(3) NH4Cl + NaOH → NH3↑ + NaCl + H2O
(4) NH3 + HNO3 → NH4NO3
(5) NH4NO3 t°→ N2O + 2H2O
Lời giải:
Phương trình điều chế hiđro
CH4 + 2H2O t°, xt, p→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 t°→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 Fe, 450−500°C⇄200−300atm 2NH3
Lời giải:
Trích mẫu thử của 4 dung dịch ra 4 ống nghiệm có đánh số.
Cho quỳ tím vào từng ống: ống màu xanh là dung dịch NH3; hai ống có màu hồng là NH4Cl và (NH4)2SO4; ống không có hiện tượng gì là Na2SO4.
Cho Ba(OH)2 vào hai ống làm hồng quỳ tím. Nếu thấy ống nào có khí bay ra mùi khai là NH4Cl, ống vừa có khí bay ra mùi khai vừa có kết tủa là (NH4)2SO4.
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + 2H2O
A. Tăng áp suất và tăng nhiệt độ.
B. Giảm áp suất và giảm nhiệt độ.
C. Tăng áp suất và giảm nhiệt độ.
D. Giảm áp suất và tăng nhiệt độ.
Lời giải:
Đáp án C.
- Phản ứng điều chế NH3:
N2 + 3H2 Fe, 450−500°C⇄200−300atm 2NH3 ∆H < 0
- Sau phản ứng số mol khí giảm nên theo nguyên lí chuyển dịch cân bằng khi tăng áp suất cân bằng chuyển dịch theo chiều giảm áp suất (chiều thuận).
- Phản ứng này toả nhiệt nên khi giảm nhiệt độ cân bằng chuyển dịch theo chiều tăng nhiệt độ (chiều thuận)
Lời giải:
Phản ứng nhiệt phân:
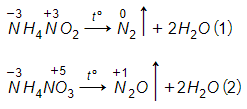
Trong hai phản ứng trên số oxi hoá của nitơ trong mỗi phản ứng đều thay đổi.
Trong mỗi phân tử muối một nguyên tử nitơ có số oxi hoá tăng, một nguyên tử có số oxi hoá giảm, đây là phản ứng oxi hoá khử nội phân tử.
Ở cả hai phản ứng nitơ nguyên tử trong ion đều là chất khử (chất cho electron) nitơ từ số oxi hoá -3 tăng lên 0 ở phản ứng (1) và lên +1 ở phản ứng (2).
Nguyên tử nitơ trong ion và là chất oxi hoá (chất nhận e). Ở phản ứng (1) số oxi hoá của N từ +3 (trong ) xuống 0 và ở phản ứng (2) số oxi hoá của nitơ từ +5 (trong ) xuống +1.
Bài 7 trang 38 Hóa 11: Cho dung dịch NaOH dư vào 150,0 ml dung dịch (NH4)2SO4 1,00M, đun nóng nhẹ.
a) Viết phương trình hoá học ở dạng phân tử và dạng ion rút gọn?
b) Tính thể tích khí (đktc) thu được?
Lời giải:
a)
Phương trình dạng phân tử:
2NaOH + (NH4)2SO4 → 2NH3↑ + Na2SO4 + 2H2O
Phường trình dạng ion rút gọn:
+ OH- → 2NH3↑ + H2O
b) = 0,15. 1 = 0,15 mol
Theo phương trình:
= 2.
= 0,15. 2 = 0,3 mol
= 0,3. 22,4 = 6,72 lít
A. 44,8 lit N2 và 134,4 lit H2
B. 22,4 lit N2 và 134,4 lit H2
Lời giải:
Đáp án A
→ = 22,4 lít
N2 + 3H2 2NH3
Ta thấy tỉ lệ về thể tích cũng là tỉ lệ về số mol.
Theo phương trình:
lít
lít
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:
lít
= 134,4 lít
Bài giảng Hóa 11 Bài 8: Amoniac và muối amoni
Xem thêm lời giải bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 9: Axit nitric và muối nitrat
Bài 11: Axit photphoric và muối photphat
Bài 13: Luyện tập tính chất của nitơ, photpho và các hợp chất của chúng
Xem thêm tài liệu Hóa học lớp 11 hay, chi tiết khác:
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
