Giải Hóa 11 Bài 37: Nguồn hiđrocacbon thiên nhiên
Lời giải bài tập Hóa học lớp 11 Bài 37: Nguồn hiđrocacbon thiên nhiên chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa 11 Bài 37. Mời các bạn đón xem:
Mục lục Giải Hóa 11 Bài 37: Nguồn hiđrocacbon thiên nhiên
Video giải Hóa 11 Bài 37: Nguồn hiđrocacbon thiên nhiên
Lời giải:
- Dầu mỏ là chất lỏng, sánh, màu nâu đen, có mùi đặc trưng, nhẹ hơn nước và không tan trong nước.
- Dầu mỏ là hỗn hợp của nhiều hiđrocacbon khác nhau, về cơ bản đều gồm các nhóm chất sau:
+ Nhóm ankan từ C1 đến C50.
+ Nhóm xicloankan gồm chủ yếu xiclopentan, xiclohexan và các đồng đẳng của chúng.
+ Nhóm hiđrocacbon thơm gồm benzen, toluen, xilen, naphtalen và các đồng đẳng của chúng.
Ngoài thành phần chính là hiđrocacbon, trong dầu mỏ còn chứa một lượng nhỏ các hợp chất hữu cơ có chứa nitơ; oxi, lưu huỳnh và lượng nhỏ các chất vô cơ ở dạng hòa tan.
- Từ thành phần của dầu mỏ đã khái quát ở trên, dễ dàng kết luận được không thể biểu thị thành phần của dầu mỏ bằng một công thức nhất định.
Lời giải:
- Khí thiên nhiên có nhiều trong các mỏ khí, tại đó khí tích tụ trong các lớp đất, đá, xốp ở những độ sâu khác nhau và được bao bọc bởi các lớp đất đá không thấm nước và khí, chẳng hạn như đất sét.
- Khí mỏ dầu (còn được gọi là khí đồng hành vì nó thoát ra cùng với dầu mỏ) có trong các mỏ dầu.
- Khí lò cốc là khí thoát ra trong quá trình nung than mỡ để luyện cốc, khí lò cốc là hỗn hợp của các chất dễ cháy.
- Thành phần chính của khí thiên nhiên là metan (có thể chiếm tới 95% thể tích); Thành phần chính của khí mỏ dầu gần giống với khí thiên nhiên, nhưng hàm lượng metan thấp hơn (chỉ chiếm khoảng 50 – 70% thể tích); Thành phần chính của khí lò cốc là H2 (khoảng 59%).
- Các loại khí này đều được ứng dụng để làm nhiên liệu.
Lời giải:
- Dầu khai thác từ mỏ lên gọi là dầu thô. Dầu thô sau khi sơ chế loại bỏ nước, muối, được chưng cất ở áp suất thường trong các tháp chưng cất phân đoạn liên tục cao vài chục mét. Nhờ vậy người ta tách được những phân đoạn dầu có nhiệt độ sôi khác nhau. Các phân đoạn đó được đưa đi sử dụng hoặc được chế biến tiếp.
Các sản phẩm chưng cất dầu mỏ ở áp suất thường
|
Nhiệt độ sôi |
Số nguyên tử C trong phân tử |
Hướng xử lí tiếp theo |
|
< 180ºC |
1~10 Phân đoạn khí và xăng |
Chưng cất áp suất cao, tách phân đoạn C1-C2, C3-C4 khỏi phân đoạn lỏng (C5-C10) |
|
170-270ºC |
10~16 Phân đoạn dầu hoả |
Tách tạp chất chứ S, dùng làm nhiên liệu phản lực, nhiên liệu thắp sáng, đun nấu… |
|
250-350ºC |
16-21 Phân đoạn điêzen |
Tách tạp chất chứa S, dùng làm nhiên liệu cho động cơ điêzen |
|
350-400ºC |
21-30 Phân đoạn dầu nhờn |
Sản xuất dầu nhờn, làm nguyên liệu cho crăckinh |
|
> 400ºC |
> 30 Cặn mazut |
Chưng cất áp suất thấp lấy nguyên liệu cho crăckinh, dầu nhờn, parafin, nhựa rải đường |
- Than mỏ là một trong các loại nhiên liệu và nguyên liệu quan trọng. Than mỏ là phần còn lại của cây cỏ cổ đại đã bị biến hóa. Có 3 loại than chính: than gầy, than mỡ và than nâu.
Trong đó than mỡ được dùng để chế biến than cốc và cung cấp một lượng nhỏ hiđrocacbon.
Lời giải:
a. Nhiệt lượng cần để đun nóng 100 lít nước từ 20oC lên 100oC là:
4,18.(100 - 20).(100.103)
= 33 440 000 (J)
= 33 440 (kJ)
Gọi số mol khí thiên nhiên là x (mol)
⇒ nCH4 = 0,85x (mol) ;
nC2H6 = 0,1x (mol)
Nhiệt lượng toả ra khi đốt cháy metan là:
880.0,85x = 748x (kJ)
Nhiệt lượng toả ra khi đốt cháy etan là:
1560.0,1x = 156x (kJ)
⇒ 748x + 156x = 33440
⇒ x = 36,991 (mol)
Vậy thể tích khí thiên nhiên ở đktc cần dùng là:
36,991.22,4 = 828,6 (lít)
b. Ta có:
828,6 (lít) khí thiên nhiên có 0,85x (mol) CH4 và 0,1x (mol) C2H6
106 (lít) khí thiên nhiên có a (mol) CH4 và b (mol) C2H6
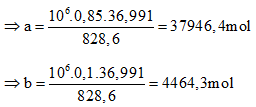
Ta có sơ đồ:
2CH4 → CH2 = CH – Cl
37946,4 → 18973,2 mol
C2H6 → CH2 = CH – Cl
4464,3 → 4464,3 mol
Số mol vinyl clorua thực tế là:
(18973,2 + 4464,3).0,65 = 15234,375 (mol)
Khối lượng vinyl clorua thực tế thu được là:
15234,375. 62,5 ≈ 952,15.103 (g) = 952,15 (kg)
Bài giảng Hóa 11 Bài 37: Nguồn hiđrocacbon thiên nhiên
Xem thêm lời giải bài tập Hóa học lớp 11 hay, chi tiết khác:
Bài 38: Hệ thống hóa về hiđrocacbon thiên nhiên
Bài 39: Dẫn xuất halogen của hiđrocacbon
Bài 42: Luyện tập: Dẫn xuất halogen, ancol và phenol
Xem thêm tài liệu Hóa học lớp 11 hay, chi tiết khác:
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 11 (hay nhất) | Để học tốt Ngữ Văn 11 (sách mới)
- Soạn văn 11 (ngắn nhất) | Để học tốt Ngữ văn 11 (sách mới)
- Tác giả tác phẩm Ngữ văn 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Văn mẫu 11 (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 11 | Giải bài tập Toán 11 Học kì 1, Học kì 2 (sách mới)
- Các dạng bài tập Toán lớp 11
- Lý thuyết Toán lớp 11 (sách mới) | Kiến thức trọng tâm Toán 11
- Giáo án Toán lớp 11 mới nhất
- Bài tập Toán lớp 11 mới nhất
- Chuyên đề Toán lớp 11 mới nhất
- Giải sgk Tiếng Anh 11 (thí điểm)
- Giải sgk Tiếng Anh 11 | Giải bài tập Tiếng anh 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Tiếng Anh 11 (sách mới) | Sách bài tập Tiếng Anh 11
- Giải sbt Tiếng Anh 11 (thí điểm)
- Giải sgk Lịch sử 11 | Giải bài tập Lịch sử 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Lịch Sử 11(sách mới) | Kiến thức trọng tâm Lịch Sử 11
- Giải Tập bản đồ Lịch sử 11
- Giải sgk Vật Lí 11 | Giải bài tập Vật lí 11 Học kì 1, Học kì 2 (sách mới)
- Giải sbt Vật Lí 11 (sách mới) | Sách bài tập Vật Lí 11
- Lý thuyết Vật Lí 11 (sách mới) | Kiến thức trọng tâm Vật Lí 11
- Các dạng bài tập Vật Lí lớp 11
- Giáo án Vật lí lớp 11 mới nhất
- Giải sgk Sinh học 11 | Giải bài tập Sinh học 11 Học kì 1, Học kì 2 (sách mới)
- Lý thuyết Sinh học 11 (sách mới) | Kiến thức trọng tâm Sinh 11
- Giải sgk Giáo dục công dân 11
- Lý thuyết Giáo dục công dân 11
- Lý thuyết Địa Lí 11 (sách mới) | Kiến thức trọng tâm Địa lí 11
- Giải Tập bản đồ Địa Lí 11
- Giải sgk Giáo dục quốc phòng - an ninh 11
