Hệ thống kiến thức Hóa học lớp 8 Học kì 2
Hệ thống kiến thức Hóa học lớp 8 Học kì 2 chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hoá học 11 Học kì 2. Mời các bạn cùng đón xem:
[Năm 2023] Hệ thống kiến thức Hóa học lớp 8 Học kì 2
CHƯƠNG 4: OXI-KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI
1. Tính chất vật lí
Là chất khí, không màu, không mùi, ít tan trong nước, nặng hơn không khí. Oxi hóa lỏng ở nhiệt độ -183oC, oxi ở thể lỏng có màu xanh nhạt.
2. Tính chất hóa học
Oxi là một đơn chất phi kim hoạt động mạnh, đặc biệt là ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất.
a. Tác dụng với phi kim (S, N, P…)
S + O2 SO2 (cháy sáng ngọn lửa màu xanh nhạt)
b. Tác dụng với kim loại
Oxi có thể tác dụng với hầu hết các kim loại dưới tác dụng của nhiệt độ để tạo ra các oxit (trừ một số kim loại Au, Ag, Pt oxi không phản ứng
2Mg + O2 2MgO
2Zn + O2 2ZnO
c. Tác dụng với hợp chất
2H2S + 3O2 2SO2 + 2H2O
II. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI
1. Sự oxi hóa
Là sự tác dụng của oxi với một chất
2. Phản ứng hóa hợp
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Phản ứng cần nâng nhiệt độ lên để khơi mào phản ứng lúc đầu, các chất sẽ cháy, tỏa nhiều nhiệt gọi là phản ứng tỏa nhiệt.
III. OXIT
1. Định nghĩa
Oxit là hợp chất của ha nguyên tố , trong đó có một nguyên tố là oxi
2. Phân loại:
a. Oxit axit:
Thường là oxit của phi kim và tương ứng với một axit
Vd: SO3 tương ứng với axit H2SO4
b. Oxit bazơ
Thường là oxit của kim loại và tương ứng với một bazơ
NaO tương ứng với NaOH
3. Cách gọi tên:
Tên oxit = tên nguyên tố + oxit
- Nếu kim loại có nhiều hóa trị
Tên oxit = tên kim loại (hóa trị) + oxit
VD: FeO: sắt (II) oxit
- Nếu phi kim có nhiều hóa trị
Tên gọi = tên phi kim + oxit
Dùng các tiền tố ( tiếp đầu ngữ) chỉ số nguyên tử
+ Mono: một
+ Đi: hai
+ Tri: ba
+ Tetra: bốn
+ Penta: năm
VD: CO: cacbon monooxit
IV. Điều chế khí oxi - Phản ứng phân hủy
1. Điều chế oxi
a. Trong phòng thí nghiệm
Đun nóng hợp chất giâu oxi và dễ bị phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm, oxi thoát ra theo
2KMnO4 K2MnO4 + MnO2 + O2
2KClO3 2KCl + 3O2
b. Trong công nghiệp
- Sản xuất từ không khí: hóa lỏng không khí ở nhiệt độ thấp và áp suất cao. Trước hết thu được Nitơ (-196°C) sau đó là Oxi (- 183°C)
- Sản xuất từ nước: điện phân nước
2. Phản ứng phân hủy
Là phản ứng hóa học trong đó từ môtj chất sinh ra nhiều chất mới.
VD: 2KMnO4 K2MnO4 + MnO2 + O2
V. KHÔNG KHÍ - SỰ CHÁY
1. Không khí
Không khí là một hỗn hợp khí trong đó oxi chiếm khoảng 1/5 thể tích. Cự thể oxi chiếm 21% thể tích, 78% nitơ, 1% là các khí khác
2. Sự cháy và sự oxi hóa chậm
- Sự cháy là sự oxi hóa có tỏa nhiệt và phát sáng
- Sự oxi hóa chậm là sự oxi hóa có tỏa nhiệt nhưng không phát sáng
- Trong điều kiện nhất định, sựu oxi hóa chậm có thể chuyển thành sự cháy
CHƯƠNG 5: HIDRO - NƯỚC
I. Tính chất - Ứng dụng của Hiđro
1. Tính chất vật lý
Là chất khí không màu, không mùi, không vị, nhẹ nhất trong các khí, tan rất ít trong nước
2. Tính chất hóa học
a. Tác dụng với oxi
2H2 + O2 2H2O
Hỗn hợp sẽ gây nổ nếu trộng hidrơ và oxi theo tỉ lệ thể tích 2:1
b. Tác dụng với đồng oxit CuO
Bột CuO màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và có những giọt nước tạo thành trên thành cốc
H2 + CuO Cu +H2O
II. Điều chế khí Hiđro - Phản ứng thế
1. Điều chế hidro
a. Trong phòng thí nghiệm
Cho kim loại (Al, Fe,….) tác dụng với dung dịch axit (HCl, H2SO4)
VD: Fe + 2HCl → FeCl2 + H2
b. Trong công nghiệp
Hidro được điều chế bằng cách điện phân nước hoặc dùng than khử oxi của H2O
PT: 2H2O 2H2 + O2
2. Phản ứng thế
Phản ứng thế là phản ứng hóa học của đơn chất và hợp chất trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất
VD: Fe + 2HCl → FeCl2 + H2
III. Nước
1. Tính chất vật lý
Là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị. sôi ở 100°C (p = 760 mmHg), hóa rắn ở 0°C.
Có thể hòa tan được nhiều chất rắn (muối ăn, đường,…), chất lỏng (cồn, axit), chất khí (HCl,…)
2. Tính chất hóa học
Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
Tác dụng với mốt số oxit bazo như CaO, K2O,… tạo ra bazơ tương ứng Ca(OH)2, KOH,…
Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
IV. Axit - Bazơ - Muối
1. Axit
a. Khái niệm
Phân tử axit gồm có một hay nhiều nguyên tử hihdro liên kết với gốc axit, các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại
b. CTHH: gồm một hay nhiều nguyên tử H và gốc axit
c. Phân loại: 2 loại
- Axit không có oxi: HCl, H2S,…
- Axit có oxi: H2SO4, H2CO3,…
d. Tên gọi
- Axit không có oxi
Tên axit = axit + tên phi kim + hidric
VD: HCl: axit clohidric. Gốc axit tương ứng là clorua
- Axit có oxi
+ Axit có nhiều oxi:
Tên axit = axit + tên phi kim + ic
VD: H2SO4 : axit sunfuric. Gốc axit: sunfat
+ Axit có ít oxi:
Tên axit = axit + tên phi kim + ơ
VD: H2SO3 : axit sunfuro. Gốc axit sunfit
2. Bazơ
a. Khai niệm:
Phân tử bazơ gồm có môt nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH).
b. CTHH: M(OH)n, n: số hóa trị của kim loại
c. Tên gọi:
Tên bazơ = tên kim loại ( kèm hóa trị nếu có nhiều hóa trị) + hiđroxit
VD: Fe(OH)2: sắt (II) hidroxit
d. Phân loại
Bazơ tan trong nước gọi là kiềm. VD: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ không tan trong nước. VD: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
3. Muối
a. Khái niệm
Phân tử muối có một hay nhiều nguyên tử kim loại liên kết với môht hay nhiều gốc axit
b. CTHH: gồm 2 phần: kim loại và gốc axit
VD: Na2SO4, CaCO3,…
c. Tên gọi
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4 : natri sunfat
d. Phân loại
- Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hiđro có thể thay thế bằng các nguyên tử kim loại
VD: Na2SO4, CaCO3,…
- Muối axit: là muối trong đó gốc axit còn nguyên tử hiđro H chưa được thay thế bằng nguyên tử kim loại. Hóa trị của gốc axit bằng số nguyên tử hidro đã được thay thế bằng các nguyên tử kim loại.
VD: NaHSO4, NaHS, NaHSO3,…
CHƯƠNG 6: DUNG DỊCH
I. Dung môi – chất tan – dung dịch
Dung môi là chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Chất tan là chất bị hòa tan trong dung môi.
Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
II. Dung dịch chưa bão hòa. Dung dịch bão hòa
Ở một nhiệt độ xác định:
- Dung dịch chưa bão hòa là dung dịch có thể hòa thêm chất tan
- Dung dịch bão hòa là dung dịch không thể hòa thêm chất tan
III. Độ tan của một chất trong nước
Độ tan (kí hiệu S) của một chất trong nước là số gam chất đó hòa tan trong 100g nước để tạo thành dung dịch bão hòa ở nhiệt độ xác định.
Công thức tính:
Trong đó
V. NỒNG ĐỘ DUNG DỊCH
1. Nồng độ phần trăm
Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho ta biết số gam chất tan trong 100g dung dịch
CT:
2. Nồng độ mol dung dich
Nồng độ mol (kí hiệu CM) của dung dịch cho biết số mol chất tan trong 1 lit dung dịch
Ví dụ 1: Hòa tan 15 gam muối vào 50 gam nước. Tình nồng độ phần trăm của dung dịch thu được:
Hướng dẫn giải:
Ta có: mdd = mdm + mct = 50 + 15 = 65 gam
Áp dụng công thức:
Ví dụ 2: Người ta hòa tan 40 gam muối và nước được dung dịch có nồng độ 20%.
a) Tính khối lượng dung dịch nước muối thu được.
b) Tính khối lượng nước cần dùng cho sự pha chế trên.
Hướng dẫn giải:
a) Khối lượng dung dịch nước muối thu được là:
c) khối lượng nước cần dùng cho sự pha chế trên là:
m dd - m ct = 200 - 40 = 160 gam
Ví dụ 3: Tính nồng độ mol của dung dịch khi 0,5 lit dung dịch CuSO4 chứa 100 gam CuSO4
Hướng dẫn giải:
Số mol của CuSO4 = 100 : 160 = 0,625 mol
Nồng độ mol của dung dịch CuSO4 = 0,625 : 0,5 = 1,25M
Ví dụ 4: Tính khối lượng H2SO4 có trong 100 ml dung dịch H2SO4 2M
Hướng dẫn giải:
Số mol của H2SO4 là = 0,1 x 2 = 0,2 mol
Khối lượng của H2SO4 = 0,2 x 98 = 19,6 gam
Ví dụ 5: Trộn 200 ml dung dịch H2SO4 4M vào 4 lít dung dịch H2SO4 0,25M. Nồng độ mol của dung dịch mới là
Hướng dẫn giải:
Số mol H2SO4 2 lít dung dịch H2SO4 4M là
0,2 : 4 = 0,8 mol
Số mol H2SO4 4 lít dung dịch H2SO4 0,25M là
4 : 0,25 = 1 mol
Thể tích sau khi trộn dung dịch là: 4 + 0,2 = 4,2 lít
Nồng độ mol của dung dịch mới là: ( 0,8 + 1) : 4,2 = 0,43M
Đề thi Hoá học lớp 8 Học kì 2 năm 2022 - 2023 có đáp án
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Hoá học lớp 8 Học kì 2 năm 2022 - 2023 có đáp án đề số 1
Câu 1: Hoàn thành PTHH
1/ Fe + O2
2/ KClO3
3/ CH4 + O2
4/ P2O5 + H2O →
5/ K + H2O →
6/ Na2O + H2O →
Hướng dẫn giải
1/ 3Fe + 2O2 Fe3O4
2/ 2KClO3 2KCl + 3O2
3/ CH4 + 2O2 CO2 + 2H2O
4/ P2O5 + 3H2O → 2H3PO4
5/ 2K + 2H2O → 2KOH + H2
6/ Na2O + H2O → 2NaOH
Câu 2: Phân loại oxit, axit, bazơ, muối trong các hợp chất sau: Fe(OH)3, HNO3, Na2S, Al2O3
Hướng dẫn giải
Ta có:
+ Oxit: Al2O3
+ Axit: HNO3
+ Bazơ: Fe(OH)3
+ Muối: Na2S
Câu 3: Cho biết hiện tượng và viết PTHH khi đốt bột photpho đỏ trong bình khí oxi?
Hướng dẫn giải
+ Hiện tượng: Photpho cháy mạnh trong khí oxi với ngọn lửa sáng chói, tạo ra khói trắng dày đặc bám vào thành bình.
+ Phương trình hóa học: 4P + 5O2 2P2O5
Câu 4: Bằng phương pháp hóa học hãy nhận biết các chất lỏng có trong các lọ mất nhãn: Dung dịch H2SO4, dung dịch NaOH, dung dịch NaCl, nước.
Hướng dẫn giải
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho quỳ tím vào các mẫu thử, nếu:
+ Qùy tím hóa đỏ là H2SO4
+ Qùy tím hóa xanh là NaOH
+ Qùy tím không đổi màu là: NaCl và nước (nhóm I)
- Đun 2 ống nghiệm nhóm I trên ngọn lửa đèn cồn.
+ Chất trong ống nghiệm bay hơi hết, được ống nghiệm sạch → mẫu thử là nước.
+ Sau khi nước bay hơi hết, thu được chất rắn trắng bám đáy ống nghiệm → mẫu thử là NaCl.
Câu 5: Tính số gam đường và số gam nước có trong 50 gam dung dịch nước đường nồng độ 20%.
Hướng dẫn giải
+ Ta có khối lượng đường có trong dung dịch:
mđường =
+ Số gam nước có trong dung dịch:
mnước = mdd – mđường = 50 – 10 = 40 gam.
Câu 6: Cho a gam kẽm tác dụng hoàn toàn với dd HCl, phản ứng tạo ra kẽm clorua (ZnCl2) và 3,36 lít khí hiđro (đktc).
a/ Tính a gam?
b/ Tính khối lượng HCl đã phản ứng?
c) Sau phản ứng thu được bao nhiêu gam khí hiđro?
đ) Lượng khí hidro ở trên được dùng để khử 16 gam CuO ở nhiệt độ cao. Tính khối lượng đồng thu được?
Hướng dẫn giải
a/ Số mol H2 là: mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: nZn = 0,15 mol
Vậy a = mZn = 0,15.65 = 9,75 gam
b/ Phương trình phản ứng:
Ta có: nHCl = 0,3 mol
Vậy khối lượng HCl đã phản ứng là:
mHCl = 0,3.36,5 = 10,95 gam.
c/ Số mol H2 là: mol
Suy ra = 0,15.2 = 0,3 gam
d/ Số mol của CuO là: nCuO = 0,2 mol
Phương trình phản ứng:
H2 + CuO Cu + H2O
Xét tỉ lệ:
Suy ra H2 phản ứng hết, CuO dư
Theo phương trình phản ứng: nCu = 0,15 mol
Suy ra mCu = 0,15.64 = 9,6 gam.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Hoá học lớp 8 Học kì 2 năm 2022 - 2023 có đáp án đề số 2
I. TRẮC NGHIỆM (4,0đ) Chọn ý đúng A hoặc B, C, D ghi vào bảng sau :
Câu 1. Chất nào sau đây không phải là oxit bazơ:
A. MgO.
B. Mn2O7.
C. FeO.
D. CuO.
Hướng dẫn giải
Đáp án đúng: B
+ Oxit bazơ là oxit của kim loại và tương ứng với một bazơ.
+ Chất không phải là oxit bazơ: Mn2O7 (do tương ứng với axit HMnO4).
Câu 2. Ở nhiệt độ thường, nước tác dụng được với dãy chất:
A. K, Na2O, Fe, ZnO.
B. CuO, Zn, K2O, CO2.
C. Ba, Fe2O3, Al, SO2.
D. K, Na, CaO, P2O5.
Hướng dẫn giải
Đáp án đúng: D
Ở nhiệt độ thường, nước tác dụng được với dãy chất: K, Na, CaO, P2O5.
2K + 2H2O → 2KOH + H2
2Na + 2H2O → 2NaOH + H2
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
Câu 3. Dung dịch là hỗn hợp
A. của chất khí trong chất lỏng.
B. của chất rắn trong chất lỏng.
C. đồng nhất của dung môi và chất tan.
D. đồng nhất của chất rắn trong chất lỏng.
Hướng dẫn giải
Đáp án đúng: C
Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
Câu 4. Khi nhiệt độ tăng thì độ tan của chất rắn trong nước:
A. Phần lớn là tăng.
B. Phần lớn là giảm.
C. Đều giảm.
D. Đều tăng.
Hướng dẫn giải
Đáp án đúng: A
Khi nhiệt độ tăng thì độ tan của chất rắn trong nước: Phần lớn là tăng.
Câu 5. Cho các phương trình hóa học sau:
a. H2 + ZnO Zn + H2O
b. S + O2 SO2
c. 2HgO 2Hg + O2
d. Ca(HCO3)2 CaCO3 + CO2 + H2O
Phương trình thuộc loại phản ứng phân hủy:
A. a, b.
B. b, c.
C. c, d.
D. a, d.
Hướng dẫn giải
Đáp án đúng: C
+ Phản ứng phân hủy là phản ứng hóa học trong đó từ một chất sinh ra hai hay nhiều chất mới.
+ Phương trình thuộc loại phản ứng phân hủy:
c. 2HgO 2Hg + O2
d. Ca(HCO3)2 CaCO3 + CO2 + H2O
Câu 6. Có 3 dd mất nhãn: HCl, NaCl, NaOH. Dùng thuốc thử nào để nhận biết 3 dung dịch?
A. Fe.
B. Cu.
C. H2O.
D. Quỳ tím.
Hướng dẫn giải
Đáp án đúng: D
- Trích mẫu thử và đánh số thứ tự
- Cho quỳ tím vào lần lượt các dung dịch HCl, NaCl, NaOH nếu:
+ Qùy tím chuyển sang đỏ thì đó là dung dịch HCl
+ Qùy tím chuyển sang xanh là NaOH
+ Qùy tím không đổi màu là NaCl.
Câu 7. Nguyên liệu điều chế khí oxi trong phòng thí nghiệm:
A. KMnO4, KClO3.
B. KClO3, H2O.
C. KMnO4, Không khí.
D. Nước, Không khí.
Hướng dẫn giải
Đáp án đúng: A
Nguyên liệu điều chế khí oxi trong phòng thí nghiệm: KMnO4, KClO3.
2KMnO4 K2MnO4 + MnO2 + O2
2KClO3 2KCl + 3O2
Câu 8. Ở 100 C, hòa tan 4g NaCl vào 25g nước. Độ tan của NaCl ở nhiệt độ trên là
A. 13,8g.
B. 16g.
C. 21g.
D. 25g.
Hướng dẫn giải
Đáp án đúng: B
Độ tan của một chất là số gam chất đó hòa tan được trong 100 gam nước đề tạo thành dung dịch bão hòa ở nhiệt độ xác định
Vậy độ tan của NaCl trong 100 gam nước là: = 16 gam
II. TỰ LUẬN (6,0đ)
Câu 9 (1,0đ). Phân loại và đánh dấu X vào ô chỉ hợp chất oxit, axit, bazơ, muối:
|
|
NaOH |
CO2 |
H2SO3 |
Na2SO4 |
|
Oxit |
|
|
|
|
|
Axit |
|
|
|
|
|
Bazơ |
|
|
|
|
|
Muối |
|
|
|
|
Hướng dẫn giải
|
|
NaOH |
CO2 |
H2SO3 |
Na2SO4 |
|
Oxit |
|
× |
|
|
|
Axit |
|
|
× |
|
|
Bazơ |
× |
|
|
|
|
Muối |
|
|
|
× |
Câu 10 (2,0đ). Hoàn thành các phương trình hóa học sau:
a. Cu + ? CuO.
b. KClO3 KCl + ?.
c. ? + H2O → Ca(OH)2 + ?.
d. H2 + Fe3O4 ? + ?.
Hướng dẫn giải
a. 2Cu + O2 2CuO.
b. 2KClO3 2KCl + 3O2
c. Ca + 2H2O → Ca(OH)2 + H2
d. 4H2 + Fe3O4 3Fe + 4H2O
Câu 11 (2,0đ). Cho 7,2g magie vào dung dịch HCl thu được magie clorua (MgCl2) và khí hiđro.
a. Tính thể tích khí hiđro sinh ra (đktc).
b. Nếu cho lượng kim loại trên vào 200g dung dịch HCl. Tính nồng độ phần trăm của dung dịch sau phản ứng. (Mg = 24; H = 1; Cl = 35,5)
Hướng dẫn giải
a. Số mol Mg là: nMg = = 0,3 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,3 mol
Vậy thể tích khí hiđro sinh ra (đktc) là:
= 0,3.22,4 = 6,72 lít.
b. Phương trình phản ứng:
Có = 0,3 mol suy ra
= 0,3.95 = 28,5 gam
Khối lượng dung dịch MgCl2:
= mMg + mddHCl -
= 7,2 + 200 – 0,3.2 = 206,6 gam
Nồng độ phần trăm của đung dịch MgCl2:
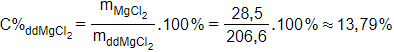
Câu 12 (1,0đ). Hòa tan 11,7g Kim loại A (chưa rõ hóa trị) vào nước dư thu được 3,36 lít H2 (đktc). Tìm kim loại A? (Ba = 137, Na = 23, K = 39, Ca = 40)
Hướng dẫn giải
Số mol của H2: = 0,15 mol
Gọi nguyên tử khối của kim loại A là A, hóa trị A là n.
Phương trình hóa học: A + nH2O A(OH)n + H2.
Theo phương trình: 1 mol mol
Theo đề: mol 0,15 mol
Ta có: = 39n
|
n |
1 |
2 |
3 |
|
MA |
39 (nhận) |
78 (loại) |
117 (loại) |
Chọn n = 1, MA = 39
Vậy A là kali.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Hoá học lớp 8 Học kì 2 năm 2022 - 2023 có đáp án đề số 3
I. TRẮC NGHIỆM (0,25 điểm/1 câu)
Câu 1. Công thức bazơ tương ứng của FeO là
A. Fe(OH)3.
B. Fe(OH)2.
C. Fe(OH)4.
D. FeOH.
Hướng dẫn giải
Đáp án đúng là: B
Công thức bazơ tương ứng của FeO là: Fe(OH)2.
Câu 2. Để điều chế khí hiđro trong phòng thí nghiệm, ta có thể dùng kim loại kẽm tác dụng với:
A. CuSO4 hoặc HCl loãng.
B. H2SO4 loãng hoặc HCl loãng.
C. Fe2O3 hoặc CuO.
D. KClO3 hoặc KMnO4.
Hướng dẫn giải
Đáp án đúng là: B
Để điều chế khí hiđro trong phòng thí nghiệm, ta có thể dùng kim loại kẽm tác dụng với: H2SO4 loãng hoặc HCl loãng.
Phương trình hóa học:
Zn + H2SO4 → ZnSO4 + H2↑
Zn + 2HCl → ZnCl2 + H2↑
Câu 3. Điều khẳng định nào sau đây là đúng, không khí là:
A. Một chất.
B. Một đơn chất.
C. Một hợp chất.
D. Một hỗn hợp.
Hướng dẫn giải
Đáp án đúng là: D
Không khí là một hỗn hợp gồm các khí O2, N2, CO2 ....
Câu 4. Hòa tan 5,6 gam KOH trong 94,4 gam H2O thì thu được dung dịch có nồng độ là
A. 5,6%.
B. 5,9%.
C. 94,4%.
D. 44,5%.
Hướng dẫn giải
Đáp án đúng là: A
Có: mdd = 94,4 + 5,6 = 100 (g)
![]()
Câu 5. Để thu khí hidro bằng cách đẩy không khí có hiệu quả nhất ta phải đặt ống nghiệm thu khí như thế nào?
A. Ngửa ống nghiệm.
B. Úp ống nghiệm.
C. Đặt ống nghiệm ngang.
D. Bất kì tư thế nào.
Hướng dẫn giải
Đáp án đúng là: B
Để thu khí hidro bằng cách đẩy không khí có hiệu quả nhất ta phải đặt úp ống nghiệm vì khí H2 nhẹ hơn không khí ( = 2 g/mol < MKK = 29 g/mol).
Câu 6. Oxit nào dưới đây góp nhiều phần nhất vào sự hình thành mưa axit?
A. CO2.
B. CO.
C. SO2.
D. SnO2.
Hướng dẫn giải
Đáp án đúng là: C
Trong các oxit trên, oxit góp nhiều phần nhất vào sự hình thành mưa axit là: SO2.
Câu 7. Muối nào sau đây là muối axit
A. MgCl2.
B. NH4Cl.
C. KHSO4.
D. Cu(NO3)2.
Hướng dẫn giải
Đáp án đúng là: C
Muối axit là muối mà gốc axit vẫn còn hiđro.
Vậy KHSO4 là muối axit.
Câu 8. Phân hủy m gam KMnO4, thu được 3,36 lít O2 (đktc). Giá trị của m là?
A. 47,4.
B. 27,3.
C. 23,7.
D. 44,7.
Hướng dẫn giải
Đáp án đúng là: A
Số mol O2 là: mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,3 mol
Vậy m = 0,3.158 = 47,4 gam
Câu 9. Dẫn khí H2 dư qua ống nghiệm đựng CuO nung nóng. Sau thí nghiệm, hiện tượng quan sát được là:
A. Có tạo thành chất rắn màu đen vàng, có hơi nước tạo thành.
B. Có tạo thành chất rắn màu đen nâu, không có hơi nước tạo thành.
C. Có tạo thành chất rắn màu đỏ, có hơi nước bám ở thành ống nghiệm.
D. Có tạo thành chất rắn màu đỏ, không có hơi nước bám ở thành ống nghiệm.
Hướng dẫn giải
Đáp án đúng là: C
Dẫn khí H2 dư qua ống nghiệm đựng CuO nung nóng. Sau thí nghiệm, hiện tượng quan sát được là: Có tạo thành chất rắn màu đỏ, có hơi nước bám ở thành ống nghiệm.
Phương trình phản ứng:
CuO (đen) + H2 Cu (đỏ) + H2O
Câu 10. Ở nhiệt độ 18oC, khi hòa tan hết 53 gam Na2CO3 vào 250 gam nước thì thu được dung dịch bão hòa. Vậy độ tan của muối Na2CO3 trong nước ở nhiệt độ này là?
A. 53 gam.
B. 21,2 gam.
C. 25 gam.
D. 32,7 gam.
Hướng dẫn giải
Đáp án đúng là: B
Ở nhiệt độ 18oC 250g nước hòa tan 53g Na2CO3 để tạo dung dịch bão hòa.
Vậy ở nhiệt độ 18oC, 100g nước hòa tan S g Na2CO3 tạo dung dịch bão hòa.
= 21,2 g Na2CO3
Theo định nghĩa về độ tan, ta có độ tan của Na2CO3 ở 18oC là 21,2g.
Câu 11. P2O5 có axit tương ứng là
A. HP2O5.
B. H2PO2.
C. H2PO3.
D. H3PO4.
Hướng dẫn giải
Đáp án đúng là: D
P2O5 có axit tương ứng là H3PO4.
P2O5 + 3H2O → 2H3PO4.
Câu 12. Dẫn khí sinh ra khi cho Al tác dụng với dung dịch HCl qua bình đựng CuO, nung nóng. Sau khi phản ứng xảy ra hoàn toàn, chất rắn trong bình là?
A. Chỉ có CuO.
B. Chỉ có Cu.
C. AlCl3.
D. Cu và CuO có thể còn dư.
Hướng dẫn giải
Đáp án đúng là: B
2Al + 6HCl → 2AlCl3 + 3H2
H2 + CuO Cu + H2O
Câu 13. Đốt cháy 5,625 kg than chứa 20% tạp chất trơ không cháy thì thể tích khí oxi cần dùng (đktc) là?
A. 8,4 m3.
B. 5,6 m3.
C.10,5m3.
D. 2,1 m3.
Hướng dẫn giải
Đáp án đúng là: A
![]()
Suy ra nC = = 375 mol
Phương trình hóa học:
Suy ra = 375 mol
Vậy thể tích khí oxi cần dùng (đktc) là:
= 375.22,4 = 8400 lít = 8,4 m3.
Câu 14. Kim loại nào sau đây phản ứng với nước ở nhiệt độ thường
A. Cu.
B. Fe.
C. Al.
D. Ba.
Hướng dẫn giải
Đáp án đúng là: D.
Ba + 2H2O → Ba(OH)2 + H2
Câu 15. Cho bảng sau:
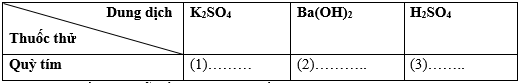
Hiện tượng điền vào chỗ trống (1), (2), (3) lần lượt là:
A. (1) không đổi màu, (2) hóa đỏ, (3) hóa xanh.
B. (1) hóa đỏ, (2) hóa xanh, (3) không đổi màu.
C. (1) không đổi màu, (2) hóa xanh, (3) hóa đỏ.
D. (1) hóa đỏ, (2) không đổi màu, (3) hóa xanh.
Hướng dẫn giải
Đáp án đúng là: C
Khi cho quỳ tím lần lượt vào K2SO4 (1), Ba(OH)2 (2), H2SO4(3) thì xảy ra các hiện tượng lần lượt là: (1) không đổi màu, (2) hóa xanh, (3) hóa đỏ.
Câu 16. Trường hợp tạo thành dung dịch là
A. Trộn 1 lít nước vào 2 lít xăng.
B. Trộn 1 lít xăng vào 0,5 lít dầu.
C. Trộn 1 lít dầu vào 2 lít nước.
D. Tất cả đều sai.
Hướng dẫn giải
Đáp án đúng là: B
Trường hợp tạo thành dung dịch là trộn 1 lít xăng vào 0,5 lít dầu.
Trường hợp A và C không tạo thành dung dịch do xăng và dầu không tan trong nước.
II. TỰ LUẬN
Câu 1. (2 điểm) Hoàn thành các phương trình phản ứng sau, cho biết chúng thuộc loại phản ứng nào?
a) Fe2O3 + ? → Fe + ?
b) KClO3 → ? + ?
c) K + H2O → ? + ?
d) Al + H2SO4 loãng → ? + ?
Hướng dẫn giải
a) Fe2O3 + 3CO → 2Fe + 3CO2
Thuộc loại phản ứng oxi hóa khử.
b) 2KClO3 2KCl + 3O2
Thuộc loại phản ứng phân hủy.
c) 2K + 2H2O → 2KOH + H2
Thuộc loại phản ứng thế.
d) 2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2
Thuộc loại phản ứng thế.
Câu 2. (2 điểm) Hoàn thành bảng sau:
|
Công thức hóa học |
Tên gọi |
Phân loại |
|
P2O5 |
|
|
|
|
Bari nitrat |
|
|
Na2CO3 |
|
|
|
|
Canxi sunfit |
|
|
|
Natri hiđrophotphat |
|
|
CO2 |
|
|
|
Fe(OH)3 |
|
|
|
|
|
Axit |
Hướng dẫn giải
|
Công thức hóa học |
Tên gọi |
Phân loại |
|
P2O5 |
Điphotpho pentaoxit |
Oxit axit |
|
Ba(NO3)2 |
Bari nitrat |
Muối |
|
Na2CO3 |
Natri cacbonat |
Muối |
|
CaSO3 |
Canxi sunfit |
Muối |
|
Na2HPO4 |
Natri hiđrophotphat |
Muối |
|
CO2 |
Cacbon đioxit |
Oxit axit |
|
Fe(OH)3 |
Sắt(III) hiđroxit |
Bazơ |
|
HCl |
Axit clohiđric |
Axit |
Câu 3. (1 điểm) Dẫn khí hiđro đi qua đồng (II) oxit, nung nóng, sau phản ứng thu được 19,2 gam Cu.
a) Viết PTHH xảy ra
b) Tính khối lượng đồng(II) oxit tham gia và thể tích khí hiđro (đktc) cần dùng?
Hướng dẫn giải
a) Phương trình hóa học: H2 + CuO Cu + H2O
b) Số mol Cu là: nCu = = 0,3 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: nCuO = 0,3 mol
Suy ra mCuO = 0,3.80 = 24 gam
Theo phương trình phản ứng = 0,3 mol
Suy ra thể tích khí hiđro (đktc) cần dùng là:
= 0,3.22,4 = 6,72 lít.
Câu 4. (1 điểm) Hòa tan hết 12,8 gam hỗn hợp gồm Mg và MgO cần dùng 400ml dung dịch HCl 2M.
a) Tính phần trăm theo khối lượng mỗi chất trong hỗn hợp ban đầu
b) Để đốt cháy toàn bộ lượng khí H2 sinh ra ở phản ứng trên thì cần dùng bao nhiêu lít không khí (đktc) (biết oxi chiếm 20% không khí)
Hướng dẫn giải
a) Số mol của HCl là: nHCl = 0,8 mol
Gọi x, y lần lượt là số mol của Mg và MgO ta có: 24x + 40y = 12,8 (1)
Phương trình phản ứng:
Từ 2 phương trình trên suy ra 2x + 2y = 0,8 (2)
Từ (1) và (2) suy ra x = 0,2; y = 0,2 mol
Vậy = 37,5%
%mMgO = 100% - 37,5% = 62,5%
b) Phương trình hóa học:
Theo phương trình phản ứng ta có:
= 0,2 mol
Số mol O2 là: = 0,1 mol
Oxi chiếm 20% không khí hay = 20%nKK suy ra nKK = 0,5 mol
Vậy thể tích không khí (đktc) là: VKK = 0,5.22,4 = 11,2 lít.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Hoá học lớp 8 Học kì 2 năm 2022 - 2023 có đáp án đề số 4
I. PHẦN TRẮC NGHIỆM: ( 3.0 điểm )
Khoanh tròn các chữ cái đứng trước câu trả lời mà em cho là đúng nhất:
Câu 1: Khí oxi tác dụng được với dãy chất:
A. Fe, P, CH4.
B. Cu, Au, C2H4.
C. FeS2, Ag, Zn.
D. Au, S, CO.
Hướng dẫn giải
Đáp án đúng là: A
3Fe + 2O2 Fe3O4
4P + 5O2 2P2O5
CH4 + 2O2 CO2 + 2H2O
Câu 2: Cho các oxit sau: SO3, Na2O, CuO, Fe2O3, P2O5 Những oxit tác dụng được với nước là:
A. SO3, CuO, Fe2O3.
B. SO3, P2O5, Na2O.
C. Na2O, Fe2O3, P2O5.
D. SO3, Na2O, Fe2O3.
Hướng dẫn giải
Đáp án đúng là: B
SO3 + H2O → H2SO4
P2O5 + 3H2O → 2H3PO4
Na2O + H2O → 2NaOH
Câu 3: Cho công thức hoá học của các chất sau: CuO, H2SO4, NaCl, NaOH. Dãy hợp chất nào sau đây lần lượt là oxit, axit, bazơ, muối?
A. CuO, H2SO4, NaOH, NaCl.
B. NaOH, CuO, NaCl, H2SO4.
C. CuO, NaOH, H2SO4, NaCl.
D. CuO, H2SO4, NaCl, NaOH.
Hướng dẫn giải
Đáp án đúng là: A
Dãy hợp chất lần lượt là oxit, axit, bazơ, muối: CuO, H2SO4, NaOH, NaCl.
Câu 4: Cho mẫu nhỏ Natri vào cốc đựng nước, hiện tượng xảy ra là
A. Natri nổi lên mặt nước.
B. Xuất hiện kết tủa xanh.
C. Natri tan dần, có khí không màu thoát ra.
D. Natri tan, có khí mùi hắc thoát ra.
Hướng dẫn giải
Đáp án đúng là: C
Cho mẫu nhỏ Natri vào cốc đựng nước, hiện tượng xảy ra là: Natri tan dần, có khí không màu thoát ra.
Phương trình phản ứng:
2Na + 2H2O → 2NaOH + H2
Câu 5: Đốt cháy hoàn toàn 5 ml khí hiđro trong bình chứa 5 ml khí oxi. Thể tích hơi nước thu được sau phản ứng là (biết rằng thể tích các khí đo cùng điều kiện):
A. 2,5 ml.
B. 5 ml.
C. 7,5 ml.
D. 10 ml.
Hướng dẫn giải
Đáp án đúng là: B
Phương trình phản ứng:
2H2 + O2 2H2O
Theo phương trình phản ứng ta có:
suy ra
Mà = 5 ml, = 5 ml
Suy ra dư.
Theo phương trình phản ứng:
Vậy = 5 ml
Chú ý: Với các chất ở cùng điều kiện, tỉ lệ về thể tích cũng là tỉ lệ về số mol.
Câu 6: Phản ứng nào sau đây là phản ứng hóa hợp?
A. 3CO + Fe2O3 3CO2 + 2Fe
B. Zn + 2HCl → ZnCl2 + H2
C. 2H2 + O2 2H2O
D. 2KClO3 2KCl + 3O2
Hướng dẫn giải
Đáp án đúng là: C
+ Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới (sản phẩm) được tạo thành từ hai hay nhiều chất ban đầu.
+ Phản ứng hóa hợp: 2H2 + O2 2H2O
II. PHẦN TỰ LUẬN: (7.0 điểm)
Câu 1: (2,5 đ) Em lập phương trình hóa học cho các phản ứng sau:
Al + HCl → ...... + .......
Na2O + H2O → ..........
P + O2 ........
Magie hiđroxit + axit sunfuric → Magie sunfat + nước
Canxi cacbonat + nước + cacbon đioxit → canxi hiđrocacbonat
Hướng dẫn giải
2Al + 6HCl → 2AlCl3 + 3H2
Na2O + H2O → 2NaOH
4P + 5O2 2P2O5
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
CaCO3 + H2O + CO2 → Ca(HCO3)2
Câu 2. (1,5 đ) Bằng phương pháp hóa học, em hãy nhận biết các khí sau: khí cacbonic, khí oxi và khí hiđro.
Hướng dẫn giải
- Dẫn lần lượt các khí qua bình đựng dung dịch Ca(OH)2 dư:
+ Vẩn đục: CO2
Phương trình hóa học:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
+ Không hiện tượng là: O2, H2 (nhóm I)
- Cho que đóm còn tàn đỏ lần lượt vào từng lọ đựng khí ở nhóm I.
+ Que đóm còn tàn đỏ bùng cháy: O2
+Que đóm không bùng cháy: H2
Câu 3. (2.0 đ) Trong phòng thí nghiệm người ta dùng H2 dư để khử hoàn toàn Fe3O4 thu được khí 33,6 gam sắt.
a. Tính khối lượng Fe3O4 đã phản ứng.
b. Tính thể tích H2 đã dùng (ở đktc). Biết rằng người ta đã dùng khí H2 dư 20% so với lý thuyết.
(Fe = 56; O = 16; H = 1)
Hướng dẫn giải
a. Số mol sắt là: nFe = = 0,6 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,2 mol
Vậy khối lượng Fe3O4 đã phản ứng là:
= 0,2.232 = 46,4 gam.
b. Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,8 mol
Thể tích H2 theo lý thuyết (ở đktc) là:
(lý thuyết) = 0,8.22,4 = 17,92 lít.
Do lượng H2 dùng dư 20% nên lượng H2 đã dùng là:
(thực tế) = (lý thuyết) + (dư)
→ (thực tế) =
Câu 4 (1.0 đ)
Em hãy đọc đoạn văn bản sau :
Nước là một vật chất rất quan trọng cho sự sống, được con người sử dụng vào các mục đích sinh hoạt, nông nghiệp, công nghiệp, giao thông, giải trí… Cơ thể con người cần rất nhiều nước để có thể tồn tại. Nước chiếm tới 2/3 trọng lượng cơ thể. Trong điều kiện trời mát mẻ, không mất mồ hôi con người có thể nhịn khát tối đa là 1 tuần, còn trong điều kiện đổ mồ hôi nhiều thì không thể nhịn khát quá 2 ngày. Trong ngành nông nghiệp, nước chiếm tới 80% nhu cầu. Đặc biệt là với những quốc gia trồng lúa nước như Việt Nam thì nước càng quan trọng. Không phải ngẫu nhiên mà ông cha ta đặt nước là yếu tố quan trọng hàng đầu: “Nhất nước, nhì phân, tam cần, tứ giống”. Trong hoạt động công nghiệp cũng cần rất nhiều nước. Cùng với sự gia tăng dân số và sự phát triển của xã hội thì nhu cầu về nước không ngừng gia tăng.
Do có khoảng 2/3 bề mặt trái đất là nước nên một số người nhầm tưởng nước ngọt là tài nguyên vô tận mà quên rằng có đến 97% nước trên thế giới là nước muối, chỉ có 3% là nước ngọt nhưng gần hơn 2/3 lượng nước này tồn tại ở dạng sông băng và các mũ băng ở các cực. Phần còn lại là dạng nước ngầm và chỉ một tỷ lệ nhỏ tồn tại trên mặt đất và trong không khí. Có nghĩa là nước ngọt mà chúng ta sử dụng hàng ngày chỉ chiếm một phần rất nhỏ và không hề vô tận như một số người vẫn thường nghĩ.
Thiếu nước đang là một vấn đề lớn cho thế giới hiện nay. Ở một số nơi trên thế giới đã xuất hiện xung đột vũ trang vì tranh chấp nguồn nước. Vấn đề ngày càng trở nên cấp bách hơn khi con người lại làm ô nhiễm các nguồn nước sẵn có bằng các loại chất thải phát sinh từ hoạt động sinh hoạt, sản xuất nông nghiệp, công nghiệp.
Theo em, có những biện pháp nào giúp bảo vệ nguồn nước ?
Hướng dẫn giải
Theo em, có những biện pháp giúp bảo vệ nguồn nước là:
+ Hạn chế hóa chất tẩy rửa.
+ Hạn chế dùng thuốc trừ sâu hóa học.
+ Không vứt rác bừa bãi xuống ao, hồ, kênh rạch…
+ Phải xử lý nước thải sinh hoạt, nước thải công nghiệp trước khi thải ra môi trường.
+ Tuyên truyền nâng cao ý thức bảo vệ nguồn nước.
Xem thêm các bộ đề thi Hoá học lớp 8 chọn lọc, hay khác:
Hệ thống kiến thức Hóa học lớp 8 Giữa học kì 2
TOP 30 Đề thi Học kì 2 Hoá học lớp 8 năm 2023 có đáp án
Đề cương Học kì 2 Hoá học lớp 8 năm 2023 chi tiết nhất
