Hệ thống kiến thức Hóa học lớp 8 Học kì 1
Hệ thống kiến thức Hóa học lớp 8 Học kì 1 chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 8 Học kì 1. Mời các bạn cùng đón xem:
[Năm 2023] Hệ thống kiến thức Hóa học lớp 8 Học kì 1
CHƯƠNG 1: CHẤT, NGUYÊN TỬ, PHÂN TỬ
I. CHẤT
1. Vật thể và chất:
- Chất là những thứ tạo nên vật thể
- Vật thể:
+ Vật thể tự nhiên: cây, đất đá, quả chuối…
+ Vật thể nhân tạo: con dao, quyển vở…
2. Tính chất của chất:
- Mỗi chất đều có những tính chất đặc trưng( tính chất riêng).
- Tính chất của chất:
+ Tính chất vật lý: màu, mùi, vị, khối lượng riêng, tó, tonc, trạng thái
+ Tính chất hóa học: sự biến đổi chất này thành chất khác
3. Hỗn hợp:Hỗn hợp: là gồm nhiều chất trộn lẫn với nhau: không khí, nước sông…
+ Tính chất của hỗn hợp thay đổi.
+ Tính chất của mỗi chất trong hỗn hợp là không thay đổi.
+ Muốn tách riêng từng chất ra khỏi hỗn hợp phải dựa vào tính chất đặc trưng khác nhau của các chất trong hỗn hợp.
Chất tinh khiết: là chất không có lẫn chất khác: nước cất…
II. NGUYÊN TỬ:
1. Nguyên tử: Là hạt vô cùng nhỏ và trung hòa về điện.
Nguyên tử:
+ Nhân gồm có proton và notron
+ Vỏ: các hạt eclectron
|
Electron(e) |
Proton (p) |
Notron (n) |
|
me = 9,1095.10-31Kg qe = -1,602. 10-19 C qe = 1- |
mp = 1,6726.10-27 Kg = 1đvC qp = +1,602 . 10-19C qp = 1+ qp = qe 1 |
mn = 1,6748. 10-27 Kg = 1 đvC qn = 0
|
=> mp = mn = 1 đvC , => p = e
- Vì me rất nhỏ(không đáng kể) nên mnt tập trung hầu hết ở hạt nhân nguyên tử khối lượng hạt nhân nguyên tử được coi là khối lượng nguyên tử.
- p + e + n = tổng số hạt nguyên tử
2. Lớp electron trong nguyên tử:
a) Trong nguyên tử electron chuyển động rất nhanh xung quanh hạt nhân và sắp xếp thành từng lớp
b) Mô hình cấu tạo nguyên tử 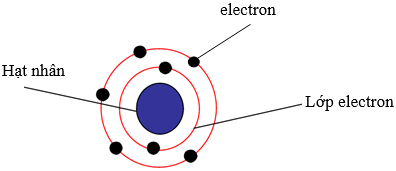
III. NGUYÊN TỐ HÓA HỌC:
1. Định nghĩa: NTHH là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân.
2. Kí hiệu hóa học:
- Kí hiệu hóa học: thường lấy chữ cái đầu (in hoa) tên Latinh, trường hợp nhiều nguyên tố có chữ cái đầu giống nhau thì KHHH của chúng có thêm chữ thứ hai (viết thường).( tr.42)
- Ví dụ: Cacbon: C, Canxi: Ca, Đồng: Cu
- Ý nghĩa của KHHH: Chỉ NTHH đã cho, chỉ một nguyên tử của nguyên tố đó.
- Ví dụ: 2O: Hai nguyên tử Oxi.
3. Nguyên tử khối
- NTK: Là khối lượng của một nguyên tử tính bằng đơn vị Cacbon (đvC)
1đvC = khối lượng của một nguyên tử Cacbon
1đvC = . 1,9926.10-23 = 1,6605.10-24g = 1,6605.10-27 kg
- Ví dụ: NTK C = 12đvC, O = 16 đvC
4. Phân tử: Là hạt đại diện cho chất, gồm một số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất.
5. Phân tử khối: Là khối lượng của phân tử tính bằng đơn vị cacbon, bằng tổng nguyên tử NTK của các nguyên tử trong phân tử.
VD: PTK của H2O= 1.2+16 = 18 đvC
IV. ĐƠN CHẤT – HỢP CHẤT:
1. Đơn chất:
Là những chất được tạo nên từ một NTHH.

2. Hợp chất:
Là những chất được tạo nên từ 2 hay nhiều NTHH (H2O, NaCl, H2SO4)
V. CÔNG THỨC HÓA HỌC:
1. Ý nghĩa của CTHH:
- Những nguyên tố nào tạo thành chất.
- Số nguyên tử của mỗi nguyên tố tạo thành một phân tử chất.
- Phân tử khối của chất.
2. CTHH của đơn chất:
- Kim loại(A): Al, Fe, Cu…
Phi kim:
+ X2: O2, N2, H2…
+ X: S, C, P
3. CTHH của hợp chất: gồm KHHH của những nguyên tố tạo thành phân tử hợp chất, có ghi chỉ số ở chân kí hiệu. (VD: H2O, NaCl, H2SO4) AxBy…
4. CTHH của hợp chất: gồm KHHH của những nguyên tố tạo thành phân tử hợp
chất, có ghi chỉ số ở chân kí hiệu. (VD: H2O, NaCl, H2SO4) AxBy…
VI. HÓA TRỊ:
1. Khái niệm: Hóa trị của một nguyên tố(nhóm nguyên tử) là con số biểu thị khả năng liên kết của nguyên tử nguyên tố đó với nguyên tử nguyên tố khác.( Bảng 1 tr.42).
- Hóa trị được ghi bằng chữ số La Mã và được xác định theo hóa trị của H bằng I. Hóa trị của O bằng II.
- Ví dụ: HCl thì( Cl:I ), NH3 thì( N:III ), K2O thì( K: I ), Al2O3 thì( Al: III ).
1. Quy tắc hóa trị:
Ta có: a.x = b.y hay
2. Áp dụng QTHT:
- Tính hóa trị của một nguyên tố:
+ Ví dụ: Tính hóa trị của Al trong hợp chất Al2O3
Gọi hóa trị của Al là a.
Ta có: => a.2 = II.3 => a=3. Vậy Al (III)
- Lập CTHH của hợp chất theo hóa trị:
- Lập CTHH của sắt oxit, biết Fe(III).
- Lập CTHH của hợp chất gồm Na(I) và SO4(II).
CHƯƠNG 2: PHẢN ỨNG HÓA HỌC
I. SỰ BIẾN ĐỔI CHẤT
1. Hiện tượng vật lí: là hiện tượng chất bị biến đổi về hình dạng hoặc bị biến đổi về trạng thái (rắn, lỏng, khí) nhưng bản chất của chất vẫn không thay đổi (không có sự tạo thành chất mới).
Ví dụ: chặt dây thép thành những đoạn nhỏ, tán thành đinh
2. Hiện tượng hóa học: là hiện tượng có sự biến đổi chất này thành chất khác, nghĩa là có sinh ra chất mới.
Ví dụ: đốt cháy than (cacbon) tạo ra khí cacbonic
II. PHẢN ỨNG HÓA HỌC
- Phản ứng hóa học là quá trình biến đổi chất này (chất phản ứng) thành chất khác (sản phẩm phản ứng)
- Trong phản ứng hóa học, các nguyên tử được bảo toàn, chỉ liên kết giữa các ng.tử bị thay đổi, làm phân tử chất này biến thành phân tử chất khác
Ví dụ: phản ứng xảy ra khi nung vôi: CaCO3 CaO + CO2
Trong đó: Chất pứ: CaCO3
Chất sản phẩm: CaO, CO2
- Dấu hiệu nhận biết có pứ xảy ra: có chất mới tạo thành có tính chất khác với chất pứ (màu, mùi, vị, tỏa nhiệt, phát sáng…)
III. ĐỊNH LUẬT BẢO TOÀN KHỐI LƯỢNG
1. ĐLBTKL: trong một phản ứng hóa học, tổng khối lượng của các chất sp bằng tổng khối lượng của các chất pứ
Áp dụng: A + B → C + D
mA + mB = mC + mD
IV. PHƯƠNG TRÌNH HÓA HỌC:
Phương trình hóa học là sự biểu diễn phản ứng hóa học bằng công thức hóa học
Ví dụ: Phản ứng sắt tác dụng với oxi:
3Fe + 2O2Fe3O4
- Các bước lập PTHH:
+ B1: Viết sơ đồ của pứ: Al + O2 -----> Al2O3
+ B2: Cân bằng số nguyên tử của mỗi nguyên tố: Al + O2-----> 2Al2O3
+ B3: Viết PTHH: 4Al + 3O2 2Al2O3
CHƯƠNG 3: MOL-TÍNH TOÁN HÓA HỌC
I. BÀI TẬP TÍNH THEO CÔNG THỨC HÓA HỌC:
1. Phương pháp giải:
Tính % về khối lượng của nguyên tố trong hợp chất AxBy hoặc AxByCz
Cách giải :
Tìm khối lượng mol phân tử AxBy hoặc AxByCz
Áp dụng công thức:
%A =
2. Bài tập vận dụng :
Bài 1 : Tính thành phần % khối lượng của các nguyên tố trong hợp chất CaCO3
Bài giải
- Tính khối lượng mol: M CaCO3 = 40 + 12 + (16.3)= 100 (gam)
- Thành phần % về khối lượng các nguyên tố:
II. LẬP CÔNG THỨC HÓA HỌC:
1. Phương pháp giải bài toán tính toán theo phương trình hóa học
a. Phương pháp giải:
Bước 1: Viết phương trình phản ứng.
Bước 2: Tính số mol (n) của chất bài ra cho:
+ Nếu bài toán cho khối lượng(m) thì:
+ Nếu bài toán cho thể tích khí V(đktc):
+ Nếu bài toán cho nồng đô mol (CM) và Vdd(l): n = CM . Vdd(l)
+ Nếu bài toán cho nồng đô C% và mdd (g) thì tính như sau:
Tính => Tính
Bước 3: Dựa vào phương trình phản ứng và số mol chất tính được ở bước 2 để tính số mol chất cần tìm theo quy tắc tam suất.
Bước 4: Chuyển số mol đã tìm được ở bước 3 về đại lượng cần tìm.
2. Bài tập vận dụng:
Ví dụ : Cho 2,4 gam Mg tác dụng với axit clohiđric. Tính:
a) Thể tích khí hiđro thu được sau phản ứng(đktc)?
b) Khối lượng axit clohiđric đã tham gia phản ứng?
Hướng dẫn giải
- Số mol của Kẽm là:
- Phương trình hóa học: Mg + 2HCl → ZnCl2 + H2
Theo phương trình: 1 mol 2mol 1 mol
Theo đầu bài: 0,1 mol →0,2 mol → 0,1 mol
Theo phương trình hóa học:
nHCl = 0,2 mol nH2 = 01 mol
- Vậy thể tích khí H2: V = n.22,4 = 0,1 .22,4 = 2,24 lít
- Khối lượng axit clohiđric : m = n.M = 0,2.36,5=7,1 gam
Xem thêm:
Đề thi Hoá học lớp 8 Học kì 1 năm 2022-2023 có đáp án
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
(Đề số 1)
Câu 1: (1 điểm) Đơn chất là gì? Viết công thức hoá học của 2 đơn chất
Câu 2: (1 điểm) Hiện tượng hoá học là gì? Cho ví dụ?
Câu 3: (3 điểm) Lập PTHH của các phản ứng sau:
a. Mg + O2 MgO
b. Fe + Cl2 FeCl3
c. NaOH + CuCl2 Cu(OH)2 + NaCl
d. HCl + Mg MgCl2 + ?
e. Fe2O3 + HCl FeCl3 + H2O
f. Al + O2 Al2O3
Câu 4: ( 2 điểm) Một chất khí A có tỉ khối đối với H2 là 8, có thành phần các nguyên tố gồm: 75% C và 25% H. Hãy lập công thức hoá học của hợp chất A (Biết C = 12 , H = 1)
Câu 5: (3 điểm) Cho 13g kẽm tác dụng với HCl theo sơ đồ phản ứng
Zn + HCl ZnCl2 + H2
a. Lập PTHH của phản ứng.
b. Tính khối lượng HCl đã tham gia phản ứng
c. Tính thể tích khí H2 (ĐKTC) đã sinh ra sau phản ứng
(Biết Zn = 65 , H = 1 , Cl = 35,5. )
ĐÁP ÁN VÀ BIỂU ĐIỂM ĐỀ 1 -HOÁ 8:
|
Câu |
Đáp án |
Điểm |
|
Câu 1
Câu 2
Câu 3
Câu 4
Câu 5
|
- Đơn chất là những chất được tạo nên từ một nguyên tố hoá học. - Ví dụ: Al , N2 (mỗi ví dụ đúng 0,25 đ)
- Hiện tượng chất biến đổi có tạo ra chất mới gọi là hiện tượng hoá học - Ví dụ: đường cháy thành than và nước
Lập đúng các PTHH mỗi PT 0,5 đ a. 2Mg + O2 2MgO b. 2Fe + 3Cl2 2FeCl3 c. 2NaOH + CuCl2 Cu(OH)2 + 2NaCl d. 2HCl + Mg MgCl2 + H2 e. Fe2O3 + 6 HCl 2FeCl3 + 3 H2O f. 4Al + 3O2 2 Al2O3
Ta có: MA = 8 . 2 = 16 (g) m C = 16. 75% = 12 (g) n C = 12 /12 = 1 (mol) m H = 16 – 12 = 4 (g) n H = 4 / 1 = 4 (mol) Công thức hoá học: CH4
a.PTHH: Zn + 2HCl ZnCl2 + H2 nZn = 13: 65 = 0,2 (mol) b.Theo PT: nHCl = 2 nZn = 2. 0,2 = 0,4 mol Vậy mHCl = 0,4 . 36,5 = 14,6(g) c. Theo PTHH: nH2 = nZn = 0,2 mol VH2 (đktc) = 0,2 . 22,4 = 4,48(l ) |
0,5 đ
0,5 đ
0,5 đ
0,5 đ
0,5 đ 0,25 đ 0,25đ 0,25 đ 0,25 đ 0,5 đ
0,5 đ 0,5 đ 0,5đ 0,5 đ 0,5 đ 0,5 đ
|
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
(Đề số 2)
I. TRẮC NGHIỆM ( 3 điểm):
Hãy khoanh tròn vào chữ cái đứng trước câu trả lời đúng:
Câu 1. Hạt nhân nguyên tử cấu tạo bởi:
A. Proton và electron
B. Proton và nơtron
C. Nơtron và electron
D. Proton, nơtron và electron.
Câu 2. Dãy chất gồm các đơn chất:
A. Na, Ca, CuCl2, Br2.
B. Na, Ca, CO, Cl2
C. Cl2, O2, Br2, N2.
Câu 3. Công thức hoá học của hợp chất tạo bởi nguyên tố R với nhóm SO4 là R2(SO4)3. Công thức hoá học của hợp chất tạo bởi nguyên tố R và nguyên tố O là:
A. RO
B. R2O3
C. RO2
D. RO3
Câu 4. Chất khí A có công thức hoá học của A là:
A. SO2
B. CO2
C. NH3
D. N2
Câu 5. Số phân tử của 16 gam khí oxi là:
A. 3.1023
B. 6.1023
C. 9.1023
D. 12.1023
Câu 6. Đôt cháy hết một phân tử hợp chất A( chưa biết) cần 2 phân tử O2 . Sau phản ứng thu được 2 phân tử CO2 và 2 phân tử H2O. Công thức hoá học của hợp chất A là:
A. C2H6
B. C2H4
C. C2H4O
D. C2H4O2
II. PHẦN TỰ LUẬN (7 điểm):
Câu 1. (3 điểm): Hoàn thành các phương trình hoá học sau:
1. Na + O2 Na2O
2. Na3PO4 + BaCl2 NaCl + Ba3(PO4)2
3. Al2O3 + H2SO4 Al2(SO4)3 + H2O
( Cân bằng luôn vào các phản ứng phía trên, không cần viết lại)
Câu 2(3 điểm):Cho a gam nhôm (Al) tác dụng vừa đủ với dung dịch chứa 29,4 gam axit sunfuric ( H2SO4 ). Sau phản ứng thu được muối nhôm sunfat (Al2(SO4)3 ) và khí hiđro ( H2)
a. Viết phương trình hóa học?
b. Tính a gam nhôm đã tham gia phản ứng?
c. Tính thể tích khí hiđro sinh ra ( ở đktc)?
Câu 3 (1điểm): Hợp chất A chứa nguyên tố: Fe và O . Trong phân tử A có 7 nguyên tử và MA=232 (g/mol). Tìm công thức hoá học của A?
(Cho biết : S =32 ; O =16; Al=27; H=1; Fe=56; C=12)
ĐÁP ÁN VÀ BIỂU ĐIỂM ĐỀ 2-HOÁ 8
I.TRẮC NGHIỆM (3 điểm): Mỗi đáp án đúng 0,5đ
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
B |
C |
B |
D |
A |
D |
II. PHẦN TỰ LUẬN (7điểm):
Câu 1 (3đ): Mỗi phản ứng cân bằng đúng 1đ
1. 4Na + O2 2Na2O
2. 2Na3PO4 + 3BaCl2 6NaCl + Ba3(PO4)2
3. Al2O3 + 3H2SO4 Al2(SO4)3 + 3H2O
Câu 2 (3đ):
a. ( 0,5đ) 2Al + 3H2SO4 Al2(SO4)3 + 3H2
b. (1,25đ) Tính được khối lượng a gam nhôm: 5,4( gam)
nH2SO4 = 29,4 / 98 = 0,3 mol
Theo pt: nAl = 2/3 . nH2SO4= 0,3 . 2/3 = 0,2 mol
mAl = 27 . 0,2 = 5,4 g
c. (1,25đ) Tính được thể tích khí H2 sinh ra (đktc): 6,72 ( lít)
Theo pt: nH2 = nH2SO4 =0,3 mol
=>VH2 = 0,3 . 22,4 = 6,72 l
Câu 3 (1đ) Xác định được công thức hoá học của hợp chất A: Fe3O4
Đặt CTHH là FexOy
Theo bài ta có: 56x + 16 y = 232
x + y = 7
Giải hệ => x=3, y=4 => Fe3O4
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
(Đề số 3)
A. Trắc nghiệm (4đ)
Câu 1.Trong các dãy chất sau dãy nào toàn là đơn chất?
A. H2, O2, Na, Al
B. CaO, CO2, ZnO, O2
C. H2NO3, H2CO3, H2SO4.
D. Na2SO4, K2SO4, CaCO3.
Câu 2.Trong các dãy chất sau dãy nào toàn là hợp chất?
A. C, H2, Cl2, CO2.
B. H2, O2, Al , Zn;
C. CO2, CaO, H2O;
D. Br2, HNO3, NH3.
Câu 3. Biết Al có hóa trị (III) và O có hóa trị (II) nhôm oxit có công thức hóa học là:
A. Al2O3
B. Al3O2
C. AlO3
D. Al2O
Câu 4. Quá trình nào sau đây là xảy hiện tượng hóa học:
A. Muối ăn hòa vào nước.
B. Đường cháy thành than và nước
C. Cồn bay hơi
D. Nước dạng rắn sang lỏng
Câu 5. Phân tử khối của hợp chất CaCO3 là:
A. 70 g/mol
B. 80 g/mol
C. 90 g/mol
D.100 g/mol
Câu 6. Hiện tượng nào sau đây là hiện tượng hóa học?
A. Nhôm nung nóng chảy để đúc xoong, nồi…
B. Than cần đập vừa nhỏ trước khi đưa vào bếp lò.
C. Cồn để trong lọ không kín bị bay hơi.
D. Trứng để lâu ngày sẽ bị thối.
Câu 7. Trong công thức hóa học của hiđrô sunfua (H2S) và khí sunfurơ (SO2), hóa trị của lưu huỳnh lần lượt là:
A. I và II
B. II và IV
C. II và VI
D. IV và VI
Câu 8 : Trong quá trình phản ứng, lượng chất phản ứng :
A. Giữ nguyên .
B. Tăng
C. Giảm dần
D. Cả a,b,c.
B. Tự luận (6đ)
Câu 1 (1,5đ): Trong các công thức hoá hoá học sau, công thức nào đúng? Công thức nào sai? Hãy sửa lại công thức sai.
a) NaO
b) CaCl2
c) Al3O2
Câu 2 (1đ): Lập phương trình hoá học và cho biết tỉ lệ số nguyên tử, số phân tử các chất trong phản ứng.
a) Al(OH)3 Al2O3 + H2O
b) Fe + HCl FeCl2 + H2
Câu 3 (3,5đ): Hòa tan hoàn toàn 56g sắt bằng dung dịch axit clohiđric(HCl), phản ứng kết thúc thu được muối sắt clorua ( FeCl2) và khí hiđro.
a. Lập phương trình hóa học.
b. Tính khối lượng axit clohiđric(HCl) đã tham gia phản ứng.
c. Tính thể tích khí hiđro sinh ra ( ở đktc)
ĐÁP ÁN VÀ BIỂU ĐIỂM ĐỀ 3-HOÁ 8
A.Phần trắc nghiệm (5đ)
* Đúng mỗi câu được 0,5đ
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
|
A |
C |
A |
B |
D |
D |
B |
C |
B. Tự luận (5đ)
Câu 1: (1,5đ) Mỗi đáp án đúng 0,5 điểm
CTHH đúng: b) CaCl2
CTHH sai: a) NaO => sửa: Na2O
c) Al3O2 => sửa : Al2O3
Câu 2: (1đ)
a) 2 Al(OH)3 Al2O3 + 3H2O (0,5đ)
Tỉ lệ: nAl(OH)3 : nAl2O3 : nH2O = 2 : 1 : 3
b) Fe + 2HCl FeCl2 + H2 (0,5đ)
Tỉ lệ: nFe : nHCl : nFeCl2 : nH2 = 1 : 2 : 1 : 1
Câu 3: (2,5đ)
- Số mol của 56g sắt là:
nFe = m: M = 56 : 56 = 1 (mol) 0,5 đ
a. Fe + 2HCl FeCl2 + H2 0,5 đ
Theo pt: 1mol 2mol 1mol
Theo bài ra: 1mol 2mol 1mol 0,5 đ
b. Theo pt nHCl = 2.nFe = 2.1= 2mol
Khối lượng axit clohiđric(HCl) đã tham gia phản ứng: 0,5 đ
mHCl = nHCl . MHCl = 2 . 36,5 = 73 (g)
c. Theo pt nH2 = nFe =1mol
Thể tích của hiđro sinh ra là:
VH = nH2. 22,4 = 1 . 22,4 = 224( l) 0,5 đ
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học 8
Thời gian làm bài: 45 phút
(Đề số 4)
A. PHẦN TRẮC NGHIỆM : (3 Điểm)
Câu 1: Số e trong nguyên tử Al (có số proton =13), là:
A. 10
B. 11
C. 12
D. 13.
Câu 2: Số e lớp ngoài cùng của nguyên tử Al (có số proton =13) là:
A. 1
B. 2
C. 3
D. 4.
Câu 3: Số lớp e của nguyên tử Al (có số proton =13) là:
A. 1
B. 2
C. 3
D. 4.
Câu 4: Khối lượng của 1 nguyên tử Cacbon là:
A. 1,9926.10-23g
B. 1,9926g
C. 1,9926.10-23đvC
D.1,9926đvC.
Câu 5: Khối lượng của 1 đvC là:
A. 1,6605.10-23g
B.1,6605.10-24g
C. 6.1023g
D.1,9926.10-23g
Câu 6: Hiện tượng hoá học khác với hiện tượng vật lý là :
A. Chỉ biến đổi về trạng thái.
B. Có sinh ra chất mới.
C. Biến đổi về hình dạng.
D. Khối lượng thay đổi.
Câu 7 : Cho biết công thức hóa học hợp chất của nguyên tố X với O là: XO và hợp chất của nguyên tố Y với H là: YH3 (X; Y là những nguyên tố nào đó). Công thức hóa học đúng cho hợp chất X với Y là:
A. X3Y2
B.X2Y3
C.XY3
D.XY
Câu 8 : Trong 1 phản ứng hoá học các chất phản ứng và sản phẩm chứa cùng:
A. Số nguyên tử của mỗi nguyên tố.
B. Số phân tử trong mỗi chất.
C. Số phân tử của mỗi chất.
D.Số nguyên tố tạo ra chất.
Câu 9: Tỉ lệ % khối lượng của các nguyên tố Ca, C, O trong CaCO3 lần lượt là:
A. 40%; 40%; 20%
B. 20% ; 40% ; 40%
C. 40%; 12%; 48%
D.10% ; 80% ; 10%
Câu 10: Trong hợp chất AxBy . Hoá trị của A là m, hoá trị của B là n thì quy tắc hóa trị là:
A. m.n = x.y
B. m.y = n.x
C. m.A= n.B
D. m.x = n.y
B. PHẦN TỰ LUẬN : (7 Điểm)
Câu 1(2đ): Phát biểu nội dung định luật bảo toàn khối lượng.
Áp dụng : Nung 10,2g đá vôi (CaCO3) sinh ra 9g vôi sống và khí cacboníc
a. Viết công thức về khối lượng.
b. Tính khối lượng khí cacboníc sinh ra.
Câu 2(2đ): Lập phương trình hóa học của các phản ứng sau:
a. Nhôm + Khí ôxi Nhôm ôxit.
b. Natri + Nước Natri hiđrôxit + Khí Hiđrô
Câu 3(3đ): Cho 13 gam Kẽm tác dụng vừa đủ với axit clohiđric theo phương trình
Zn + HCl ZnCl2 + H2
a) Tính số mol Zn và lập phương trình phản ứng trên.
b) Tính thể tích khí H2 thoát ra (đktc).
c) Tính khối lượng axit clohiđric (HCl) đã dùng cho phản ứng trên.
(Cho KLNT: Ca = 40; C = 12; O = 16; Zn = 65; H = 1; Cl = 35,5)
(Hóa trị: Al(III); O(II); Na(I); H(I)).
ĐÁP ÁN VÀ BIỂU ĐIỂM ĐỀ 4-HOÁ 8
A . TRẮC NGHIỆM KHÁCH QUAN (3 Điểm)
Chọn và khoanh tròn vào chữ cái có phương án trả lời đúng nhất. Mỗi câu trả lời đúng 0.3đ
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Đáp án |
D |
C |
C |
A |
B |
B |
A |
D |
C |
D |
B. PHẦN TỰ LUẬN : (7 Điểm)
Bài 1 : (2đ) Phát biểu đúng nội dung định luật bảo toàn khối lượng được (1đ).
Áp dụng : a. mCaCO3 = mCaO + mCO2 (0,5đ)
b. mCO2 = mCaCO3 – mCaO = 10,2 – 9 = 1,2 g (0,5đ)
Bài 2: (2đ) - Mỗi PTHH viết đúng được (0,5đ)
- Mỗi PTHH cân bằng đúng được (0,5đ)
a. 4Al + 3O2 2Al2O3
b. 2Na + 2H2O 2NaOH + H2
Bài 3(3đ):
a) Số mol Zn. nZn = = 0,2 mol. (0,5đ)
Lập phương trình phản ứng trên.
Zn + 2HCl ZnCl2 + H2 (0,5đ)
1mol 2mol 1mol 1mol
0,2 mol 0,4 mol 0,2 mol 0,2 mol
b) = nZn = 0,2 mol (0,5đ)
Thể tích khí H2 thoát ra (đktc).
V = n.22,4 = 0,2.22,4 = 4,48 lít (0,5đ)
c) Khối lượng axit clohiđric (HCl) đã dùng cho phản ứng trên.
= 2nZn = 0,4 mol (0,5đ)
mHCl = n.M = 0,4.36,5 = 14,6 g. (0,5đ)
Xem thêm các bộ đề thi Hoá học lớp 8 chọn lọc, hay khác:
TOP 30 Đề thi Giữa Học kì 2 Hoá học lớp 8 năm 2023 có đáp án
Đề cương Giữa học kì 2 Hoá học lớp 8 năm 2023 chi tiết nhất
Bài tập Hóa học lớp 8 Giữa học kì 2 có đáp án
