TOP 11 Đề thi Giữa Học kì 2 Hoá học 8 năm 2023 có đáp án
Bộ 11 Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hoá học 8 Giữa học kì 2. Mời các bạn cùng đón xem:
Chỉ 100k mua trọn bộ Đề thi Hóa học 8 bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Đề thi Giữa Học kì 2 Hoá học lớp 8 năm 2022 - 2023 có đáp án
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 1
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65)
Câu 1: Phát biểu nào sau đây không đúng?
A. Khí oxi là chất khí không màu, không mùi, ít tan trong nước.
B. Khí oxi nhẹ hơn không khí.
C. Oxi hóa lỏng ở − 183oC.
D. Oxi lỏng có màu xanh nhạt.
Câu 2: Cho các phát biểu sau:
(1) Khí oxi là một đơn chất phi kim hoạt động rất kém.
(2) Ở nhiệt độ cao, khí oxi dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất.
(3) Sắt cháy trong khí oxi thu được oxit sắt từ.
(4) Oxi là nguyên tố hóa học phổ biến nhất (chiếm 49,4% khối lượng vỏ Trái Đất).
(5) Ở dạng đơn chất, khí oxi có nhiều trong không khí.
Trong các phát biểu trên, số phát biểu đúng là
A. 3.
B. 2.
C. 5.
D. 4.
Câu 3: Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 3,2 gam metan là
A. 4,48 lít.
B. 5,60 lít.
C. 8,96 lít.
D. 2,24 lít
Câu 4: Ứng dụng nào sau đây không phải của oxi?
A. Cần để đốt nhiên liệu trong đời sống và sản xuất.
B. Dùng để dập tắt đám cháy.
C. Cần cho sự hô hấp của người và động vật.
D. Oxi lỏng còn dùng để đốt nhiên liệu trong tên lửa.
Câu 5: Trong các phản ứng hóa học sau, phản ứng nào là phản ứng hóa hợp?
A. 4Al + 3O2 2Al2O3.
B. CaCO3 CaO + CO2.
C. Fe + H2O FeO + H2↑.
D. CO + CuO Cu + CO2.
Câu 6: Công thức Fe2O3 có tên gọi là gì?
A. Sắt oxit.
B. Sắt(II) oxit.
C. Sắt(III) oxit.
D. Sắt từ oxit.
Câu 7: Chỉ ra các oxit bazơ trong dãy sau: P2O5, CaO, CuO, BaO, Na2O, SO3?
A. P2O5, CaO, CuO.
B. CaO, CuO, BaO, Na2O.
C. BaO, Na2O, SO3.
D. P2O5, CaO, SO3.
Câu 8: Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất nào?
A. Khí oxi tan trong nước.
B. Khí oxi ít tan trong nước.
C. Khí oxi khó hóa lỏng.
D. Khí oxi nhẹ hơn nước.
Câu 9: Cho các phản ứng sau:
1) 2FeCl2 + Cl2 2FeCl3
2) CuO + H2 Cu + H2O
3) 2KNO3 2KNO2 + O2
4) 2Fe(OH)3 Fe2O3 + 3H2O
5) CH4 + 2O2 CO2 + 2H2O
Số phản ứng phân hủy là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 10: Điều kiện phát sinh phản ứng cháy là
A. Chất phải nóng đến nhiệt độ cháy.
B. Phải đủ khí oxi cho sự cháy.
C. Cần phải có chất xúc tác cho phản ứng cháy.
D. Cả A và B.
Câu 11: Đốt cháy 6 gam oxi và 6,2 gam P trong bình. Sau phản ứng chất nào còn dư?
A. Photpho.
B. Cả hai chất đều hết.
C. Không xác định được.
D. Oxi.
Câu 12: Hỗn hợp khí hiđro và khí oxi là hỗn hợp nổ. Hỗn hợp sẽ gây nổ mạnh nhất nếu trộn khí H2 và khí O2 theo tỉ lệ về thể tích là
A. 1:2.
B. 1:3
C. 3:1.
D. 2:1.
Câu 13: Khử hoàn toàn 24 gam đồng (II) oxit bằng khí hiđro. Khối lượng đồng kim loại thu được là
A. 6,4 gam.
B. 12,8 gam.
C. 16,0 gam.
D. 19,2 gam.
Câu 14: Ứng dụng nào sau đây không phải của khí hiđro?
A. Dùng làm nhiên liệu cho động cơ tên lửa.
B. Dùng để bơm vào khinh khí cầu, bóng thám không.
C. Dùng trong đèn xì oxi-hiđro để hàn cắt kim loại.
D. Dùng để dập tắt đám cháy.
Câu 15: Trong phản ứng hóa học giữa khí H2 và CuO ở nhiệt độ cao đã xảy ra
A. sự oxi hóa H2 tạo thành H2O.
B. sự khử H2 tạo thành H2O.
C. sự oxi hoá CuO tạo ra Cu.
D. sự phân hủy CuO thành Cu.
Câu 16: Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A. C + O2 CO2.
B. Fe2O3 + 3CO 2Fe + 3CO2.
C. CaCO3 CaO + CO2.
D. 3Fe + 2O2 Fe3O4.
Câu 17: Cho kim loại kẽm tác dụng với dung dịch HCl dư. Để điều chế được 1,12 lít khí hiđro (ở đktc) thì khối lượng kẽm cần dùng là
A. 0,65 gam.
B. 1,95 gam.
C. 2,60 gam.
D. 3,25 gam.
Câu 18: Phát biểu nào sau đây không đúng?
A. Thu khí H2 vào ống nghiệm bằng cách đẩy không khí hay đẩy nước.
B. Nhận ra khí H2 bằng que đóm đang cháy.
C. Khí hiđro khử đồng(II) oxit ở nhiệt độ cao thành kim loại Cu.
D. Khí hiđro có tính oxi hóa.
Câu 19: Kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường?
A. Mg.
B. Cu.
C. Fe.
D. Na.
Câu 20: Oxit nào sau đây tác dụng với nước tạo thành bazơ?
A. CaO.
B. SO3.
C. Al2O3.
D. CuO.
Câu 21: Cho phương trình hóa học: 2Al + Fe2O3 Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
A. sự oxi hóa, sự khử.
B. sự khử, sự oxi hóa.
C. sự phân hủy, sự khử.
D. sự oxi hóa, sự phân hủy.
Câu 22: Phần trăm về khối lượng của nguyên tố H trong nước là
A. 88,9%.
B. 11,1%.
C. 16,2%.
D. 83,8%.
Câu 23: Vì sao cá sống được trong nước?
A. Vì trong nước có hòa tan khí nitơ.
B. Vì trong nước có hòa tan khí cacbon đioxit.
C. Vì trong nước có hòa tan khí hiđro.
D. Vì trong nước có hòa tan khí oxi.
Câu 24: Hiện tượng xảy ra khi cho một cây nến đang cháy vào một lọ thủy tinh rồi đậy nút kín là
A. cây nến cháy mãnh liệt hơn.
B. cây nến vẫn cháy như trước.
C. ngọn lửa cây nến sẽ yếu dần đi rồi tắt.
D. ngọn lửa cây nến đổi màu.
Câu 25: Cho phản ứng: C + O2 CO2. Phản ứng trên là
A. Phản ứng hóa hợp
B. Phản ứng toả nhiệt
C. Phản ứng cháy.
D. Tất cả các ý trên đều đúng.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1. B |
2. D |
3. C |
4. B |
5. A |
6. C |
7. B |
8. B |
9. B |
10. D |
|
11. A |
12. D |
13. D |
14. D |
15. A |
16. C |
17. D |
18. D |
19. D |
20. A |
|
21. A |
22. B |
23. D |
24. C |
25. D |
|
|
|
|
|
Câu 1
Đáp án B
→ Khí oxi nặng hơn không khí.
Câu 2
Đáp án D
Phát biểu đúng: (2), (3), (4), (5).
Phát biểu không đúng: (1).
Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, khí oxi dễ dàng tác dụng được với nhiều đơn chất (kim loại, phi kim) và hợp chất.
Câu 3
Đáp án C
Phương trình hóa học: CH4 + 2O2 CO2 + 2H2O.
(mol).
Theo phương trình hóa học: (mol).
→ (lít).
Câu 4
Đáp án B
Khí oxi cần cho sự hô hấp của người và động vật, cần để đốt nhiên liệu trong đời sống và sản xuất. Oxi lỏng còn dùng để đốt nhiên liệu trong tên lửa.
Câu 5
Đáp án A
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới (sản phẩm) được tạo thành từ hai hay nhiều chất ban đầu.
⇒ Phản ứng hóa hợp: 4Al + 3O2 2Al2O3.
Câu 6
Đáp án C
Fe là kim loại có nhiều hóa trị, hóa trị của Fe trong Fe2O3 là III
⇒ Công thức Fe2O3 có tên gọi là: sắt (III) oxit
Câu 7
Đáp án B
Oxit bazơ là oxit của kim loại.
⇒ Các oxit bazơ là: CaO, CuO, BaO, Na2O.
Câu 8
Đáp án B
Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất: Khí oxi ít tan trong nước.
Câu 9
Đáp án B
Phản ứng phân hủy là phản ứng hóa học trong đó một chất phản ứng sinh ra hai hay nhiều chất mới
⇒ Các phản ứng phân hủy là:
3) 2KNO3 2KNO2 + O2
4) 2Fe(OH)3 Fe2O3 + 3H2O
Câu 10
Đáp án D
Điều kiện phát sinh phản ứng cháy là:
- Chất phải nóng đến nhiệt độ cháy.
- Phải có đủ khí oxi cho sự cháy.
Câu 11
Đáp án A
Số mol O2 là: = 0,1875 mol
Số mol P là: = 0,2 mol
Phương trình hóa học:
4P + 5O2 2P2O5
Xét tỉ lệ: và
Vì 0,05 > 0,0375 ⇒ O2 phản ứng hết, P dư
Câu 12
Đáp án D
Phương trình hóa học: 2H2 + O2 2H2O.
Hỗn hợp khí hiđro và khí oxi là hỗn hợp nổ. Hỗn hợp sẽ gây nổ mạnh nhất nếu trộn khí H2 và khí O2 theo tỉ lệ về thể tích đúng như hệ số các chất trong phương trình hóa học trên tức là 2 : 1.
Câu 13
Đáp án D
Phương trình hóa học: CuO + H2 Cu + H2O.
(mol)
Theo phương trình hóa học: (mol)
→ (gam).
Câu 14
Đáp án D
Khí hiđro cháy mạnh trong khí oxi, do đó không dùng để dập tắt đám cháy.
Phương trình hóa học: 2H2 + O2 2H2O.
Câu 15
Đáp án A
Sự tách oxi khỏi hợp chất gọi là sự khử. Sự tác dụng của oxi với một chất là sự oxi hóa.
Phương trình hóa học: CuO + H2 Cu + H2O (1).
Trong phản ứng (1) trên đã xảy ra:
Quá trình tách nguyên tử oxi khỏi hợp chất CuO → xảy ra sự khử CuO tạo ra Cu.
Quá trình kết hợp của nguyên tử oxi trong CuO với H2 → sự oxi hóa H2 tạo thành H2O.
Câu 16
Đáp án C
Phản ứng oxi hóa – khử là phản ứng trong đó xảy ra đồng thời sự oxi hóa và sự khử.
→ Phản ứng không phải là phản ứng oxi hóa – khử: CaCO3 CaO + CO2.
Đây là phản ứng phân hủy.
Câu 17
Đáp án D
Phương trình hóa học: Zn + 2HCl → ZnCl2 + H2↑.
Ta có: (mol).
Theo phương trình hóa học: (mol).
→ (gam).
Câu 18
Đáp án D
Khí hiđro H2 có tính khử.
Câu 19
Đáp án D
Nước tác dụng với một số kim loại ở nhiệt độ thường (như Na, K, Ca, Ba ...) tạo thành bazơ tan và khí hiđro.
Phương trình hoá học: 2Na + 2H2O → 2NaOH + H2↑.
Câu 20
Đáp án A
Nước tác dụng với một số bazơ (Na2O, K2O, BaO, CaO …) tạo ra bazơ (NaOH, KOH, Ba(OH)2, Ca(OH)2 …).
Phương trình hoá học: CaO + H2O → Ca(OH)2.
Câu 21
Đáp án A
Sự tách oxi khỏi hợp chất gọi là sự khử. Sự tác dụng của oxi với một chất là sự oxi hóa. Vậy:
Quá trình Al tạo thành Al2O3 là sự oxi hóa.
Quá trình Fe2O3 tạo thành Fe là sự khử.
Câu 22
Đáp án B
Công thức hoá học của nước là H2O.
Phần trăm về khối lượng của nguyên tố H trong nước là
.
Câu 23
Đáp án D
Cá sống được trong vì nước có hòa tan khí oxi.
Trong quá trình thở, cá hấp thụ nước qua miệng và đẩy mạnh qua mang. Khi nước chuyển qua mang, oxi hòa tan trong nước sẽ đi qua thành mỏng của mang vào mạch máu sau đó đi vào máu. Cuối cùng chất thải cacbon đioxit có trong máu sẽ đi vào nước giúp cá thở dưới nước.
Câu 24
Đáp án C
Khi cho một cây nến đang cháy vào một lọ thủy tinh rồi đậy nút kín, ngọn lửa cây nến sẽ yếu dần đi rồi tắt. Nguyên nhân là vì khi nến cháy, lượng oxi trong bình giảm dần rồi hết, khi đó nến sẽ tắt đi.
Câu 25
Đáp án D
Phản ứng đốt cháy cacbon (than) trong khí oxi: C + O2 CO2
- Ta thấy: chất mới CO2 được tạo thành từ 2 chất ban đầu là C và O2.
⇒ Đây là phản ứng hóa hợp.
- Vì C phản ứng với O2 tỏa nhiều nhiệt.
⇒ Đây là phản ứng cháy, tỏa nhiệt.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 2
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65)
Câu 1: Nguyên liệu nào sau đây dùng để điều chế O2 trong phòng thí nghiệm?
A. KClO3, KNO3, không khí.
B. KClO3, CaCO3, KMnO4.
C. KMnO4, KClO3, KNO3.
D. KMnO4, KClO3.
Câu 2: Chọn đáp án đúng nhất?
A. Phản ứng hóa hợp chính là phản ứng cháy.
B. Sự oxi hóa chậm không tỏa nhiệt và phát sáng.
C. Sự oxi hóa chậm tỏa nhiệt và không phát sáng.
D. Cả 3 đáp án đều sai.
Câu 3: Trong các câu sau, câu nào sai?
A. Oxi nặng hơn không khí.
B. Oxi là chất khí không màu, không mùi, không vị.
C. Oxi tan nhiều trong nước.
D. Oxi chiếm 1/5 thể tích không khí.
Câu 4: Thành phần thể tích của không khí gồm
A. 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
B. 21% khí nitơ, 78% khí oxi, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
C. 21% các khí khác, 78% khí nitơ, 1% khí oxi.
D. 21% khí oxi, 78% các khí khác, 1% khí nitơ.
Câu 5: Đốt cháy hoàn toàn 2,24 lít khí CH4 trong bình chứa khí oxi. Thể tích khí oxi (đo ở đktc) cần dùng là
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
Câu 6: Phản ứng nào dưới đây không phải là phản ứng thế?
A. CuO + H2 ⟶ Cu + H2O
B. Mg + 2HCl ⟶ MgCl2 + H2
C. Ca(OH)2 + CO2 ⟶ CaCO3 + H2O
D. Zn + CuSO4 ⟶ ZnSO4 + Cu
Câu 7: Sự oxi hóa chậm là
A. sự oxi hóa không tỏa nhiệt.
B. sự oxi hóa mà không phát sáng.
C. sự oxi hóa tỏa nhiệt mà không phát sáng.
D. sự tự bốc cháy.
Câu 8: Khí oxi có tính chất vật lí nào?
A. Nhẹ hơn không khí.
B. Tan trong nước.
C. Hoá lỏng ở -100oC.
D. Nặng hơn không khí, ít tan trong nước và hoá lỏng ở – 183oC.
Câu 9: Phương trình đốt lưu huỳnh cháy với khí oxi là
A. 2S + O2 2SO2.
B. S + O2 SO2.
C. S + O SO2.
D. SO2 S + O2.
Câu 10: Chọn phát biểu đúng?
A. Oxit là một hợp chất của 2 nguyên tố.
B. Oxit là hợp chất của 2 nguyên tố trong đó có 1 nguyên tố là oxi.
C. Oxit là hỗn hợp của oxi với các nguyên tố khác.
D. Oxit là hợp chất có chứa nguyên tố oxi.
Câu 11: Trong các phản ứng hoá học sau, phản ứng nào là phản ứng phân huỷ?
A. 3Fe + 2O2 Fe3O4.
B. CaCO3 CaO + CO2.
C. CaO + H2O Ca(OH)2.
D. Fe2O3 + 3CO 2Fe + 3CO2.
Câu 12: Muốn dập tắt sự cháy phải thực hiện biện pháp
A. Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy.
B. Cách ly chất cháy với khí oxi.
C. Một hoặc đồng thời cả hai biện pháp A, B.
D. Đồng thời cả hai biện pháp A, B.
Câu 13: Khí hiđro là chất khí
A. nặng nhất.
B. nhẹ nhất trong các khí.
C. nặng bằng không khí.
D. nặng hơn khí nitơ.
Câu 14: Dẫn khí H2 qua bột CuO nung nóng ở nhiệt độ cao có hiện tượng
A. tạo thành lớp kim loại màu đỏ gạch.
B. tạo thành những giọt nước.
C. tạo thành lớp kim loại màu đen.
D. không có hiện tượng gì.
Câu 15: Phản ứng hóa học nào sau đây dùng để điều chế kim loại sắt?
A. 3CO + Fe2O3 3CO2 + 2Fe.
B. Fe + 2HCl → FeCl2 + H2 .
C. Fe + CuCl2 → FeCl2 + Cu.
D. 3Fe + 2O2 → Fe3O4.
Câu 16: Muốn điều chế được 11,2 lít khí H2 (ở đktc) cần khối lượng Zn phản ứng với dung dịch H2SO4 dư là
A. 32,5 gam
B. 6,5 gam
C. 65 gam
D. 1,3 gam
Câu 17: Tính chất hoá học của nước là
A. Tác dụng với kim loại.
B. Tác dụng với oxit bazơ.
C. Tác dụng với oxit axit.
D. Tác dụng với kim loại mạnh, oxit bazơ của kim loại mạnh và nhiều oxit axit.
Câu 18: Cho các công thức hoá học: HCl; Ca(OH)2; Al2O3; H2SO4; Fe2O3; Na2SO4. Số công thức thuộc oxit là
A. 5.
B. 4.
C. 3.
D. 2.
Câu 19: Trong phản ứng hóa học giữa khí H2 và CuO ở nhiệt độ cao đã xảy ra
A. sự oxi hóa H2 tạo thành H2O.
B. sự khử H2 tạo thành H2O.
C. sự oxi hoá CuO tạo ra Cu.
D. sự phân hủy CuO thành Cu.
Câu 20: Khử hoàn toàn 16 gam đồng (II) oxit bằng khí hiđro. Khối lượng đồng kim loại thu được là
A. 6,4 gam.
B. 12,8 gam.
C. 16,0 gam.
D. 19,2 gam.
Câu 21: Tên gọi của P2O5 là
A. Điphotpho trioxit.
B. Photpho oxit
C. Điphotpho oxit.
D. Điphotpho pentaoxit
Câu 22: Trong phân tử nước có phần trăm khối lượng H là
A. 11,1%.
B. 88,97%.
C. 90%.
D. 10%
Câu 23: Chọn phát biểu đúng?
A. Sự tách oxi khỏi hợp chất được gọi là sự oxi hóa.
B. Sự tác dụng của oxi với một chất gọi là sự khử.
C. Chất khử là chất chiếm oxi của chất khác.
D. Chất oxi hóa là chất chiếm oxi của chất khác.
Câu 24: Sự giống nhau giữa sự cháy và sự oxi hóa chậm là
A. Phát sáng.
B. Cháy.
C. Tỏa nhiệt.
D. Sự oxi hóa xảy ra chậm
Câu 25: Cho phản ứng: C + O2 CO2. Phản ứng trên là
A. Phản ứng hóa hợp.
B. Phản ứng toả nhiệt.
C. Phản ứng cháy.
D. Tất cả các ý trên đều đúng.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1. D |
2. C |
3. C |
4. A |
5. C |
6. C |
7. C |
8. D |
9. B |
10. B |
|
11. B |
12. C |
13. B |
14. A |
15. A |
16. A |
17. D |
18. D |
19. A |
20. B |
|
21. D |
22. A |
23. C |
24. C |
25. D |
|
|
|
|
|
Câu 1
Đáp án D
Trong phòng thí nghiệm, khí oxi được điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao như KMnO4 và KClO3.
Phương trình hóa học:
2KMnO4 K2MnO4 + MnO2 + O2↑
2KClO3 2KCl + 3O2↑
Câu 2
Đáp án C
Sự oxi hóa chậm là sự oxi hóa có tỏa nhiệt và không phát sáng.
Câu 3
Đáp án C
Oxi là chất khí ít tan trong nước.
⇒ Đáp án C sai.
Câu 4
Đáp án A
Thành phần thể tích của không khí gồm 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
Câu 5
Đáp án C
Ta có:
Phương trình hóa học:
⇒ Voxi = 0,2.22,4 = 4,48 lít
Câu 6
Đáp án C
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
⇒ Phương trình C không phải phản ứng thế.
Câu 7
Đáp án C
Sự oxi hóa chậm là sự oxi hóa có tỏa nhiệt mà không phát sáng.
Câu 8
Đáp án D
Khí oxi nặng hơn không khí, ít tan trong nước và hoá lỏng ở – 183oC. Đây là một số tính chất vật lí của oxi.
Câu 9
Đáp án B
S + O2 SO2
Câu 10
Đáp án B
Oxit là hợp chất của 2 nguyên tố trong đó có 1 nguyên tố là oxi.
Ví dụ: CaO, Fe2O3, CO2, SO3, …
Câu 11
Đáp án B
Phản ứng phân hủy là phản ứng hóa học mà một chất bị phân hủy thành hai hay nhiều chất mới.
⇒ Phản ứng phân hủy là CaCO3 CaO + CO2↑
Câu 12
Đáp án C
Muốn dập tắt sự cháy phải thực hiện một hay đồng thời hai biện pháp sau:
+ Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy.
+ Cách ly chất cháy với khí oxi.
Câu 13
Đáp án B
Ta có: ⇒ Khí H2 là chất khí nhẹ nhất trong các khí.
Câu 14
Đáp án A
Dẫn khí H2 qua bột CuO nung nóng ở nhiệt độ cao thấy có chất rắn màu đen (CuO) chuyển dần thành màu đỏ gạch (Cu).
Phương trình hóa học:
H2 + CuO Cu + H2O
Câu 15
Đáp án A
Để điều chế kim loại sắt thì người ta dùng khí CO để khử oxit sắt thành Fe.
Phương trình hóa học:
3CO + Fe2O3 3CO2 + 2Fe
Câu 16
Đáp án A
Ta có:
Phương trình hóa học:
⟹ mZn = 0,5.65 = 32,5 gam
Câu 17
Đáp án D
Tính chất hoá học của nước là tác dụng với:
+ kim loại mạnh.
+ oxit bazơ của kim loại mạnh.
+ nhiều oxit axit.
Câu 18
Đáp án D
Oxit là hợp chất của 2 nguyên tố trong đó có 1 nguyên tố là oxi.
⇒ Oxit gồm: Al2O3 và Fe2O3.
Câu 19
Đáp án A
Trong phản ứng hóa học giữa khí H2 và CuO ở nhiệt độ cao đã xảy ra sự oxi hóa H2 tạo thành H2O vì H2 đã kết hợp với nguyên tử oxi trong CuO.
Câu 20
Đáp án B
Ta có: nCuO =
Phương trình hóa học:
⇒ mCu = 0,2.64 = 12,8 gam
Câu 21
Đáp án D
P2O5 là oxit axit.
Tên oxit axit = Tiền tố chỉ số nguyên tử phi kim + tên phi kim + tiền tố chỉ số nguyên tử oxi + oxit
⇒ P2O5 có tên gọi là điphotpho pentaoxit
Câu 22
Đáp án A
Phần trăm khối lượng của H trong H2O là:
%mH =
Câu 23
Đáp án C
Chất khử là chất chiếm oxi của chất khác.
⇒ Đáp án C đúng.
Câu 24
Đáp án C
Sự giống nhau giữa sự cháy và sự oxi hóa chậm là đều tỏa nhiệt.
Câu 25
Đáp án D
Phản ứng đốt cháy cacbon (than) trong khí oxi: C + O2 CO2
- Ta thấy: chất mới CO2 được tạo thành từ 2 chất ban đầu là C và O2.
⇒ Đây là phản ứng hóa hợp.
- Vì C phản ứng với O2 tỏa nhiều nhiệt.
⇒ Đây là phản ứng cháy, tỏa nhiệt.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 3
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65)
Câu 1: Phát biểu nào sau đây về oxi là không đúng?
A. Oxi là phi kim hoạt động hoá học rất mạnh, nhất là ở nhịêt độ cao.
B. Oxi tạo oxit axit với hầu hết kim loại.
C. Oxi không có mùi và vị.
D. Oxi cần thiết cho sự sống.
Câu 2: Trong phòng thí nghiệm người ta điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3. Vì lí do nào sau đây?
A. Dễ kiếm, rẻ tiền.
B. Giàu oxi và dễ phân huỷ ra oxi.
C. Phù hợp với thiết bị hiện đại.
D. Không độc hại.
Câu 3: Nếu đốt cháy hoàn toàn 2,4 gam cacbon trong 4,8 gam oxi thì thu được tối đa bao nhiêu gam khí CO2?
A. 6,6 gam.
B. 6,5 gam.
C. 6,4 gam.
D. 6,3 gam.
Câu 4: Sự oxi hóa là
A. sự tác dụng của hiđro với một chất.
B. sự tác dụng của nitơ với một chất.
C. sự phân hủy của một chất.
D. sự tác dụng của oxi với một chất.
Câu 5: Trong các phản ứng hóa học sau, phản ứng nào là phản ứng hóa hợp?
A. 4Al + 3O2 2Al2O3.
B. CaCO3 CaO + CO2.
C. Fe + H2O FeO + H2↑.
D. CO + CuO Cu + CO2.
Câu 6: Khử hoàn toàn 24 gam đồng(II) oxit bằng khí hiđro. Khối lượng đồng kim loại thu được là
A. 6,4 gam.
B. 12,8 gam.
C. 16,0 gam.
D. 19,2 gam.
Câu 7: Ứng dụng nào sau đây không phải của khí hiđro?
A. Dùng làm nhiên liệu cho động cơ tên lửa.
B. Dùng để bơm vào khinh khí cầu, bóng thám không.
C. Dùng trong đèn xì oxi-hiđro để hàn cắt kim loại.
D. Dùng để dập tắt đám cháy.
Câu 8: Oxit phi kim nào dưới đây không phải là oxit axit?
A. CO.
B. SO3.
C. P2O5.
D. N2O5.
Câu 9: Chọn định nghĩa về phản ứng phân hủy đầy đủ nhất?
A. Phản ứng phân hủy là phản ứng hóa học trong đó có một chất sinh ra một chất mới.
B. Phản ứng phân hủy là phản ứng hóa học trong đó có một chất sinh ra hai chất mới.
C. Phản ứng phân hủy là phản ứng hóa học trong đó có một chất sinh ra hai hay nhiều chất mới.
D. Phản ứng phân hủy là phản ứng hóa học có chất khí thoát ra.
Câu 10: Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất nào?
A. Khí oxi tan trong nước.
B. Khí oxi ít tan trong nước.
C. Khí oxi khó hóa lỏng.
D. Khí oxi nhẹ hơn nước.
Câu 11: Khi phân hủy có xúc tác 122,5 gam kaliclorat, thể tích khí oxi thu được sau khi phân hủy là
A. 48,0 lít.
B. 24,5 lít.
C. 67,2 lít.
D. 33,6 lít.
Câu 12: Thành phần không khí gồm
A. 21% N2; 78% O2 và 1% là các khí khác.
B. 78% N2; 21% O2 và 1% là các khí khác.
C. 50% N2; 20% O2 và 30% là các khí khác.
D. 100% O2.
Câu 13: Điều kiện phát sinh phản ứng cháy là
A. chất phải nóng đến nhiệt độ cháy.
B. phải đủ khí oxi cho sự cháy.
C. cần phải có chất xúc tác cho phản ứng cháy.
D. cả A và B.
Câu 14: Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A. C + O2 CO2.
B. Fe2O3 + 3CO 2Fe + 3CO2.
C. CaCO3 CaO + CO2.
D. 3Fe + 2O2 Fe3O4.
Câu 15: Phương trình hóa học của phản ứng nào sau đây dùng để điều chế khí H2 trong phòng thí nghiệm?
A. 2Na + 2H2O → 2NaOH + H2↑.
B. Zn + H2SO4 → ZnSO4 + H2↑.
C. 2H2O 2H2↑ + O2↑.
D. CuO + H2 Cu + H2O.
Câu 16: Phản ứng nào sau đây là phản ứng thế?
A. Fe + 2HCl → FeCl2 + H2↑.
B. CaCO3 CaO + CO2.
C. Fe + S FeS.
D. CuO + CO Cu + CO2.
Câu 17: Cho phương trình hóa học của phản ứng: Fe2O3 + 3H2 2Fe + 3H2O. Phát biểu đúng là
A. Phản ứng hóa học trên không là phản ứng oxi hóa – khử.
B. Phản ứng hóa học trên là phản ứng oxi hóa – khử; Fe2O3 là chất oxi hóa, H2 là chất khử.
C. Phản ứng hóa học trên là phản ứng oxi hóa – khử; Fe2O3 là chất khử, H2 là chất oxi hóa.
D. Phản ứng hóa học trên là phản ứng phân hủy.
Câu 18: Khử hoàn toàn 11,6 gam Fe3O4 bằng khí hiđro dư. Khối lượng Fe thu được sau phản ứng là
A. 5,60 gam.
B. 7,84 gam.
C. 8,40 gam.
D. 8,96 gam.
Câu 19: Kim loại không tan trong nước là
A. Na.
B. K.
C. Ca.
D. Cu.
Câu 20: Khi cho dòng điện một chiều đi qua nước, trên bề mặt 2 điện cực sẽ sinh ra
A. khí hiđro và khí oxi.
B. khí hiđro và khí cacbon oxit.
C. khí oxi và khí cacbon oxit.
D. khí hiđro và khí clo.
II. TỰ LUẬN (3 ĐIỂM)
Câu 1 (1,5 điểm): Trong dãy các oxit sau: H2O; Al2O3; CO2; FeO; SO3; P2O5; BaO. Phân loại oxit và gọi tên tương ứng với mỗi oxit đó?
Câu 2 (1,5 điểm): Đốt cháy hoàn toàn 23,3 gam hỗn hơp 2 kim loại Mg và Zn trong bình kín đựng khí oxi, sau phản ứng xảy ra hoàn toàn thu được 36,1 gam hỗn hợp 2 oxit.
a) Viết phương trình hóa học xảy ra.
b) Tính thể tích khí oxi (đktc) đã dùng để đốt cháy lượng kim loại trên.
c) Tính khối lượng mỗi kim loại trong hỗn hợp trên.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. TRẮC NGHIỆM (7 điểm)
|
1. B |
2. B |
3. A |
4. D |
5. A |
6. D |
7. D |
8. A |
9. C |
10. B |
|
11. D |
12. B |
13. A |
14. C |
15. B |
16. A |
17. B |
18. C |
19. D |
20. A |
Câu 1
Đáp án B
Oxi tác dụng với nhiều phi kim để sinh ra oxit axit.
Câu 2
Đáp án B
Trong phòng thí nghiệm người ta điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3. Vì những chất này giàu oxi và dễ bị phân hủy ra oxi.
Câu 3
Đáp án A
Ta có: ;
Phương trình hóa học:
C + O2 CO2
Nhận thấy: ⇒ C dư, oxi hết.
⇒
⇒ = 0,15.44 = 6,6 gam
Câu 4
Đáp án D
Sự oxi hóa là sự tác dụng của oxi với một chất.
Chất đó có thể là đơn chất hay hợp chất.
Câu 5
Đáp án A
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới (sản phẩm) được tạo thành từ hai hay nhiều chất ban đầu.
→ Phản ứng hóa hợp: 4Al + 3O2 2Al2O3.
Câu 6
Đáp án D
Phương trình hóa học: CuO + H2 Cu + H2O.
(mol)
Theo phương trình hóa học: (mol)
⇒ (gam).
Câu 7
Đáp án D
Khí hiđro cháy mạnh trong khí oxi, do đó không dùng để dập tắt đám cháy.
Phương trình hóa học: 2H2 + O2 2H2O.
Câu 8
Đáp án A
CO là oxit trung tính.
Câu 9
Đáp án C
Phản ứng phân hủy là phản ứng hóa học trong đó có một chất sinh ra hai hay nhiều chất mới.
Câu 10
Đáp án B
Người ta thu khí oxi bằng cách đẩy nước nhờ dựa vào tính chất: Khí oxi ít tan trong nước
Câu 11
Đáp án D
Ta có:
Phương trình hóa học:
2KClO3 2KCl + 3O2↑
Theo phương trình ta có:
⇒ lít
Câu 12
Đáp án B
Thành phần không khí gồm: 78% N2; 21% O2 và 1% là các khí khác.
Câu 13
Đáp án A
Điều kiện phát sinh phản ứng cháy là:
- Chất phải nóng đến nhiệt độ cháy.
- Phải có đủ khí oxi cho sự cháy.
Câu 14
Đáp án C
Phản ứng oxi hóa – khử là phản ứng trong đó xảy ra đồng thời sự oxi hóa và sự khử.
→ Phản ứng không phải là phản ứng oxi hóa – khử:
CaCO3 CaO + CO2.
Câu 15
Đáp án B
Trong phòng thí nghiệm, khí hiđro được điều chế bằng cách cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm).
→ Phương trình hóa học của phản ứng dùng để điều chế khí H2 trong phòng thí nghiệm: Zn + H2SO4 → ZnSO4 + H2↑
Câu 16
Đáp án A
Phản ứng thế là phản ứng hoá học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố trong hợp chất.
→ Phản ứng thế: Fe + 2HCl → FeCl2 + H2↑ (nguyên tử của đơn chất Fe thay thế nguyên tử của nguyên tố H trong hợp chất HCl).
Câu 17
Đáp án B
Phản ứng hóa học trên là phản ứng oxi hóa – khử.
Fe2O3 là chất oxi hóa vì là chất nhường oxi.
H2 là chất khử vì là chất chiếm oxi.
Câu 18
Đáp án C
Phương trình hoá học: Fe3O4 + 4H2 3Fe + 4H2O.
(mol).
Theo phương trình hoá học:
(mol).
⇒ (gam).
Câu 19
Đáp án D
Chỉ có các kim loại kiềm và kiềm thổ như: Li, Na, K, Ca, Ba… tan trong nước còn lại các kim loại khác không tan.
⇒ Cu không tan trong nước.
Câu 20
Đáp án A
Khi cho dòng điện một chiều đi qua nước, trên bề mặt 2 điện cực sẽ sinh ra khí hiđro và khí oxi.
Phương trình hoá học: 2H2O 2H2↑ + O2↑
II. TỰ LUẬN (3 điểm)
Câu 1:
|
Oxit axit |
Oxit bazơ |
Tên gọi tương ứng |
|
Na2O |
Natri oxit |
|
|
Al2O3 |
Nhôm oxit |
|
|
CO2 |
Cacbon đioxit |
|
|
N2O5 |
Đinitơ pentaoxit |
|
|
FeO |
Sắt (II) oxit |
|
|
SO3 |
Lưu huỳnh trioxit |
|
|
P2O5 |
Điphotpho pentaoxit |
Câu 2:
Phương trình hóa học:
2Mg + O2 2MgO
2Zn + O2 2ZnO
b) Áp dụng bảo toàn khối lượng:
mhh + moxi = moxit ⇒ moxi = moxit - mhh = 36,1 - 23,3 = 12,8 gam
Số mol của oxi đã dùng là:
⇒ lít
Gọi x, y lần lượt là số mol của Mg, Zn trong hỗn hợp X.
Khối lượng hỗn hợp ban đầu:
mhh = mMg + mZn = 24x + 65y = 23,3 (1)
Số mol của oxi ở cả 2 phương trình là: = 0,4 (2)
Sử dụng phương pháp thế giải được:
⇒ mMg = 0,7.24 = 16,8 gam
mZn = 0,1.65 = 6,5 gam
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 4
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65)
Câu 1: Trong phòng thí nghiệm, oxi được điều chế từ 2 chất nào sau đây?
A. CuO; Fe3O4.
B. KMnO4; KClO3.
C. Không khí; H2O.
D. KMnO4; MnO2.
Câu 2: Trong các phản ứng hóa học sau, phản ứng nào là phản ứng hóa hợp?
A. S + O2 SO2
B. CaCO3 CaO + CO2
C. CH4 + 2O2 CO2 + 2H2O
D. 2H2O 2H2 + O2
Câu 3: Trong các phản ứng sau, phản ứng nào xảy ra sự oxi hóa?
A. CaO + H2O → Ca(OH)2
B. S + O2 SO2
C. K2O + H2O → 2KOH
D. CaCO3 CaO + CO2
Câu 4: Người ta thu khí oxi bằng cách đẩy không khí dựa vào tính chất nào sau đây của khí oxi?
A. Khí O2 nhẹ hơn không khí.
C. Khí O2 là khí không mùi.
B. Khí O2 dễ hoà tan trong nước.
D. Khí O2 nặng hơn không khí.
Câu 5: Hiện tượng nào sau đây là sự oxi hóa chậm?
A. Đốt cồn trong không khí.
B. Sắt để lâu trong không khí bị gỉ.
C. Nước bốc hơi.
D. Đốt cháy lưu huỳnh trong không khí.
Câu 6: Phản ứng nào dưới đây là phản ứng phân hủy?
A. CuO + H2 Cu + H2O
B. Ca(HCO3)2 CaCO3 + CO2 + H2O
C. CO2 + Ca(OH)2 CaCO3 + H2O
D. CaO + H2O ⟶ Ca(OH)2
Câu 7: Chất có công thức hóa học nào sau đây là oxit?
A. ZnSO4.
B. ZnO.
C. Zn(OH)2.
D. ZnCO3.
Câu 8: Đốt cháy hoàn toàn khí metan (CH4) trong khí oxi (vừa đủ). Sản phẩm của phản ứng là
A. CO2.
B. CO2 và H2O.
C. CO2, H2O và O2.
D. H2O.
Câu 9: Cho các phương trình hóa học của các phản ứng sau:
1) CaCO3 CaO + CO2.
2) Fe + S FeS.
3) Zn + 2HCl → ZnCl2 + H2.
4) 2Fe + 3Cl2 2FeCl3.
Trong các phản ứng trên, số phản ứng hóa hợp và phản ứng phân hủy lần lượt là
A. 3; 1.
B. 2; 1.
C. 1; 3.
D. 1; 2.
Câu 10: Dãy chất nào sau đây gồm toàn oxit bazơ?
A. SO3; P2O5.
B. Na2O; SO3.
C. SO2; CaO.
D. Na2O; CaO.
Câu 11: Thành phần thể tích của không khí gồm
A. 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, hơi nước, khí hiếm, ...).
B. 21% khí nitơ, 78% khí oxi, 1% các khí khác (CO2, hơi nước, khí hiếm, ...).
C. 21% các khí khác, 78% khí nitơ, 1% khí oxi.
D. 21% khí oxi, 78% các khí khác, 1% khí nitơ.
Câu 12: Đốt cháy hoàn toàn 2,24 lít khí CH4 trong bình chứa khí oxi. Thể tích khí oxi (đo ở đktc) cần dùng là:
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
Câu 13: Cho các oxit: CaO; Al2O3; N2O5; CuO; Na2O; BaO; MgO; P2O5; Fe3O4; K2O. Số oxit tác dụng với nước tạo bazơ tương ứng là
A. 3.
B. 4.
C. 5.
D. 2
Câu 14: Chọn phát biểu đúng?
A. Sự tách oxi khỏi hợp chất được gọi là sự oxi hóa.
B. Sự tác dụng của oxi với một chất gọi là sự khử.
C. Chất khử là chất chiếm oxi của chất khác.
D. Chất oxi hóa là chất chiếm oxi của chất khác.
Câu 15: Cho 6,5 gam Zn phản ứng với axit clohiđric (HCl) thấy có khí bay lên với thể tích là
A. 2,24 lít.
B. 0,224 lít.
C. 22,4 lít.
D. 4,48 lít.
Câu 16: Dãy gồm các kim loại tác dụng với nước ở nhiệt độ thường là
A. Fe, Mg, Al.
B. Fe, Cu, Ag.
C. Zn, Al, Ag.
D. Na, K, Ca.
Câu 17: Cần bao nhiêu gam oxi để đốt cháy hết 1,5 mol lưu huỳnh?
A. 16 gam.
B. 32 gam.
C. 64 gam.
D. 48 gam.
Câu 18: Trong phản ứng hóa học giữa khí H2 và CuO ở nhiệt độ cao đã xảy ra
A. sự oxi hóa H2 tạo thành H2O.
B. sự khử H2 tạo thành H2O.
C. sự oxi hoá CuO tạo ra Cu.
D. sự phân hủy CuO thành Cu.
Câu 19: Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A. C + O2 CO2.
B. Fe2O3 + 3CO 2Fe + 3CO2.
C. CaCO3 CaO + CO2.
D. 3Fe + 2O2 Fe3O4.
Câu 20: Đâu là phản ứng thế trong các phản ứng sau?
A. Fe + 2HCl → FeCl2 + H2
B. NaOH + HCl → NaCl + H2O
C. Cu + O2 CuO
D. CuO + 2HCl → CuCl2 + H2O
Câu 21: Trong phòng thí nghiệm cần điều chế 4,48 lít O2 (đktc). Dùng chất nào sau đây để có khối lượng nhỏ nhất?
A. KClO3.
B. KMnO4.
C. KNO3.
D. H2O2.
Câu 22: Một loại oxit sắt trong đó cứ 14 phần sắt thì có 6 phần oxi (về khối lượng). Công thức của oxit sắt là
A. FeO.
B. Fe2O3.
C. Fe3O4.
D. Không xác định.
Câu 23: Cho 4,6 gam Na tác dụng với nước dư. Sau phản ứng thu được V lít khí (ở đktc). Giá trị của V là
A. 2,24.
B. 1,12.
C. 3,36.
D. 4,48.
Câu 24: Tính chất vật lí nào dưới đây không phải của hiđro?
A. Là chất khí không màu, không mùi, không vị.
B. Tan ít trong nước.
C. Tan nhiều trong nước.
D. Nhẹ hơn không khí.
Câu 25: Chất rắn Cu tạo thành từ phản ứng của CuO và H2 có màu gì?
A. Màu đen.
B. Màu nâu.
C. Màu xanh.
D. Màu đỏ.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 5
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65)
Câu 1: Chất nào là oxit bazơ?
A. N2O5.
B. SO3.
C. SO2.
D. Na2O
Câu 2: Chất nào là oxit?
A. H2SO4.
B. CO.
C. KClO3.
D. CaCO3.
Câu 3: Có hai khí không màu là O2 và H2 được chứa trong 2 bình riêng biệt. Sử dụng dụng cụ, hóa chất nào để nhận ra khí O2?
A. Que đóm.
B. Kim loại kẽm.
C. Que đóm cháy dở còn tàn đỏ.
D. Nước.
Câu 4: Thành phần % của khí oxi có trong không khí là
A. 78%.
B. 21%.
C. 100%.
D. 1%.
Câu 5: CO2 là sản phẩm thu được khi đốt cháy chất nào trong khí oxi?
A. Sắt.
B. Canxi.
C. Cacbon.
D. Lưu huỳnh.
Câu 6: Để đốt cháy hoàn toàn 1,2 gam C cần dùng bao nhiêu lít không khí ở đktc?
A. 4,48 lít.
B. 11,2 lít.
C. 5,6 lít.
D. 2,24 lít.
Câu 7: Phản ứng hóa hợp là
A. HCl + NaOH ⟶ NaCl + H2O.
B. Mg + 2HCl ⟶ MgCl2 + H2↑.
C. 2Fe + 3Cl2 2FeCl3.
D. Zn(OH)2 ZnO + H2O
Câu 8: Phương án nào không dùng để dập tắt đám cháy xăng dầu?
A. Phun CO2 lên đám cháy.
B. Dùng nước phun lên đám cháy.
C. Dùng cát phủ lên đám cháy.
C. Dùng chăn bông dày và ướt phủ lên đám cháy.
Câu 9: Người ta thu khí oxi bằng cách đẩy không khí là do oxi
A. nặng hơn không khí.
B. không màu.
C. không mùi.
D. ít tan trong nước.
Câu 10: Tên gọi của hợp chất SO3 là
A. sắt oxit.
B. lưu huỳnh trioxit.
C. lưu huỳnh (III) oxit.
D. lưu huỳnh (VI) oxit.
Câu 11: Có thể điều chế được bao nhiêu gam O2 từ 31,6 gam KMnO4?
A. 1,6 gam.
B. 16 gam.
C. 3,2 gam.
D. 6,4 gam.
Câu 12: Hỗn hợp H2 và O2 nổ mạnh nhất với tỉ lệ số mol bằng
A. 1:2.
B. 2:1.
C. 1:1.
D. 2:3.
Câu 13: Phản ứng hóa học có xảy ra sự oxi hóa là
A. Fe(OH)2 FeO + H2O
B. 2Mg + O2 2MgO
C. Na2O + H2O ⟶ 2NaOH
D. Na2SO4 + BaCl2 ⟶ BaSO4↓ + 2NaCl
Câu 14: Phản ứng phân hủy là
A. 2Zn + O2 2ZnO
B. 2Al(OH)3 Al2O3 + 3H2O
C. Fe + 2HCl ⟶ FeCl2 + H2↑
D. 2H2 + O2 2H2O
Câu 15: Tên gọi của hợp chất Fe2O3 là
A. sắt oxit.
B. đi sắt trioxit.
C. sắt (II) oxit.
D. sắt (III) oxit.
Câu 16: Đốt cháy 3,1 gam photpho trong bình chứa 11,2 lít khí oxi (đktc). Sau phản ứng trong bình có những chất nào?
A. Photpho và khí oxi.
B. Photpho, khí oxi và điphotpho pentaoxit.
C. Photpho và điphotpho pentaoxit.
D. Khí oxi và điphotpho pentaoxit.
Câu 17: Chất dùng để điều chế khí oxi trong phòng thí nghiệm là
A. không khí.
B. CaCO3.
C. KClO3.
D. H2O.
Câu 18: Trong phòng thí nghiệm, người ta dùng khí hiđro để khử sắt (III) oxit. Sau phản ứng thu được 5,6 gam sắt. Khối lượng sắt (III) oxit đã phản ứng và thể tích khí hiđro đã tiêu thụ (ở đktc) lần lượt là:
A. 16 gam; 2,24 lít.
B. 16 gam; 3,36 lít.
C. 8 gam; 3,36 lít.
D. 8 gam; 2,24 lít.
Câu 19: Khi ta muốn đốt 1 khúc gỗ, điều kiện để khúc gỗ đó cháy là
A. phải có chất xúc tác.
B. cần phải đủ khí O2.
C. cần ngâm khúc gỗ đó vào trong nước.
D. khúc gỗ đó phải nóng đến nhiệt độ cháy.
Câu 20: Đốt cháy hoàn toàn 56 lít khí hiđro (ở đktc) với khí oxi. Khối lượng nước thu được là
A. 45 gam.
B. 36 gam.
C. 24 gam.
D. 18 gam.
Câu 21: Kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường?
A. Mg.
B. Cu.
C. Fe.
D. Na.
Câu 22: Cho kim loại kẽm tác dụng với dung dịch HCl dư. Để điều chế được 1,12 lít khí hiđro (ở đktc) thì khối lượng kẽm cần dùng là
A. 0,65 gam.
B. 1,95 gam.
C. 2,60 gam.
D. 3,25 gam.
Câu 23: Phản ứng nào sau đây là phản ứng thế?
A. 3CO + Fe2O3 2Fe + 3CO2.
B. Fe + CuCl2 FeCl2 + Cu.
C. 2KClO3 2KCl + 3O2↑.
D. CaO + CO2 → CaCO3.
Câu 24: Cho những biến đổi hóa học sau:
(1) Nung nóng canxi cacbonat.
(2) Sắt tác dụng với lưu huỳnh.
(3) Khí CO đi qua đồng (II) oxit nung nóng.
Những biến đổi hóa học trên thuộc loại phản ứng nào?
A. (1) và (3) là phản ứng oxi hóa – khử, (2) là phản ứng hóa hợp.
B. (1) là phản ứng phân hủy, (2) là phản ứng hóa hợp, (3) là phản ứng oxi hóa – khử.
C. (1) là phản ứng phân hủy, (2) là phản ứng oxi hóa – khử, (3) là phản ứng hóa hợp.
D. (1) là phản ứng hóa hợp, (2) và (3) là phản ứng oxi hóa – khử.
Câu 25: Khi phân huỷ có xúc tác 122,5 gam KClO3, thể tích khí oxi thu được là
A. 33,6 lít.
B. 3,36 lít.
C. 11,2 lít.
D. 1,12 lít.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 6
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65)
Câu 1: Phát biểu nào sau đây về oxi là không đúng?
A. Oxi cần thiết cho sự sống.
B. Oxi không có mùi và không có màu.
C. Oxi là một đơn chất phi kim rất hoạt động, nhất là ở nhiệt độ cao.
D. Oxi tan nhiều trong nước.
Câu 2: Dãy các oxit axit là
A. CO, SO2, NO2, CuO.
B. P2O5, N2O5, CO2, SO3.
C. CuO, N2O5, SO2, CO2.
D. CO2, SO3, CaO, P2O5.
Câu 3: Phản ứng hóa học nào sau đây là phản ứng hóa hợp?
A. CaCO3 CaO + CO2
B. NaOH + HCl ⟶ NaCl + H2O
C. C + O2 CO2
D. Cu(OH)2 CuO + H2O
Câu 4: Oxit là hợp chất của oxi với
A. các nguyên tố hóa học khác.
B. một nguyên tố hóa học khác.
C. một nguyên tố phi kim khác.
D. một nguyên tố kim loại khác.
Câu 5: Hai chất dùng để điều chế khí oxi trong phòng thí nghiệm là
A. KClO3, CaCO3.
B. KMnO4, KClO3.
C. Fe3O4, KMnO4.
D. CaCO3, KMnO4.
Câu 6: Đốt cháy 12,4 gam P trong bình chứa 20 gam khí oxi. Khối lượng P2O5 thu được sau phản ứng là
A. 14,2 gam.
B. 32,4 gam.
C. 35,5 gam.
D. 28,4 gam.
Câu 7: Người ta thu khí oxi bằng cách đẩy nước là dựa vào tính chất vật lý nào?
A. Khí oxi khó hóa lỏng.
B. Khí oxi nhẹ hơn nước.
C. Khí oxi tan nhiều trong nước.
D. Khí oxi ít tan trong nước.
Câu 8: Khí oxi phản ứng được với chất nào cho dưới đây?
A. SO3.
B. Na2O.
C. CaO.
D. CH4.
Câu 9: Công thức hóa học của hợp chất tạo bởi sắt (Fe) và oxi (O), trong đó tỉ lệ là
A. Fe3O4.
B. Fe2O3.
C. FeO.
D. Fe3O2.
Câu 10: Thành phần của không khí là
A. 1% khí nitơ, 21% các khí khác, 78% khí oxi.
B. 21% khí nitơ, 78% khí oxi, 1% các khí khác.
C. 21% khí oxi, 78% khí nitơ, 1% các khí khác.
D. 1% khí oxi, 21% khí nitơ, 78% các khí khác.
Câu 11: Dãy chất nào sau đây phản ứng được với khí hiđro?
A. CuO, HCl.
B. CuO, O2.
C. CuO, H2O.
D. CuO, H2SO4.
Câu 12: Một oxit của nitơ có phân tử khối bằng 108 ứng với công thức nào sau đây?
A. NO2.
B. NO.
C. N2O5.
D. N2O3.
Câu 13: Phản ứng hóa học nào là phản ứng thế?
A. K2O + H2O ⟶ 2KOH
B. C + O2 CO2
C. Cu(OH)2 CuO + H2O
D. Zn + 2HCl ⟶ ZnCl2 + H2
Câu 14: Cặp chất dùng để điều chế khí H2 trong phòng thí nghiệm là
A. Cu và dung dịch HCl.
B. Zn và dung dịch NaOH.
C. Cu và dung dịch H2SO4.
D. Zn và dung dịch HCl.
Câu 15: Khi phân hủy có xúc tác 15,8 gam KMnO4, thể tích khí oxi thu được ở đktc là
A. 3,36 lít.
B. 11,2 lít.
C. 1,12 lít.
D. 33,6 lít.
Câu 16: Ứng dụng của khí H2 là
A. Dùng làm chất khử để điều chế một số kim loại.
B. Nhiên liệu cho động cơ tên lửa, ô tô, khinh khí cầu, bóng thám không, ...
C. Nguyên liệu tổng hợp amoniac NH3, axit, hợp chất hữu cơ.
D. Cả A, B, C đều đúng.
Câu 17: Cho phản ứng: H2O + Na2O ⟶ 2NaOH. Phản ứng đã cho thuộc loại
A. phản ứng tỏa nhiệt.
B. phản ứng oxi hóa khử.
C. phản ứng hóa hợp.
D. tất cả các ý trên đều đúng.
Câu 18: Khí H2 cháy trong khí O2 tạo nước theo phản ứng:
2H2 + O2 2H2O
Muốn thu được 22,5 gam nước thì thể tích khí H2 (đktc) cần dùng là
A. 4,48 lít.
B. 28 lít.
C. 2,8 lít.
D. 11,2 lít.
Câu 19: Cho một cây nến đang cháy vào bình thủy tinh rồi đậy kín. Hiện tượng gì sẽ xảy ra?
A. Nến cháy nhỏ dần rồi tắt.
B. Nến tắt ngay lập tức.
C. Nến cháy to hơn.
D. Nến cháy to hơn rồi tắt.
Câu 20: Trong phòng thí nghiệm, người ta điều chế khí oxi bằng cách nhiệt phân KClO3 hoặc KMnO4 vì chúng có những đặc điểm quan trọng nhất là
A. Không độc hại.
B. Dễ kiếm, rẻ tiền.
C. Giàu oxi và dễ phân hủy.
D. Phù hợp với thiết bị hiện đại.
Câu 21: Khi cho dòng điện một chiều đi qua nước, trên bề mặt 2 điện cực sẽ sinh ra
A. khí hiđro và khí oxi.
B. khí hiđro và khí cacbon oxit.
C. khí oxi và khí cacbon oxit.
D. khí hiđro và khí clo.
Câu 22: Để tạo ra được 3,6 gam nước thì thể tích khí hiđro và khí oxi (ở đktc) cần tác dụng với nhau lần lượt là
A. 4,48 lít và 4,48 lít
B. 4,48 lít và 2,24 lít.
C. 2,24 lít và 4,48 lít.
D. 2,24 lít và 2,24 lít.
Câu 23: Cho phương trình hóa học: 2Al + Fe2O3 Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
A. sự oxi hóa, sự khử.
B. sự khử, sự oxi hóa.
C. sự phân hủy, sự khử.
D. sự oxi hóa, sự phân hủy.
Câu 24: Dẫn luồng khí H2 dư đi qua 20 gam hỗn hợp hai oxit Fe2O3 và CuO nung nóng. Sau phản ứng để nguội, cân lại thấy khối lượng hỗn hợp giảm 24%. Phần trăm khối lượng của CuO trong hỗn hợp ban đầu là
A. 70%.
B. 30%.
C. 40%.
D. 60%.
Câu 25: Biết oxi chiếm 20% thể tích không khí. Thể tích không khí (đktc) cần thiết để đốt cháy 1 mol cacbon là
A. 112,0 lít.
B. 224,0 lít.
C. 11,2 lít.
D. 22,4 lít.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 7
Phần 1. Câu hỏi trắc nghiệm (3 điểm)
Câu 1. Phương trình hóa học nào dưới đây không xảy ra phản ứng.
A. 4P + 5O2 2P2O5
B. 4Ag + O2 2Ag2O
C. CO + O2 CO2
D. 2Cu + O2 2CuO
Câu 2. Tên gọi của oxit N2O5 là
A. Đinitơ pentaoxit
B. Đinitơ oxit
C. Nitơ (II) oxit
D. Nitơ (II) pentaoxit
Câu 3. Chất tác dụng với nước tạo ra dung dịch axit là:
A. CaO
B. BaO
C. Na2O
D. SO3
Câu 4. Dãy chất sau đây chỉ gồm các oxit:
A. MgO; Ba(OH)2; CaSO4; HCl
B. MgO; CaO; CuO; FeO
C. SO2; CO2; NaOH; CaSO4
D. CaO; Ba(OH)2; MgSO4; BaO
Câu 5. Dãy hóa chất nào dưới đây dùng để điều chế oxi trong phòng thí nghiệm
A. Không khí, KMnO4
B. KMnO4, KClO3
C. NaNO3, KNO3
D. H2O, không khí
Câu 6. Phản ứng phân hủy là
A. Ba + 2HCl → BaCl2 + H2
B. Cu + H2S → CuS + H2
C. MgCO3 → MgO + CO2
D. KMnO4 → MnO2 + O2 + K2O
Câu 7. Người ta thu khí oxi bằng cách đẩy nước là nhờ dựa vào tính chất.
A. Khí oxi tan trong nước
B. Khí oxi ít tan trong nước
C. Khí oxi khó hóa lỏng
D. Khí oxi nhẹ hơn nước
Câu 8. Thành phần các chất trong không khí:
A. 9% Nitơ, 90% Oxi, 1% các chất khác
B. 91% Nitơ, 8% Oxi, 1% các chất khác
C. 50% Nitơ, 50% Oxi
D. 21% Oxi, 78% Nitơ, 1% các chất khác
Câu 9. Phương pháp nào để dập tắt lửa do xăng dầu?
A. Quạt
B. Phủ chăn bông hoặc vải dày
C. Dùng nước
D. Dùng cồn
Câu 10. Tính khối lượng KMnO4 biết nhiệt phân thấy 2,7552 l khí bay lên
A. 38,678 g
B. 37,689 g
C. 38,868 g
D. 38,886 g
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Hoàn thành phản ứng các phương trình hóa học sau
a) P2O5 + H2O → ....
b) Mg + HCl → .....+ .....
c) KMnO4 → ......+ ......+ O2
d) K + H2O → ....
e) C2H4 + O2 → ......+ H2O
Câu 2. (2 điểm)
a. Trong dãy các oxit sau: H2O; Al2O3; CO2; FeO; SO3; P2O5; BaO. Phân loại oxit và gọi tên tương ứng với mỗi oxit đó?
b. Trong một oxit của kim loại R (hóa trị II), nguyên tố R chiếm 71,429% về khối lượng. Tìm công thức phân tử và gọi tên của oxit trên.
Câu 3. (3 điểm) Đốt cháy hoàn toàn 23,3 gam hỗn hơp 2 kim loại Mg và Zn trong bình kín đựng khí oxi, sau phản ứng xảy ra hoàn toàn thu được 36,1 gam hỗn hợp 2 oxit.
a) Viết phương trình hóa học xảy ra.
b) Tính thể tích khí oxi (đktc) đã dùng để đốt cháy lượng kim loại trên
c) Tính khối lượng mỗi kim loại trong hỗn hợp trên.
ĐÁP ÁN
Phần 1. Trắc nghiệm (3 điểm)
Mỗi câu đúng 0,3 điểm
| 1B | 2A | 3D | 4B | 5B |
| 6C | 7B | 8D | 9B | 10C |
Phần 2. Tự luận (7 điểm)
Câu 1.
a) P2O5 + H2O → H3PO4
b) Mg + 2HCl → MgCl2 + H2
c) 2KMnO4 → K2MnO4 + MnO2 + O2
d) 2K + H2O → 2KOH
e) C2H4 + 3O2 → 2CO2 + 2H2O
Câu 2. a
| Oxit axit | Oxit bazo | Tên gọi tương ứng |
| Na2O | Natri oxit | |
| Al2O3 | Nhôm oxit | |
| CO2 | Cacbonđioxit | |
| N2O5 | Đinito pentaoxit | |
| FeO | Sắt (II) oxit | |
| SO3 | Lưu trioxit | |
| P2O5 | Điphotpho pentaoxit |
b.
Gọi CT của oxit kim loại R là RO (x,y ∈N∈N*)
MR= 0,7143MR+ 11,4288
⇔ MR= 40
⇒ R là Ca
CTPT: CaO, tên gọi: Canxi oxit
Câu 3.
Phương trình hóa học.
2Mg + O2 2MgO
2Zn + O2 2ZnO
b) Áp dụng bảo toàn khối lượng
mhh + moxi = moxit => moxi = moxit - mhh = 36,1 - 23,3 = 12,8 gam
Số mol của oxi bằng
Gọi x, y lần lượt là số mol của Mg, Zn
2Mg + O2 2MgO
x → x/2
2Zn + O2 2ZnO
y y/2
Khối lượng hỗn hợp ban đầu: mhh = mMg +mZn = 24x + 65y = 23,3 (1)
Số mol của oxi ở cả 2 phương trình là: x/2 + y/2 = 0,4 (1)
Sử dụng phương pháp thế giải được x = nMg = 0,7mol, y =nZn = 0,1 mol
=> mMg = 0,7.24 = 16,8 gam
mZn = 0,1.65 = 6,5 gam
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 8
Phần 1. Câu hỏi trắc nghiệm (3 điểm)
Câu 1. Chất tác dụng với nước tạo ra dung dịch axit là:
A. K2O
B. CuO
C. P2O5
D. CaO
Câu 2. Tên gọi của oxit Cr2O3 là
A. Crom oxit
B. Crom (II) oxit
C. Đicrom trioxit
D. Crom (III) oxit
Câu 3. Đâu là tính chất của oxi
A. Không màu, không mùi, ít tan trong nước
B. Không màu, không mùi, tan nhiều trong nước
C. Không màu, có mùi hắc, ít tan trong nước
D. Màu trắng, không mùi, tan nhiều trong nước
Câu 4. Để bảo quản thực phẩm, người ta không sử dụng biện pháp nào sau đây?
A. Bơm khí CO2 vào túi đựng khí thực phẩm
B. Hút chân không
C. Dùng màng bọc thực phẩm
D. Bơm khí O2 vào túi đựng thực phẩm
Câu 5. Phản ứng nào dưới đây là phản ứng hóa hợp
A. NaOH + HCl → NaCl + H2O
B. 2Mg + O2 2MgO
C. 2KClO3 2KCl + 3O2
D. Na + H2O → 2NaOH + H2
Câu 6. Đốt cháy sắt thu được 0,2 mol Fe3O4. Thể tích khí oxi (đktc) đã dùng là
A. 8,96 lít
B. 4,48 lít
C. 2,24 lít
D. 3,36 lít
Câu 7. Trong phòng thí nghiệm, khí oxi được điều chế bằng cách đun nóng hợp chất nào sau đây?
A. KMnO4
B. H2O
C. CaCO3
D. Na2CO3
Câu 8. Điều kiện phát sinh phản ứng cháy là:
A. Chất phải nóng đến nhiệt độ cháy
B. Phải đủ khí oxi cho sự cháy.
C. Cần phải có chất xúc tác cho phản ứng cháy
D. Cả A & B
Câu 9. Khí Oxi không phản ứng được với chất nào dưới đây.
A. CO
B. C2H4
C. Fe
D. Cl2
Câu 10. Sự cháy và sự oxi hóa chậm đều là quá trình
A. Oxi hóa có tỏa nhiệt phát sáng
B. Oxi hóa có tỏa nhiệt, không phát sáng
C. Oxi hóa có phát sáng
D. Oxi hóa có tỏa nhiệt
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Viết phương trình hóa học của phản ứng xảy giữa oxi và các chất sau:
a) Na, Ca, Al, Fe.
b) S, SO2, C2H4
Câu 2. (2,5 điểm) Đốt cháy 12,4 gam photpho trong bình chứa 20,8 gam khí oxi tạo thành điphotpho pentaoxit P2O5 (là chất rắn, màu trắng).
a) Photpho hay oxi, chất nào còn dư và số mol chất dư là bao nhiêu?
b) Chất nào được tạo thành? Khối lượng là bao nhiêu?
Câu 3. (1,5 điểm) Phân loại các oxit sau thuộc oxit bazo, oxit axit
MgO, FeO, SO2, Fe2O3, SO3, P2O5, Na2O, CuO, ZnO, CO2, N2O, N2O5, SiO2, CaO
Câu 4. (1 điểm) Đốt nóng 2,4 gam kim loại M trong khí oxi dư, thu được 4,0 gam chất rắn. Xác định kim loại M.
ĐÁP ÁN
Phần 1. Trắc nghiệm (3 điểm)
| 1C | 2C | 3A | 4B | 5B |
| 6A | 7A | 8D | 9D | 10D |
Phần 2. Tự luận (7 điểm)
Câu 1.
a) 4Na + O2 2Na2O
2Ca + O2 CaO
2Al + O2 2Al2O3
3Fe + 2O2 Fe3O4
b) S + O2 SO2
2SO2 + O2 2SO3
C2H4 + 3O2 2CO2 + 2H2O
Câu 2.
Số mol phopho: nP = mP/MP = 2,4/31 = 0,4 (mol)
Số mol oxi: nO2 = mO2 = 20,8/32 = 0,65 mol
Phương trình hóa học của phản ứng: 4P + 5O2 2P2O5
Trước phản ứng: 0,4 0,65 (mol)
Phản ứng: 0,4 0,5 0,2 (mol)
Sau phản ứng: 0 0,15 0,2 (mol)
a) So sánh tỉ lệ: nP/4 = 0,4/4 = 0,1 < nO2/4 = 0,65/5 = 0,13 => P phản ứng hết, oxi còn dư.
Tính toán theo số mol P.
Số mol oxi dư bằng: 0,65 - 0,5 = 0,15 mol
b) Chất được tạo thành là điphopho pentaoxit P2O5
Khối lượng P2O5 tạo thành: mP2O5 = n.M = 0,2.142 = 28,4 gam
Câu 3.
Oxit axit: SO2, SO3, P2O5, CO2, N2O, N2O5, SiO2
Oxit bazo: MgO, FeO, Fe2O3, Na2O, CuO, ZnO, CaO
Câu 4. Gọi hóa trị của M là n (đk: n nguyên dương)
Sơ đồ phản ứng: M + O2 M2On
Áp dụng định luật bảo toàn khối lượng:
mM + mO2 = mM2On => 2,4 + mO2 = 4,0 => mO2 = 3,6 gam => nO2 = 0,05 mol
Phương trình hóa học phản ứng:
4M + nO2 2M2On
0,05.4/n 0,05
Số mol kim loại M bằng: nM = 0,05.4/n = 0,2/n mol
Khối lượng kim loại M: mM = nM.M => M = 12n
Lập bảng:
| n | 1 | 2 | 3 |
| M | 12 (loại) | 24 (Mg) | 36 (loại) |
Vậy kim loại M là Mg
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 9
Phần 1. Câu hỏi trắc nghiệm (3 điểm)
Câu 1. Phần trăm khối lượng của Cu trong CuO là
| A. 60% | B. 70% | C. 80% | D. 50% |
Câu 2. Khi cho dây sắt cháy trong bình kín đựng khí oxi. Hiện tượng xảy ra đối với phản ứng trên là:
A. Sắt cháy sáng, có ngọn lửa màu đỏ, không khói, tạo các hạt nhỏ nóng đỏ màu nâu.
B. Sắt cháy sáng, không có ngọn lửa, tạo khói trắng, sinh ra các hạt nhỏ nóng chảy màu nâu.
C. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo các hạt nhỏ nóng chảy màu nâu.
D. Sắt cháy từ từ, sáng chói, có ngọn lửa, không có khói, tạo các hạt nhỏ nóng chảy màu nâu
Câu 3. Để điều chế 1 lượng khí oxi thì sử dụng hóa chất nào dưới đây để khối lượng dùng nhỏ nhất?
| A. H2O | B. KMnO4 | C. KNO3 | D. KClO3 |
Câu 4. Phản ứng nào sau đây là phản ứng phân hủy
A. 4P + 5O2 2P2O5
C. Fe(OH)3 Fe2O3 + 3H2O
C. CO + O2 CO2
D. 2Cu + O2 2CuO
Câu 5. Trong công nghiệp sản xuất khí oxi bằng cách
A. Chưng cất không khí
B. Lọc không khí
C. Hóa lỏng không khí, sau đó chiết lấy oxi
D. Hóa lỏng không khí, sau đó cho không khí lỏng bay hơi
Câu 6. Công thức hóa học của sắt oxit, biết Fe (III) là:
| A. Fe2O3 | B. Fe3O4 | C. FeO | D. Fe3O2 |
Câu 7. Cho biết ứng dụng nào dưới đây không phải của oxi?
A. Sử dụng trong đèn xì oxi - axetilen.
B. Cung cấp oxi cho bệnh nhân khó thở
C. Phá đá bằng hỗn hợp nổ có chứa oxi lỏng
D. Điều chế khí hidro trong phòng thí nghiệm
Câu 8. Sự cháy và sự oxi hóa chậm đều là quá trình
A. Oxi hóa có tỏa nhiệt phát sáng
B. Oxi hóa có tỏa nhiệt, không phát sáng
C. Oxi hóa có phát sáng
D. Oxi hóa có tỏa nhiệt
Câu 9. Chất tác dụng với nước tạo ra dung dịch bazơ là:
| A. K2O | B. CuO | C. CO | D. SO2 |
Câu 10. Chỉ ra các oxit bazơ: P2O5, CaO, CuO, BaO, Na2O, P2O3
A. P2O5, CaO, CuO
B. CaO, CuO, BaO, Na2O
C. BaO, Na2O, P2O3
D. P2O5, CaO, P2O3
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Hoàn thành phương trình hóa học sau
1) MgCl2 + KOH → .... + KCl
2) FeO + HCl → ..... + H2O
3) Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O
4) P + O2 → .....
5) NO2 + O2 + H2O → HNO3
Câu 2. (2 điểm) Phân loại và gọi tên các oxit sau: P2O5, Fe2O3, CuO, NO2, CaO, SO3, SiO2
Câu 3: (3 điểm) Cho 13 gam Kẽm tác dụng vứi 24,5 gam H2SO4, sau phản ứng thu được muối ZnSO4, khí hidro (đktc) và chất còn dư
a) Viết phương trình phản ứng hóa học
b) Tính thể tích (đktc) khí hidro sinh ra.
c) Tính khối lượng các chất còn lại sau phản ứng
ĐÁP ÁN
Phần 1. Trắc nghiệm
| 1C | 2C | 3A | 4A | 5D |
| 6A | 7D | 8D | 9A | 10B |
Phần 2. Tự luận
Câu 1.
1) MgCl2 + 2KOH → Mg(OH)2 + 2KCl
2) FeO + 2HCl → FeCl2 + H2O
3) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
4) 4P + 5O2 → 2P2O5
5) 4NO2 + O2 + 2H2O → 4HNO3
Câu 2.
Oxit axit: P2O5: Đi photpho pentaoxit, NO2: nito đioxit, SO3: lưu huỳnh trioxit, SiO2, Silic đioxit
Oxit bazo: Fe2O3: Sắt (III) oxit, CuO: Đồng oxit, CaO: Canxi oxit
Câu 3.
Hướng dẫn giải
a) Phương trình phản ứng hóa học:
Zn + H2SO4 (loãng) → ZnSO4 + H2
b) nZn = = 0,2 mol
nH2SO4= = 0,25 mol
Phương trình phản ứng hóa học: Zn + H2SO4 (loãng) → ZnSO4 + H2
Theo phương trình: 1 mol 1 mol 1 mol
Theo đầu bài: 0,2 mol 0,25 mol
Xét tỉ lệ:
Zn phản ứng hết, H2SO4 dư, phản ứng tính theo số mol Zn
Số mol của khí H2 phản ứng là: nZn = nH2 = 0,2 mol
Thể tích khí H2 bằng: VH2 = 0,2 . 22,4 = 4,48 lít
c) Chất còn lượng sau phản ứng là ZnSO4 và H2SO4 dư
Số mol của ZnSO4 bằng: nZnSO4 = nZn = 0,2 mol
Khối lượng của ZnSO4 bằng: mZnSO4 = 0,2 . 161 = 32,2 gam
Số mol của H2SO4 dư = Số mol của H2SO4 ban đầu - Số mol của H2SO4 phản ứng = 0,25 - 0,2 = 0,05 mol
Khối lương H2SO4 dư = 0,05 . 98 = 4,9 gam
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 10
Câu 1. Hoàn thành các PTHH (ghi rõ điều kiện phản ứng nếu có)
SO3 + H2O →
Al + O2 →
SO3 + H2O →
Na2O + H2O →
CaCO3 →
FeS2 + O2 → Fe2O3 + SO2
Câu 2.
a. Phân đạm urê, có công thức hoá học là (NH2)2CO. Phân đạm có vai trò rất quan trọng đối với cây trồng và thực vật nói chung, đặc biệt là cây lấy lá như rau.
- Khối lượng mol phân tử ure
- Hãy xác định thành phần phần trăm (theo khối lượng) của các nguyên tố N
b. Hãy tìm công thức hóa học của chất X có khối lượng mol MX= 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn lại O.
Câu 3. Điền các thông tin còn thiếu vào bảng sau:
|
Tên gọi oxit |
Công thức hóa học |
Phân loại |
|
Natri oxit |
|
|
|
|
SO2 |
|
|
|
Cl2O5 |
|
|
Sắt (III) oxit |
|
|
|
Đi nito penta oxit |
N2O5 |
|
|
|
CuO |
|
Câu 4. Đốt cháy 12,4 gam photpho trong bình chứa 20,8 gam khí oix tạo thành điphotpho pentaoxit P2O5 (là chất rắn, màu trắng)
a) Viết phương trình hóa học
b) Photpho hay oxi, chất nào còn dư và số mol chất dư là bao nhiêu?
c) Chất nào được tạo thành? Khối lượng là bao nhiêu?
ĐÁP ÁN
Câu 1.
SO3 + H2O → H2SO4
4Al + 3O2![]() 2Al2O3
2Al2O3
SO2 + O2 ![]() SO3
SO3
Na2O + H2O → NaOH
CaCO3 CaO + CO2
4FeS2 + 11O2![]() 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
Câu 2.
a) Xác định khối lượng mol của hợp chất.
M(NH2)2CO = 14.2+ 2.2 + 12 + 16 = 60 g/mol
Tính thành phần % của mỗi nguyên tố.
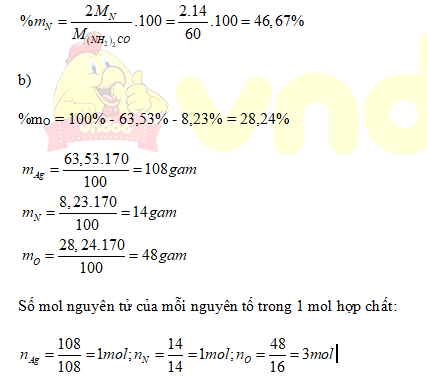
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất:
Phân tử hợp chất khí trên có: 1mol nguyên tử Ag; 1 mol nguyên tử N và 3 mol nguyên tử O.
Công thức hóa học của hợp chất trên là AgNO3
Câu 3.
|
Tên gọi oxit |
Công thức hóa học |
Phân loại |
|
Natri oxit |
Na2O |
Oxit bazo |
|
Lưu huỳnh đioxit |
SO2 |
Oxit axit |
|
dDdiclo pentaoxit |
Cl2O5 |
Oxit axit |
|
Sắt (III) oxit |
Fe2O3 |
Oxit bazo |
|
Đi nito penta oxit |
N2O5 |
Oxit axit |
|
Đồng (II) oxit |
CuO |
Oxit bazo |
Câu 4.
nP = 12,4/31 = 0,4 mol
nO2 = 20,8/32 = 0,65 mol
Phương trình hóa học:
4P + 5O2 ->2P2O5
Theo đề bài: 0,4 0,65 (mol)
Phản ứng: 0,4 0,5 0,2 (mol)
Sau phản ứng: 0 0,15 0,2 (mol)
So sánh tỉ lệ nP/4 = 0,4/4 = 0,12 < nO2/5 = 0,65/5 = 0,13 => P phản ứng hết, oxi còn dư. Tính toán theo số mol P.
Số mol dư bằng: 0,65 - 0,5 = 0,15 (mol)
c) Chất được tạp thành P2O5
mP2O5 = 0,2.142 = 28,4 (gam)
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 có đáp án đề số 11
Phần 1. Câu hỏi trắc nghiệm (3 điểm)
Câu 1. Phát biểu nào sau đây về oxi là không đúng
A. Oxi là phi kim hoạt động hoá học rất mạnh, nhất là ở nhịêt độ cao
B. Oxi không có mùi, không vị
C. Oxi tạo oxit axit với hầu hết kim loại
D. Oxi cần thiết cho sự sống
Câu 2. Trong những oxit sau: CuO, MgO, Fe2O3, CaO, Na2O. Oxit nào không bị Hidro khử:
A. CuO, MgO
B. Fe2O3, Na2O
C. Fe2O3, CaO
D. CaO, Na2O, MgO
Câu 3. Chất tác dụng với nước tạo ra dung dịch làm quỳ tím hóa xanh là:
A. BaO
B. Fe2O3
C. CO2
D. SO3
Câu 4. Dãy chất sau đây chỉ gồm các oxit bazơ
A. MgO; CaO; CuO; FeO
B. MgO; CO2; CaO; CO
C. SO2; CO2; MgO; CuO
D. CO2; SO2; MgO; BaO
Câu 5. Dãy hóa chất nào dưới đây dùng để điều chế oxi trong phòng thí nghiệm
A. Không khí, KMnO4
B. KMnO4, KClO3
C. NaNO3, KNO3
D. H2O, không khí
Câu 6. Phản ứng nào là phản ứng hóa hợp
A. Zn + H2SO4 loãng → ZnSO4+ H2↑
B. CaO + H2O → Ca(OH)2
C. CaCO3 CaO + CO2↑
D. Fe + 2HCl → FeCl2 + H2↑
Câu 7. Người ta thu khí oxi bằng cách đẩy không khí là nhờ dựa vào tính chất
A. khí oxi nhẹ hơn không khí
B. khí oxi ít tan trong nước
C. khí oxi dễ trộn lẫn với không khí
D. khí oxi nặng hơn không khí
Câu 8. Quá trình nào dưới đây không làm giảm lượng oxi trong không khí
A. Sự hô hấp của động vật
B. Sự cháy của than, củi, bếp ga
C. Sự gỉ của các vật dụng bằng sắt
D. Sự quang hợp của cây xanh
Câu 9. Hòa tan 11,28 gam K2O vào nước dư, thu được m gam KOH. Tính m
A. 6,72 gam.
B. 13,44 gam.
C. 8,4 gam.
D. 8,96 gam
Câu 10. Khi oxi hoá 9,6 gam kim loại R bằng oxi thu được 16 gam oxit RO. R là kim loại nào sau đây?
A. Fe
B. Ca
C. Mg
D. Pb
Phần 2. Tự luận (7 điểm)
Câu 1. (2 điểm) Hoàn thành phản ứng các phương trình hóa học sau
a) N2O5 + H2O → ....
b) Zn + HCl → .....+ .....
c) KMnO4 → ......+ ......+ O2
d) Ca(OH)2 + → CaCO3 + H2O
e) C2H6 + O2 → ......+ H2O
Câu 2. (2 điểm)
a. Trong dãy các oxit sau: SiO2; ZnO; CO2; Fe3O4; SO3; N2O5; NO2. Phân loại oxit và gọi tên tương ứng với mỗi oxit đó?
b. Trong một oxit của kim loại R (hóa trị III), nguyên tố oxi chiếm 30% về khối lượng. Tìm công thức phân tử và gọi tên của oxit trên.
Câu 3. (3 điểm) Đốt cháy một hỗn hợp gồm bột nhôm và magie trong đó bột magie là 2,4 gam cần 7,84 lít khí oxi (đktc).
a) Viết phương trình hóa học xảy ra.
c) Tính % về khối lượng của mỗi kim loại trong hỗn hợp.
Để xem trọn bộ Đề thi Hóa học 8 có đáp án, Thầy/ cô vui lòng Tải xuống!
Xem thêm các bộ đề thi Hoá học lớp 8 chọn lọc, hay khác:
Đề cương Giữa học kì 2 Hoá học lớp 8 năm 2023 chi tiết nhất
Bài tập Hóa học lớp 8 Giữa học kì 2 có đáp án
Các dạng bài tập Hóa học lớp 8 Giữa học kì 2
