Bài tập Hóa học lớp 8 Học kì 1 có đáp án
Bài tập Hóa học lớp 8 Học kì 1 có đáp án chi tiết giúp học sinh ôn luyện đạt điểm cao trong bài thi Hóa 8 Học kì 1. Mời các bạn cùng đón xem:
[Năm 2023] Bài tập Hóa học lớp 8 Học kì 1 có đáp án
A. Công thức hóa học và tính theo công thức hóa học
I. Lập công thức hóa học của hợp chất khi biết hóa trị
Các bước để xác định hóa trị
Bước 1: Viết công thức dạng AxBy
Bước 2: Đặt đẳng thức: x. hóa trị của A = y. hóa trị của B
Bước 3: Chuyển đổi thành tỉ lệ: xy=ba=b'= Hóa tri của B/Hóa trị của A
Chọn a’, b’ là những số nguyên dương và tỉ lệ b’/a’ là tối giản => x = b (hoặc b’); y = a (hoặc a’)
Ví dụ: Lập công thức hóa học của hợp chất sau: C (IV) và S (II)
Bước 1: Công thức hóa học của C (IV) và S (II) có dạng
Bước 2: Biểu thức quy tắc hóa trị: x.IV = y.II
Chuyển thành tỉ lệ:
Bước 3: Công thức hóa học cần tìm là: CS2
Bài tập vận dụng:
Bài tập 1: Lập công thức hóa học của các hợp chất sau:
a) C (IV) và S (II)
b) Fe (II) và O.
c) P (V) và O.
d) N (V) và O.
Bài tập 2: Lập công thức hóa học và tính phân tử khối của các hợp chất tạo bởi một nguyên tố và nhóm nguyên tử sau:
a) Ba (II) và nhóm (OH)
b) Cu (II) và nhóm (SO4)
c) Fe (III) và nhóm (SO4)
Bài tập số 3: Lập công thức hoá học của các hợp chất sau và tính phân tử khối:
|
a. Cu và O |
b. S(VI) và O |
c. K và (SO4) |
|
d. Ba và (PO4) |
e. Fe(III) và Cl |
f. Al và (NO3) |
|
g. P(V) và O |
h. Zn và (OH) |
k. Mg và (SO4) |
|
l. Fe(II) và (SO3) |
m. Ca và (CO3) |
|
Bài tập số 4: Trong các công thức hoá học sau đây, công thức hoá học nào sai? Sửa lại cho đúng: FeCl , ZnO2 , KCl , Cu(OH)2 , BaS, CuNO3 , Zn2OH, K2SO4 , Ca2(PO4)3, AlCl, AlO2, K2SO4, HCl, BaNO3, Mg(OH)3 ZnCl, MgO2, NaSO4, NaCl, Ca(OH)3, K2Cl, BaO2, NaSO4, H2O, Zn(NO3)2, Al(OH)2, NaOH2, SO3, Al(SO4)2.
II. Tính thành phần % theo khối lượng của các nguyên tố trong hợp chất AxByCz
Cách 1.
+ Tìm khối lượng mol của hợp chất
+ Tìm số mol nguyên tử mỗi nguyên tố trong 1 mol hợp chất rồi quy về khối lượng
+ Tìm thành phần phần trăm các nguyên tố trong hợp chất
Cách 2. Xét công thức hóa học: AxByCz
Hoặc %C = 100% - (%A + %B)
Ví dụ: Photphat tự nhiên là phân lân chưa qua chế biến hóa học, thành phần chính là canxi photphat có công thức hóa học là Ca3(PO4)2
Bước 1: Xác định khối lượng mol của hợp chất.
MCa3(PO4)2 = 40.3 + 31.2 + 16.4.2 = 310 g/mol
Bước 2: Xác định số mol nguyên tử của mỗi nguyên tó trong 1 mol hợp chất
Trong 1 mol Ca3(PO4)2 có: 3 mol nguyên tử Ca, 2 mol nguyên tử P và 8 mol nguyên tử O
Bước 3: Tính thành phần % của mỗi nguyên tố.
Bài tập vận dụng
Bài tập số 1: Phân đạm urê, có công thức hoá học là (NH2)2CO. Phân đạm có vai trò rất quan trọng đối với cây trồng và thực vật nói chung, đặc biệt là cây lấy lá như rau.
a) Khối lượng mol phân tử ure
b) Hãy xác định thành phần phần trăm (theo khối lượng) của các nguyên tố
Bài tập số 2: Tính thành phần phần trăm (theo khối lượng) của các nguyên tố hóa học có mặt trong các hợp chất sau:
a) Fe(NO3)2, Fe(NO3)2
b) N2O, NO, NO2
III. Lập công thức hóa học của hợp chất khi biết thành phần phần trăm (%) về khối lượng
Các bước xác định công thức hóa học của hợp chất
+ Bước 1: Tìm khối lượng của mỗi nguyên tố có trong 1 mol hợp chất.
+ Bước 2: Tìm số mol nguyên tử của nguyên tố có trong 1 mol hợp chất.
+ Bước 3: Lập công thức hóa học của hợp chất.
Ví dụ: Một hợp chất khí có thành phần % theo khối lượng là 82,35%N và 17,65% H. Xác định công thức hóa học của chất đó. Biết tỉ khối của hợp chất khí với hidro bằng 8,5.
Hướng dẫn giải
Khối lượng mol của hợp chất khí bằng: M = d,MH2 = 8.5,2 = 17 (gam/mol)
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất:
Trong 1 phân tử hợp chất khí trên có: 1mol nguyên tử N và 3 mol nguyên tử H.
Công thức hóa học của hợp chất trên là NH3
Bài tập vận dụng
Bài tập số 1: Một hợp chất có thành phần các nguyên tố theo khối lượng là: 40% Cu; 20% S và 40%O. Xác định công thức hóa học của chất đó. Biết hợp chất có khối lượng mol là 160g/mol.
Bài tập số 2: Hãy tìm công thức hóa học của chất X có khối lượng mol MX = 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn lại O.
Bài tập số 3: Lập công thức hóa học của hợp chất A biết:
- Phân khối của hợp chất là 160 đvC
- Trong hợp chất có 70% theo khối lượng sắt, còn lại là oxi.
IV. Lập công thức hóa học dựa vào tỉ lệ khối lượng của các nguyên tố.
1. Bài tập tổng quát: Cho một hợp chất gồm 2 nguyên tố A và B có tỉ lệ về khối lượng là a:b Hay . Tìm công thức của hợp chất
2. Phương pháp giải
Gọi công thức hóa học tổng quát của 2 nguyên tố có dạng là AxBy. (Ở đây chúng ta phải đi tìm được x, y của A, B. Tìm tỉ lệ: x:y => x,y)
CTHH
Ví dụ: Tìm công thức hóa học của một oxit sắt, biết tỷ lệ khối lượng của sắt và oxi là 7:3
Gọi công thức hóa học của oxit sắt cần tìm là: FexOy
Ta có:
CTHH: Fe2O3
Bài tập vận dụng
Bài tập số 1: Tìm công thức hóa học của một oxit nito, biết tỉ lệ khối lượng của nito đối với oxi là 7:16. Tìm công thức của oxit đó
Bài tập số 2: Phân tích một oxit của lưu huỳnh người ta thấy cứ 2 phần khối lượng S thì có 3 phần khối lượng oxi. Xác định công thức của oxit lưu huỳnh?
Bài tập số 3: Một hợp chất có tỉ lệ khối lượng của các nguyên tố Ca:N:O lần lượt là 10:7:24. Xác định công thức hóa học của hợp chất biết N và O hình thành nhóm nguyên tử, và trong nhóm tỉ lệ số nguyên tử của N: O = 1:3.
B. Phương trình hóa học. Tính theo phương trình hóa học.
I. Phương trình hóa học
1. Cân bằng phương trình hóa học
a) CuO + H2 → CuO
b) CO2 + NaOH → Na2CO3 + H2O
c) Zn + HCl → ZnCl2 + H2
d) Al + O2 →Al2O3
e) NaOH + CuSO4 → Cu(OH)2 + Na2SO4
f) Al2O3 + NaOH → NaAlO2 + H2O
g) Fe(OH)3 → Fe2O3 + H2O
h) H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
i) BaCl2 + AgNO3 → AgCl + Ba(NO3)2
k) FeO + H2SO4 → Fe2(SO4)3 + SO2 + H2O
2. Hoàn thành các phương trình hóa học sau:
1) Photpho + khí oxi →Photpho(V) oxit (P2O5)
2) Khí hiđro + oxit sắt từ (Fe3O4) → Sắt + Nước
3) Kẽm + axit clohidric → kẽm clorua + hidro
4) Canxi cacbonat + axit clohidric → canxi clorua + nước + khí cacbonic
5) Sắt + đồng (II) sunfat → Sắt (II) sunfat + đồng
3. Chọn CTHH thích hợp đặt vào những chỗ có dấu chấm hỏi và cân bằng các phương trình hóa học sau:
1) CaO + HCl →?+ H2
2) P + ? → P2O5
3) Na2O + H2O →?
4) Ba(NO3)2 + H2SO4 → BaSO4 + ?
5) Ca(HCO3)2 → CaCO3 + CO2 + ?
6) CaCO3 + HCl → CaCl2 + ? + H2O
7) NaOH + ? → Na2CO3 + H2O
4. Cân bằng các phương trình hóa học sau chứa ẩn
1) FexOy + H2 → Fe + H2O
2) FexOy + HCl → FeCl2y/x + H2O
3) FexOy + H2SO4 → Fe2(SO4)2y/x + H2O
4) M + H2SO4 → M2(SO4)n + SO2 + H2O
5) M + HNO3 → M(NO3)n + NO + H2O
6) FexOy + H2SO4 → Fe2(SO4)2y/x + SO2 + H2O
II. Tính theo phương trình hóa học
Các công thức tính toán hóa học cần nhớ
m = n.M (g)
Trong đó:
n: số mol của chất (mol)
m: khối lượng (gam)
M: Khối lượng mol (gam/mol)
V: thề tích chất (đktc) (lít)
Ví dụ: Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO.
a) Lập PTHH.
b) Tính khối lượng ZnO thu được?
c) Tính khối lượng oxi đã dùng?
Lời giải
a) PTHH: 2Zn + O2 → 2ZnO
b) Số mol Zn là: nZn = 13/65 = 0,2mol
PTHH: 2Zn + O2 → 2ZnO
Tỉ lệ PT: 2mol 1mol 2mol
0,2mol ? mol ? mol
Số mol ZnO tạo thành là: nZnO = (0,2.2)/2= 0,2mol
=> Khối lượng ZnO là: mZnO = 0,2 . 81 = 16,2 gam
c) Số mol khí O2 đã dùng là: nO2= (0,2.1)/2 = 0,1mol
=> Khối lượng O2 là: mO2 = n.M = 0,1.32 = 3,2gam
Bài tập củng cố
Bài tập số 1: Tính thể tích của oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P. Tính khối lượng của chất tạo thành sau phản ứng.
Bài tập số 2: Đốt cháy hoàn toàn 1,12 lít CH4. Tính thể tích oxi cần dùng và thể tích khí CO2 tạo thành (đktc).
Bài tập số 3: Biết rằng 2,3 gam một kim loại R (có hoá trị I) tác dụng vừa đủ với 1,12 lit khí clo (ở đktc) theo sơ đồ p/ư: R + Cl2 ---> RCl
a) Xác định tên kim loại R
b) Tính khối lượng hợp chất tạo thành
Bài tập số 4: Hòa tan hoàn toàn 6,75 gam kim loại nhôm trong dung dịch axit clohidric HCl dư. Phản ứng hóa học giữa nhôm và axit clohidric HCl được biểu diễn theo sơ đồ sau:
Al + HCl → AlCl3 + H2
a) Hãy lập phương trình hóa học của phản ứng.
b) Tính thể tích(ở đktc) của khí H2 sinh ra.
c) Tính khối lượng axit HCl đã tham gia phản ứng.
d) Tính khối lượng muối AlCl3 được tạo thành.
II. Bài toán về lượng chất dư
Giả sử có phản ứng hóa học: aA + bB ------- > cC + dD.
Cho nA là số mol chất A, và nB là số mol chất B
A và B là 2 chất phản ứng hết (vừa đủ)
Sau phản ứng thì A còn dư và B đã phản ứng hết
Sau phản ứng thì A phản ứng hết và B còn dư
Tính lượng các chất theo chất phản ứng hết.
Ví dụ. Cho 6,5 gam kẽm tác dụng với 36,5 g dung dịch HCl. Tính khối lượng muối tạo thành sau phản ứng.
;
Zn + 2HCl → ZnCl2 + H2
Theo phương trình: 1 mol 2 mol 1 mol
Theo đầu bài : 0,1 mol 0,1 mol 0,05 mol
Xét tỉ lệ: → Zn dư, Khối lượng các chất tính theo lượng HCl
Bài tập vận dụng:
Bài tập số 1: Khi cho miếng nhôm tan hết vào dung dịch HCl có chứa 0,2 mol thì sinh ra 1,12 lít khí hidro (đktc).
a. Tính khối lượng miếng nhôm đã phản ứng
b. Axit clohidric còn dư hay không? Nếu còn dư thì khối lượng dư là bao nhiêu?
Bài tập số 2: Cho 8,1g nhôm vào cốc đựng dung dịch loãng chứa 29,4g H2SO4.
a) Sau phản ứng nhôm hay axit còn dư?
b) Tính thể tích H2 thu được ở đktc?
c) Tính khối lượng các chất còn lại trong cốc?
Bài tập số 3: Cho một lá nhôm nặng 0,81g dung dịch chứa 2,19g HCl
a) Chất nào còn dư, và dư bao nhiêu gam
b) Tính khối lượng các chất thu được sau phản ứng là?
Bài tập số 4: Trộn 2,24 lít H2 và 4,48 lít khí O2 (đktc) rồi đốt cháy. Hỏi sau phản ứng khí nào dư, dư bao nhiêu lít? Tính khối lượng nước tạo thành?
Đề thi học kì môn Hóa học 8 Học kì 1
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
(Đề số 1)
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl=35,5, Fe=56, Al=27, N=14, S=32, Cu=64, Zn=65)
Câu 1: Hỗn hợp có thể tách riêng các chất thành phần bằng phương pháp lọc là:
A. Đường và muối.
B. Bột than và bột sắt.
C. Cát và muối.
D. Giấm và rượu
Câu 2: Hỗn hợp là sự trộn lẫn của mấy chất với nhau?
A. 2 chất trở lên
B. 3 chất
C. 4 chất
D. 2 chất
Câu 3: Tính chất nào sau đây cho ta biết đó là chất tinh khiết?
A. Không màu, không mùi.
B. Có vị ngọt, mặn hoặc chua.
C. Không tan trong nước.
D. Khi đun thấy sôi ở nhiệt độ xác định.
Câu 4: Hạt nhân nguyên tử được tạo bởi?
A. proton, nơtron.
B. proton, electron.
C. electron.
D. electron, nơtron.
Câu 5: Dãy chất nào sau đây chỉ kim loại?
A. Đồng, bạc, nhôm, magie.
B. Sắt, lưu huỳnh, cacbon, nhôm.
C. Cacbon, lưu huỳnh, photpho, oxi.
D. Bạc, oxi, sắt, nhôm.
Câu 6: Cho các chất có công thức hóa học sau: Na, O3, CO2, Cl2, NaNO3, SO3. Dãy công thức gồm các hợp chất là?
A. Na, O3, Cl2.
B. CO2, NaNO3, SO3.
C. Na, Cl2, CO2.
D. Na, Cl2, SO3.
Câu 7: Đơn chất là những chất được tạo nên từ bao nhiêu nguyên tố hóa học?
A. Từ 2 nguyên tố.
B. Từ 3 nguyên tố.
C. Từ 4 nguyên tố trở lên.
D. Từ 1 nguyên tố.
Câu 8: Dựa vào dấu hiện nào sau đây để phân biệt phân tử của đơn chất với phân tử của hợp chất?
A. Hình dạng của phân tử.
B. Kích thước của phân tử.
C. Số lượng nguyên tử trong phân tử.
D. Nguyên tử của cùng nguyên tố hay khác nguyên tố.
Câu 9: Biết Ca (II) và PO4 (III), vậy công thức hóa học đúng là:
A. CaPO4.
B. Ca3PO4.
C. Ca3(PO4)2.
D. Ca(PO4)2.
Câu 10: Ý nghĩa của công thức hóa học là?
A. Nguyên tố nào tạo ra chất
B. Phân tử khối của chất
C. Số nguyên tử mỗi nguyên tố có trong 1 phân tử của chất
D. Tất cả đáp án
Câu 11: Một oxit có công thức Al2Ox có phân tử khối là 102. Hóa trị của Al trong hợp chất oxit này là
A. I
B. III
C. II
D. IV
Câu 12: Phản ứng hoá học là quá trình biến đổi
A. Trạng thái tồn tại của chất.
B. Nguyên tử này thành nguyên tử khác
C. Chất này thành chất khác.
D. Nguyên tố này thành nguyên tố khác.
Câu 13: Đốt cháy than (C) trong oxi dư, thấy có khí cacbonic (CO2) thoát ra. Sản phẩm của phản ứng là:
A. Than
B. Khí cacbonic
C. Khí oxi
D. Than và khí oxi
Câu 14: Cho phương trình hóa học sau SO3 + H2O → H2SO4. Chất tham gia là?
A. SO3, H2SO4.
B. H2SO4.
C. H2O, H2SO4.
D. SO3, H2O.
Câu 15: Hiện tượng nào là hiện tượng vật lí?
A. Đập đá vôi sắp vào lò nung.
B. Làm sữa chua.
C. Muối dưa cải.
D. Sắt bị gỉ.
Câ 16: Phản ứng nào sau đây được cân bằng chưa đúng?
A. CaO + H2O → Ca(OH)2.
B. S + O2 → SO2.
C. NaOH + HCl → NaCl + H2O.
D. Cu(OH)2 + 2HCl → CuCl2 + H2O.
Câu 17: Trong các cách phát biểu về định luật bảo toàn khối lượng như sau, cách phát biểu nào đúng:
A. Tổng sản phẩm các chất bằng tổng chất tham gia
B. Trong một phản ứng, tổng số phân tử chất tham gia bằng tổng số phân tử chất tạo thành
C. Trong một phản ứng hoá học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng.
D. Không phát biểu nào đúng.
Câu 18: Cho phản ứng hóa học: A + B + C → D. Chọn đáp án đúng:
A. mA + mB = mC + mD
B. mA + mB + mC = mD
C. mA + mC = mB + mD
D. mA = mB + mC + mD
Câu 20: Đốt cháy 5 gam cacbon trong khí oxi, ta thu được 21 gam khí cacbonic. Khối lượng khí oxi cần dùng là:
A. 8 gam
B. 16 gam
C. 28 gam
D. 32 gam
Câu 21: Đốt cháy 1,5 gam kim loại Mg trong không khí thu được 2,5 gam hợp chất magie oxit MgO. Khối lượng khí oxi đã phản ứng là:
A. 1 gam
B. 1,2 gam
C. 1,5 gam
D. 1,1 gam
Câu 22: Cho phương trình hóa học: Fe + O2 Fe3O4. Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong phản ứng lần lượt là:
A. 1 : 2 : 1
B. 3 : 2 : 1
C. 3 : 4 : 1
D. 1 : 4 : 1
Câu 23: Cho sơ đồ phản ứng sau: BaCO3 + HCl BaCl2 + H2O + CO2
Chọn nhận định đúng, sau khi lập phương trình hóa học
A. Tỉ lệ phân tử BaCO3 : HCl = 2 : 1
B. Tỉ lệ phân tử BaCO3 : HCl = 1 : 2
C. Hệ số cân bằng của Na2CO3 , BaCl2, BaCO3, NaCl lần lượt là 1, 1, 1, 2.
D. Tỉ lệ phân tử BaCO3 : HCl = 3 : 1
Câu 24: Chất nào sau đây nặng hơn không khí?
A. SO2.
B. H2.
C. CH4.
D. N2.
Câu 25: Tỉ khối của khí B đối với oxi là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Khối lượng mol của khí A là:
A. 32 g/mol.
B. 34 g/mol.
C. 36 g/mol.
D. 28 g/mol.
Câu 26: Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là
A. 21,6
B. 16,2
C. 18,0
D. 27,0
Câu 27: Tính khối lượng khí H2 có trong 6,72 lít khí H₂ (đo ở đktc)?
A. 0,6 gam
B. 24,5 gam
C. 52,5 gam
D. 25,5 gam
Câu 28: Thành phần phần trăm theo khối lượng của nguyên tố Fe có trong hợp chất Fe2O3 là:
A. 70%
B. 30%
C. 40%
D. 60%
Câu 29: Hợp chất A có khối lượng mol là 94, có thành phần các nguyên tố là: 82,98% K; còn lại là oxi. Công thức hoá học của hợp chất A là
A. KO2
B. KO
C. K2O
D. KOH
Câu 30: Một hợp chất khí A có thành phần về khối lượng của các nguyên tố là 40% S và 60% O. Hãy xác định công thức hóa học của hợp chất khí A biết A có tỉ khối so với khí H2 là 40?
A. SO.
B. SO2.
C. SO3.
D. H2SO4.
---- Hết ----
Giám thị coi thi không giải thích gì thêm.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
(Đề số 2)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl=35,5, Fe=56, Al=27, N=14, S=32, Cu=64, Zn=65)
Câu 1: Chất tinh khiết là chất
A. có tính chất không đổi.
B. có lẫn thêm vài chất khác.
C. gồm những phân tử đồng dạng.
D. không lẫn tạp chất.
Câu 2: Nguyên tử sắt có điện tích hạt nhân là 26. Số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của sắt là:
A. 26
B. 48
C. 56
D. 65
Câu 3: Trong nguyên tử, hạt mang điện là
A. hạt proton, hạt nơtron
B. hạt proton, hạt electron
C. hạt nhân, proton và hạt electron
D. hạt nhân
Câu 4: Nguyên tử trung hòa về điện vì
A. Số proton bằng số nơtron
B. Số proton xấp xỉ số electron
C. Có cùng số proton
D. Số proton bằng số electron
Câu 5: Đơn chất là những chất được tạo nên từ bao nhiêu nguyên tố hóa học?
A. Từ 2 nguyên tố.
B. Từ 3 nguyên tố.
C. Từ 4 nguyên tố trở lên.
D. Từ 1 nguyên tố.
Câu 6: Cho những chất sau: Than chì (C), muối ăn (NaCl), khí ozon (O3), sắt (Fe), nước đá (H2O), khí oxi (O2), đá vôi (CaCO3). Có bao nhiêu hợp chất?
A. 1
B. 3
C. 5
D. 4
Câu 7: Phân tử khối của H2SO4 là:
A. 9 đvC.
B. 50 đvC.
C. 96 đvC.
D. 98 đvC.
Câu 8: Phân tử oxi có kí hiệu hóa học là:
A. O
B. O2
C. O3
D. O2
Câu 9: Hoá trị của Al trong các hợp chất AlCl3 (biết Cl có hoá trị I) là
A. I
B. II
C. III
D. IV
Câu 10: Biết Ba có hóa trị II và gốc (PO4) có hóa trị III. Vậy công thức hóa học của hợp chất tạo bởi nguyên tố Ba và gốc (PO4) là:
A. BaPO4
B. Ba2PO4
C. Ba3PO4
D. Ba3(PO4)2.
Câu 11: Cho phương trình hóa học: Fe + 2HCl → FeCl2 + H2↑. Chất tham gia phản ứng gồm:
A. Fe và H2.
B. Fe và HCl.
C. FeCl2 và H2.
D. HCl và FeCl2.
Câu 12: Thành phần phần trăm khối lượng của nguyên tố Na có trong Na2SO4 là
A. 25%.
B. 32,39%.
C. 31,66%.
D. 38%.
Câu 13: “Chất biến đổi trong phản ứng là.........., còn chất mới sinh ra gọi là.........”
A. chất xúc tác – sản phẩm
B. chất tham gia – chất phản ứng
C. chất phản ứng – sản phẩm
D. chất xúc tác – chất tạo thành
Câu 14: Hiện tượng nào sau đây là hiện tượng hóa học:
A. Bóng đèn điện sáng.
B. Thức ăn bị ôi thui
C. Cốc thủy tinh bị vỡ.
D. Muối ăn tan trong nước
Câu 15: Đâu là hiện tượng vật lí trong các hiện tượng sau:
A. Mặt trời mọc, sương tan dần.
B. Quá trình quang hợp của cây xanh.
C. Chưng đường ngả màu nâu đen.
D. Thức ăn bị ôi thiu.
Câu 16: Sắt cháy trong oxi, không có ngọn lửa nhưng sáng chói tạo ra hạt nhỏ nóng chảy màu nâu là oxit sắt từ, phương trình chữ của phản ứng hóa học là:
A. Sắt + Oxi Oxit sắt từ
B. Oxi + Oxit sắt từ Sắt
C. Oxit sắt từ Sắt + Oxi
D. Sắt + Oxit sắt từ Oxi
Câu 17: Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, phân tử của phản ứng: Na + O2 Na2O?
A. số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 4 : 1 : 2
B. số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 1 : 1 : 1
C. số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 2 : 1 : 2
D. số nguyên tử Na : số phân tử O2 : số phân tử Na2O = 2 : 1 : 1
Câu 18: Biết rằng kim loại Ba tác dụng với axit clohiđric tạo ra khí hiđro H2 và bari clorua BaCl2. Chọn nhận định đúng?
A. Phương trình phản ứng sau cân bằng Ba + HCl → BaCl2 + H2
B. 1 nguyên tử Ba phản ứng với 2 phân tử HCl
C. số phân tử Ba phản ứng bằng số phân tử H2 phản ứng
D. hệ số phản ứng sau khi cân bằng của Ba; HCl; BaCl2; H2 lần lượt là 1; 1; 1; 1
Câu 19: Đốt cháy m gam chất Y cần dùng 6,4 gam oxi thu được 4,4 gam khí CO2 và 3,6 gam H2O. Khối lượng m có giá trị nào sau đây:
A. 1,8 gam
B. 3,4 gam
C. 1,6 gam
D. 1,7 gam
Câu 20: Chọn đáp án đúng
A. Tổng khối lượng sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
B. Tổng khối lượng sản phẩm nhỏ hơn tổng khối lượng các chất tham gia phản ứng.
C. Tổng khối lượng sản phẩm lớn hơn tổng khối lượng các chất tham gia phản ứng.
D. Tổng khối lượng sản phẩm nhỏ hơn hoặc bằng tổng khối lượng các chất tham gia phản ứng.
Câu 21: Phương trình hoá học nào dưới đây biểu diễn đúng phản ứng cháy của rượu etylic tạo ra khí cacbon và nước.
A. C2H5OH + O2 CO2 + H2O
B. C2H5OH + O2 2CO2 + H2O
C. C2H5OH + O2 CO2 + 3H2O
D. C2H5OH + 3O2 CO2 + 6H2O
Câu 21: Câu nào sau đây đúng?
A. Trong phản ứng hoá học, các nguyên tử bị phá vỡ.
B. Trong phản ứng hoá học, liên kết trong các phân tử bị phá vỡ.
C. Trong phản ứng hoá học, liên kết trong các phân tử không bị phá vỡ.
D. Trong phản ứng hoá học, các phân tử được bảo toàn.
Câu 22: Cho sơ đồ phản ứng: Al(OH)y + H2SO4 → Alx(SO4)y + H2O
Với x y thì giá trị thích hợp của x, y lần lượt là:
A. 1 và 2
B. 2 và 3
C. 2 và 4
D. 3 và 4
Câu 23: A là oxit của lưu huỳnh có tỉ khối hơi so với phân tử oxi là 2. Vậy A có công thức phân tử là:
A. S
B. SO2
C. SO3
D. NO2
Câu 25: Khí N2 nặng hơn khí H2 bằng bao nhiêu lần?
A. 10 lần.
B. 12 lần.
C. 8 lần.
D. 14 lần.
Câu 26: Để đốt cháy hoàn toàn a gam Al cần dùng hết 19,2 gam oxi. Phản ứng kết thúc thu được sản phẩm là Al2O3. Giá trị của a là
A. 21,6
B. 16,2
C. 18,0
D. 27,0
Câu 27: Một hợp chất khí A có thành phần về khối lượng của các nguyên tố là 40% S và 60% O. Hãy xác định công thức hóa học của hợp chất khí A biết A có tỉ khối so với khí H2 là 40?
A. SO.
B. SO2.
C. SO3.
D. H2SO4.
Câu 28: Hợp chất A có khối lượng mol là 94, có thành phần các nguyên tố là: 82,98% K; còn lại là oxi. Công thức hoá học của hợp chất A là:
A. KO2
B. KO
C. K2O
D. KOH
Câu 29: Thành phần phần trăm về khối lượng của nguyên tố Fe trong hợp chất Fe3O4 là:
A. 72,4%.
B. 68,8%.
C. 76%.
D. 62,5%.
Câu 30: 0,5 mol khí CO2 đo ở điều kiện tiêu chuẩn (đktc) có thể tích là:
A. 22,4 lít
B. 11,2 lít
C. 44,8 lít
D. 24 lít.
---- Hết ----
Giám thị coi thi không giải thích gì thêm.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
(Đề số 3)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho C=12, O=16, H=1, Na=23, K=39, Mg=24, Ca=40, P=31, Cl=35,5, Fe=56, Al=27, N=14, S=32, Cu=64, Zn=65, Ne=40)
Câu 1: Đâu là chất tinh khiết trong các chất sau?
A. Nước khoáng
B. Nước mưa
C. Nước lọc
D. Nước cất
Câu 2: Một nguyên tử có 17 electron, cấu tạo của nguyên tử đó có bao nhiêu lớp electron?
A. 2
B. 3
C. 1
D. 4
Câu 3: Tính chất nào của chất trong số các tính chất sau đây có thể biết được bằng cách quan sát trực tiếp mà không cần dụng cụ đo hay làm thí nghiệm:
A. Màu sắc.
B. Tính tan trong nước.
C. Khối lượng riêng.
D. Dẫn nhiệt, dẫn điện.
Câu 4: Nguyên tử sắt có điện tích hạt nhân là 26. Số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của sắt là:
A. 26
B. 48
C. 56
D. 65
Câu 5: Phân tử khối của HCl là
A. 35,5 đvC.
B. 36,5 đvC.
C. 71 đvC.
D. 73 đvC.
Câu 6: Trong số các công thức hóa học sau: O2, N2, Al, Al2O3, H2, AlCl3, H2O, P. Số đơn chất là:
A. 4
B. 3
C. 5
D. 6
Câu 7: Dãy chất nào sau đây đều là hợp chất:
A. Cl2, KOH, H2SO4, AlCl3.
B. CuO, KOH, H2SO4, AlCl3.
C. CuO, KOH, Fe, H2SO4.
D. Cl2, Cu, Fe, Al.
Câu 8: Phân tử rượu etylic C2H5OH gồm mấy nguyên tử?
A. 10
B. 8
C. 9
D. 7
Câu 9: Một oxit có công thức Al2Ox có phân tử khối là 102. Hóa trị của Al trong hợp chất oxit này là
A. I
B. III
C. II
D. IV
Câu 10: Nguyên tố X có hóa trị III, công thức hợp chất của X với nhóm SO4 (II) là
A. XSO4
B. X(SO4)3
C. X2(SO4)3
D. X3SO4
Câu 11: Hiện tượng hoá học khác với hiện tượng vật lý là:
A. Chỉ biến đổi về trạng thái.
B. Có sinh ra chất mới.
C. Biến đổi về hình dạng.
D. Khối lượng thay đổi.
Câu 12: Hiện tượng nào sau đây không phải là hiện tượng hóa học?
A. Đốt cháy đường.
B. Thở hơi thở vào dung dịch nước vôi trong thấy có xuất hiện vẩn đục.
C. Đốt cháy cồn tạo thành khí cacbonic và hơi nước.
D. Mực hòa tan vào nước.
Câu 13: Phát biểu nào sau đây không đúng về phản ứng hóa học?
A. Phản ứng hóa học xảy ra sự thay đổi liên kết giữa các nguyên tử.
B. Khi phản ứng hóa học xảy ra, lượng chất tham gia tăng dần theo thời gian phản ứng.
C. Một số phản ứng hóa học cần xúc tác để phản ứng xảy ra nhanh hơn.
D. Chất kết tủa hoặc chất khí bay lên là dấu hiệu thể hiện phản ứng hóa học xảy ra.
Câu 14: Cho sơ đồ phản ứng hóa học: N2 + H2 NH3. Các hệ số đặt trước các phân tử N2, H2, NH3 lần lượt là
A. 1, 3, 2.
B. 1, 2, 3.
C. 2, 1, 3.
D. 3, 1, 2.
Câu 15: Cho phương trình phản ứng: aAl + bHCl → cAlCl3 + dH2. Các hệ số a, b, c, d nhận các giá trị lần lượt là:
A. 2, 6, 2, 3.
B. 2, 6, 3, 3.
C. 2, 6, 3, 2.
D. 6, 2, 2, 3.
Câu 16: Trong các mệnh đề sau, mệnh đề nào phản ánh bản chất của định luật bảo toàn khối lượng?
1. Trong phản ứng hoá học, nguyên tử được bảo toàn, không tự nhiên sinh ra và cũng không tự nhiên mất đi.
2. Tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất phản ứng.
3. Trong phản ứng hoá học, nguyên tử không bị phân chia.
4. Số phân tử các chất sản phẩm bằng số phân tử các chất phản ứng.
A. 1 và 4
B. 1 và 3
C. 3 và 4
D. 1
Câu 17: Đốt cháy hoàn toàn 13,4 gam hỗn hợp X gồm: Fe, Al và Cu trong 2,24 lít khí O2 (đktc), sau phản ứng thu được m gam chất rắn. Giá trị của m là: (biết oxi phản ứng hết)
A. 16,6 gam.
B. 13,4 gam.
C. 22,2 gam.
D. 14,8 gam.
Câu 18: Tính thể tích của khí oxi (đktc) cần dùng để đốt cháy hết 3,1 gam P, biết phản ứng sinh ra chất rắn P2O5.
A. 1,4 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 2,8 lít.
Câu 19: Trong phản ứng hóa học, các chất tham gia và các chất sản phẩm đều có cùng
A. số nguyên tử của mỗi nguyên tố.
B. số nguyên tố tạo nên chất.
C. số phân tử của mỗi chất.
D. số nguyên tử trong mỗi chất.
Câu 20: Trong phản ứng sau chất nào là sản phẩm ?
Axit clohiđric + kali cacbonat → kali clorua + cacbon đioxit + nước
A. Axit clohiđric, kali clorua.
B. Kali clorua, cacbon đioxit.
C. Cacbon đioxit, nước.
D. Kali clorua, cacbon đioxit, nước.
Câu 21: 0,25 mol phân tử Al₂O₃ có khối lượng là bao nhiêu?
A. 10,2 gam
B. 24,5 gam
C. 52,5 gam
D. 25,5 gam
Câu 22: Tính số mol phân tử có trong 6,72 lít khí H₂ (đo ở đktc)?
A. 0,3mol
B. 0,5mol
C. 1,2 mol
D. 1,5mol
Câu 23: 1 mol khí cacbonic (CO2) có thể tích là bao nhiêu ở điều kiện tiêu chuẩn?
A. 24 lít
B. 2,24 lít
C. 22,4 lít
D. 4,48 lít
Câu 24: Phần trăm theo khối lượng của K trong phân tử K2CO3 là:
A. 56,502%
B. 56,52%
C. 56,3%
D. 56,56%
Câu 25: Thành phần phần trăm khối lượng của oxi trong Fe2O3 là:
A. 35%
B. 40%
C. 30%
D. 45%
Câu 26: Oxit chứa 20% oxi về khối lượng và trong đó nguyên tố chưa biết có hoá trị II. Oxit có công thức hoá học là:
A. MgO
B. ZnO
C. CuO
D. FeO
Câu 27: A là hợp chất CxHy có tỉ khối hơi đối với H2 là 15, biết cacbon chiếm 80% khối lượng phân tử. Công thức phân tử của CxHy là
A. CH4
B. C3H6
C. C2H6
D. C2H2
Câu 28: Hỗn hợp khí CO và CO2 có tỉ khối so với O2 là 1. Thể tích khí CO2 cần thêm vào 8,96 lít hỗn hợp trên (đktc) để có tỉ khối so với O2 tăng lên bằng 1,075 là:
A. 2,24 lít
B. 1,12 lít
C. 11,2 lít
D. 22,4 lít
Câu 29: A là oxit của lưu huỳnh có tỉ khối hơi so với Ne là 3,2. Vậy A có công thức phân tử là:
A. SO2
B. CO2
C. SO3
D. NO2
Câu 30: Có thể thu được những khí nào vào bình (từ những thí nghiệm trong phòng thí nghiệm): khí H2, N2, CH4, O2 bằng cách đặt ngửa bình?
A. H2
B. CH4
C. N2
D. O2
---- Hết ----
Giám thị coi thi không giải thích gì thêm.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
(Đề số 4)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho C=12, O=16, H=1, Na=23, K=39, Mg=24, Ca=40, P=31, Cl=35,5, Fe=56, Al=27, N=14, S=32, Cu=64, Zn=65, Ne=20, Ag=108)
Câu 1: Câu sau đây ý nói về nước cất: “Nước cất là chất tinh khiết, sôi ở 100oC”. Hãy chọn phương án đúng trong số các phương án sau:
A. Cả 2 ý đều đúng.
B. Cả 2 ý đều sai.
C. Ý 1 đúng, ý 2 sai.
D. Ý 1 sai, ý 2 đúng.
Câu 2: Trong hạt nhân nguyên tử, thì gồm những hạt nào?
A. Proton,electron.
B. Proton, notron
C. Electron.
D. Proton,electron, notron
Câu 3: Chọn đán án đúng nhất
A. Trong nguyên tử có số p = số e
B. Hạt nhân tạo bởi proton và electron
C. Electron không chuyển động quanh hạt nhân
D. Eletron chuyển động hỗn loạn và không sắp xếp theo từng lớp
Câu 4: Nguyên tử cacbon có điện tích hạt nhân là 6+. Số electron lớp ngoài cùng của cacbon là:
A. 6
B. 4
C. 2
D. 1
Câu 5: Cho dãy các chất có công thức hóa học: HCl, H2, NaOH, KMnO4, O2, N2, NaClO. Có bao nhiêu hợp chất?
A. 1
B. 2
C. 3
D. 4
Câu 6: Dựa vào dấu hiện nào sau đây để phân biệt phân tử của đơn chất với phân tử của hợp chất?
A. Hình dạng của phân tử.
B. Kích thước của phân tử.
C. Số lượng nguyên tử trong phân tử.
D. Nguyên tử của cùng nguyên tố hay khác nguyên tố.
Câu 7: Phân tử khối của hợp chất Fe(OH)3 bằng:
A. 107 đvC.
B. 107 gam.
C. 73 đvC.
D. 73 gam.
Câu 8: Những nguyên tố tạo nên canxi cacbonat (CaCO3) có trong vỏ trứng là:
A. Ba, C, O.
B. Ca, C, O.
C. K, C, O.
D. C, P, O.
Câu 9: Nguyên tử P có hóa trị V trong hợp chất nào sau đây?
A. P2O3
B. P2O5
C. P4O4
D. P4O10
Câu 10: Biết Cr hoá trị III và O hoá trị II. Công thức hoá học nào sau đây viết đúng?
A. Cr2O3
B. CrO
C. CrO2
D. CrO3
Câu 11: Đâu là hiện tượng hóa học trong các hiện tượng dưới đây?
A. Nước sôi
B. Nước bốc hơi
C. Nước đóng băng
D. Nước bị phân hủy tạo thành khí oxi và khí hiđro
Câu 12: Hiện tượng vật lí là hiện tượng chất biến đổi mà:
A. Có chất mới sinh ra.
B. Vẫn giữ nguyên là chất ban đầu.
C. Có chất rắn tạo thành.
D. Có chất khí tạo thành.
Câu 13: Dấu hiệu của phản ứng hóa học xảy ra là:
A. Thay đổi màu sắc
B. Tạo chất bay hơi
C. Tạo chất kết tủa
D. Tất cả đáp án
Câu 14: Có phương trình hóa học sau:
2Al + 3CuO Al2O3 + 3Cu
Tỉ lệ số nguyên tử, phân tử của các chất trong phương trình bằng:
A. 2 : 3 : 2 : 3.
B. 2 : 3 : 1 : 2.
C. 2 : 3 : 1 : 3.
D. Kết quả khác.
Câu 15: Biết rằng kim loại Mg tác dụng với axit sunfuric H2SO4 tạo ra khí hiđro (H2) và chất magie sunfat MgSO4. Chọn nhận định đúng
A. Phương trình phản ứng sau cân bằng: Mg + H2SO4 → MgSO4 + H2
B. 1 nguyên tử Mg phản ứng với 2 phân tử H2SO4.
C. Số phân tử Mg phản ứng bằng số phân tử H2 phản ứng.
D. Hệ số phản ứng sau khi cân bằng của Mg, H2SO4, MgSO4, H2 lần lượt là 3; 2; 1; 1
Câu 16: Cho 13,2 gam hỗn hợp gồm magie, sắt và kẽm cháy trong khí oxi, thu được 18 gam hỗn hợp chất rắn. Khối lượng oxi tham gia phản ứng là:
A. 3,2 gam.
B. 4,8 gam.
C. 9,6 gam.
D. 12,8 gam.
Câu 17: Cho phản ứng hóa học: A+ B + C → D. Chọn đáp án đúng:
A. mA + mB = mC + mD
B. mA + mB + mC = mD
C. mA + mC = mB + mD
D. mA = mB + mC + mD
Câu 18: Các câu sau, câu nào sai?
A. Trong phản ứng hóa học, khi chất biến đổi làm các nguyên tử bị biến đổi.
B. Trong phương trình hoá học, cần đặt hệ số thích hợp vào công thức của các chất sao cho số nguyên tử của mỗi nguyên tố ở 2 vế đều bằng nhau.
C. Trong phản ứng hoá học, biết tổng khối lượng của các chất phản ứng ta biết được tổng khối lượng các sản phẩm.
D. Trong phản ứng hoá học, màu sắc của các chất có thẻ bị thay đổi
Câu 19: Cho nhôm (Al) tác dụng với axit sunfuric (H2SO4) thu được muối nhôm sunfat (Al2(SO4)3) và khí H2. Phương trình phản ứng nào sau đây đã viết đúng?
A. Al + H2SO4 → Al2(SO4)3 + H2
B. 2Al + H2SO4 → Al2(SO4)3 + H2
C. Al + 3H2SO4 → Al2(SO4)3 + 3H2
D. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Câu 20: Khi nung đá vôi ở nhiệt độ cao người ta thu được các sản phẩm là cacbon đioxit và canxi oxit. Chọn phương trình chữ đúng với phản ứng trên?
A. Canxi oxit + cacbon đioxit → Canxi cacbonat
B. Canxi oxit → Canxi cacbonat + cacbon đioxit
C. Canxi cacbonat → Canxi oxit + cacbon đioxit
D. Canxi cacbonat + Canxi oxit → Cacbon đioxit
Câu 21: Thành phần phần trăm khối lượng của oxi trong Fe2O3 là:
A. 35%
B. 40%
C. 30%
D. 45%
Câu 22: Đốt cháy hoàn toàn 1,12 lít khí CH4 (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được sản phẩm là khí cacbonic (CO2) và nước (H2O). Giá trị của V là:
A. 2,24
B. 1,12
C. 3,36
D. 4,48
Câu 23: Một hợp chất khí có thành phần phần trăm theo khối lượng là: 82,35%N và 17,65% H. Công thức của hợp chất khí là:
A. N3H.
B. NH3.
C. NH2.
D. N2H
Câu 24: Phân tích một khối lượng của hợp chất M, người ta nhận thấy thành phần khối lượng của nó có 50% là lưu huỳnh và 50% là oxi. Công thức của hợp chất M có thể là:
A. SO2
B. SO3
C. SO4
D. S2O3
Câu 25: Khí nào có thể thu được bằng cách đặt ngược bình (hình vẽ):
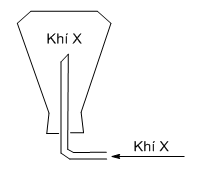
A. Khí cacbonic (CO2).
B. Khí oxi (O2).
C. Khí clo (Cl2).
D. Khí hiđro (H2).
Câu 26: A là oxit của lưu huỳnh có tỉ khối hơi so với Ne là 3,2. Vậy A có công thức phân tử là:
A. SO2
B. CO2
C. SO3
D. NO2.
Câu 27: Tỉ khối của hỗn hợp chứa N2 và O2 theo tỉ lệ về thể tích là 1:2 so với không khí là:
A.
B.
C.
D.
Câu 28: Thể tích của hỗn hợp khí gồm 0,5 mol CO2, và 0,2 mol O2 ở điều kiện tiêu chuẩn là
A. 11,2 lít
B. 22,4 lít
C. 4,48 lít
D. 15,68 lít
Câu 29: Khối lượng của 1 mol nguyên tử Ag là:
A. 27 gam.
B. 35 gam.
C. 100 gam.
D. 108 gam.
Câu 30: Số mol nguyên tử tương ứng với 10,0 gam hợp chất CaCO3 là
A. 0,5 mol.
B. 10,0 mol.
C. 0,1 mol.
D. 0,25 mol.
---- Hết ----
Giám thị coi thi không giải thích gì thêm.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
(Đề số 5)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho C=12, O=16, H=1, Na=23, K=39, Mg=24, Ca=40, P=31, Cl=35,5, Fe=56, Al=27, N=14, S=32, Cu=64, Zn=65)
Câu 1: Để tách rượu ra khỏi hỗn hợp rượu lẫn nước, dùng cách nào sau đây?
A. Lọc
B. Dùng phễu chiết
C. Chưng cất phân đoạn
D. Đốt
Câu 2: Việc hiểu biết tính chất của chất có lợi gì?
A. Giúp phân biệt chất này với chất khác, tức nhận biết được chất.
B. Biết cách sử dụng chất.
C. Biết ứng dụng chất thích hợp trong đời sống và sản xuất.
D. Cả ba ý trên.
Câu 3: Hầu hết các nguyên tử được cấu tạo bởi các hạt:
A. p và n.
B. n và e.
C. e và p.
D. n, p và e.
Câu 4: Chọn đáp án sai?
A. Khối lượng của hạt nhân được coi là khối lượng của nguyên tử.
B. Trong nguyên tử, số proton và số electron bằng nhau.
C. Hạt nhân tạo bởi proton và nơtron.
D. Hạt mang điện tích âm là electron, hạt mang điện tích dương là nơtron.
Câu 5: Phân tử khối của CH4, Mg(OH)2, KCl lần lượt là
A. 16 đvC, 74,5 đvC, 58 đvC.
B. 74,5 đvC, 58 đvC, 16 đvC.
C. 17 đvC, 58 đvC, 74,5 đvC.
D. 16 đvC, 58 đvC, 74,5 đvC.
Câu 6: Đơn chất là chất được tạo nên từ:
A. một chất
B. một nguyên tố hóa học
C. một nguyên tử
D. một phân tử
Câu 7: Dãy chất nào sau đây đều là hợp chất:
A. Cl2, KOH, H2SO4, AlCl3.
B. CuO, KOH, H2SO4, AlCl3.
C. CuO, KOH, Fe, H2SO4.
D. Cl2, Cu, Fe, Al.
Câu 8: Chọn đáp án sai?
A. CO là phân tử gồm nguyên tố C và nguyên tố O.
B. Ca là công thức hóa học của canxi.
C. Al2O3 có 2 nguyên tử nhôm và 2 nguyên tử oxi trong phân tử.
D. Fe3O4 gồm 3 nguyên tử Fe và 4 nguyên tử O.
Câu 9: Hợp chất được cấu tạo từ nitơ (N) hoá trị II và oxi (O) hoá trị II là:
A. N2O.
B. NO.
C. NO2.
D. N2O5.
Câu 10: Một oxit có công thức Al2Ox có phân tử khối là 102. Hóa trị của Al trong hợp chất oxit này là:
A. I
B. III
C. II
D. IV
Câu 11: Trong 1 phản ứng hoá học, các chất phản ứng và sản phẩm giữ nguyên:
A. số nguyên tử của mỗi nguyên tố.
B. số phân tử trong mỗi chất.
C. số phân tử của mỗi chất.
D. số nguyên tố tạo ra chất.
Câu 12: Trong quá trình phản ứng, lượng chất phản ứng:
A. Giữ nguyên.
B. Tăng
C. Giảm dần
D. Cả A, B, C.
Câu 13: Cho các quá trình sau, đâu là quá trình hóa học?
A. Đường kính hòa tan vào nước tạo thành nước đường.
B. Nước đường cô cạn thành đường kính.
C. Đường kính nung nóng chảy ở nhiệt độ vừa phải tạo thành chất lỏng trong.
D. Đường nóng chảy ở nhiệt độ cao sau một thời gian chuyển thành than.
Câu 14: Biết rằng khí etilen C2H4 cháy là phản ứng xảy ra với oxi O2, sinh ra CO2 và nước. Lập phương trình hóa học của phản ứng và cho biết phát biểu nào sau đây sai?
A. số phân tử oxi : số phân tử etilen = 3 : 1.
B. số phân tử etilen : số phân tử cacbon đioxit = 1 : 2.
C. hệ số cân bằng của C2H4 , O2, CO2, H2O lần lượt là 1, 3, 2, 2.
D. số phân tử etilen : số nguyên tử oxi = 1 : 3.
Câu 15: Hãy điền hệ số thích hợp vào trước công thức hóa học để được phương trình hóa học đúng: …. H2 + …. O2 → …… H2O
A. 1, 2, 1.
B. 2, 1, 1.
C. 2, 1, 2.
D. 1, 2, 2.
Câu 16: Khi phản ứng hóa học xảy ra có chất mới tạo thành nhưng tổng khối lượng của các chất vẫn không đổi là vì:
A. Trong phản ứng hóa học chỉ có liên kết giữa các nguyên tử thay đổi.
B. Trong phản ứng hóa học, số nguyên tử của mỗi nguyên tố trước và sau phản ứng thay đổi.
C. Trong phản ứng hóa học, liên kết giữa các nguyên tử trước và sau phản ứng thay đổi.
D. Trong phản ứng hóa học các phân tử thay đổi.
Câu 17: Trong các phương trình sau, phương trình nào cân bằng sai?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2H2 + O2 → 2H2O
C. 2Al + 3O2 → 2Al2O3
D. Zn + 2HCl → ZnCl2 + H2
Câu 18: Đốt cháy hoàn toàn 4,5 gam kim loại Mg trong khí oxi, sau phản ứng được 7,5 gam hợp chất MgO. Khối lượng của oxi đã tham gia phản ứng là
A. 12,0 gam.
B. 3,0 gam.
C. 4,5 gam.
D. 5,5 gam.
Câu 19: Cho phương trình: Cu + O2 CuO. Phương trình cân bằng đúng là:
A.-2Cu + O2 → CuO
B. 2Cu + 2O2 → 4CuO
C. Cu + O2 → 2CuO
D. 2Cu + O2 → 2CuO
Câu 20: Đốt cháy hoàn toàn 13 gam Zn trong oxi thu được ZnO. Thể tích khí oxi đã dùng (đktc) là
A. 11,2 lít.
B. 3,36 lít.
C. 2,24 lít.
D. 4,48 lít.
Câu 21: Oxit chứa 20% oxi về khối lượng và trong đó nguyên tố chưa biết có hoá trị II. Oxit có công thức hoá học là:
A. MgO
B. ZnO
C. CuO
D. FeO
Câu 22: Phân tích một khối lượng hợp chất M, người ta nhận thấy thành phần khối lượng của nó có 50% là lưu huỳnh và 50% là oxi. Công thức của hợp chất M có thể là:
A. SO2
B. SO3
C. SO4
D. S2O3
Câu 23: Khí N2 nhẹ hơn khí nào sau đây?
A. H2.
B. NH3.
C. C2H2.
D. O2.
Câu 24: Hỗn hợp khí O2 và khí CO2 có tỉ khối đối với khí hiđro là 19, thành phần phần trăm các khí trong hỗn hợp lần lượt là:
A. 60% và 25%.
B. 75% và 40%.
C. 50% và 50%.
D. 70% và 30%.
Câu 25: Khí N2 nặng hơn khí H2 bằng bao nhiêu lần?
A. 10 lần.
B. 12 lần.
C. 8 lần.
D. 14 lần.
Câu 26: Tính khối lượng khí H2 có trong 6,72 lít khí H₂ (đo ở đktc)?
A. 0,6 gam
B. 24,5 gam
C. 52,5 gam
D. 25,5 gam
Câu 27: Ở điều kiện tiêu chuẩn, thể tích mol của các chất khí có giá trị là:
A. 2,24 lít
B. 22,4 lít
C. 0,224 lít
D. 24 lít.
Câu 28: Tính số mol nguyên tử có trong 9.10²³ nguyên tử oxi?
A. 1 mol
B. 5 mol
C. 1,2 mol
D. 1,5 mol
Câu 29: Phần trăm khối lượng của K trong phân tử K2CO3 là:
A. 56,502%
B. 56,52%
C. 56,3%
D. 56,56%
Câu 30: Tính phần trăm khối lượng C, biết trong 1 mol NaHCO3 có 1 mol Na, 1 mol C, 3 mol O và 1 mol H?
A. 14,28 %
B. 14,2%
C. 14,284%
D. 14,285%
---- Hết ----
Giám thị coi thi không giải thích gì thêm.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
(Đề số 6)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: ..................................................................... Lớp: .............................
(Cho C=12, O=16, H=1, Na=23, K=39, Mg=24, Ca=40, P=31, Cl=35,5, Fe=56, Al=27, N=14, S=32, Cu=64, Zn=65, He=4)
Câu 1: Tính chất nào của chất trong số các tính chất sau đây có thể biết được bằng cách quan sát trực tiếp mà không cần dụng cụ đo hay làm thí nghiệm:
A. Màu sắc.
B. Tính tan trong nước.
C. Khối lượng riêng.
D. Dẫn nhiệt, dẫn điện.
Câu 2: Có thể tách muối ra khỏi hỗn hợp nước muối bằng cách:
A. Thêm muối
B. Thêm nước
C. Đông lạnh
D. Đun nóng
Câu 3: Trong hạt nhân nguyên tử, thì gồm những hạt nào?
A. Proton, electron.
B. Proton, nơtron
C. Electron.
D. Proton, electron, nơtron
Câu 4: Vì sao nguyên tử có khả năng liên kết với nhau?
A. Do có electron.
B. Do có nơtron.
C. Tự dưng có sẵn.
D. Do khối lượng hạt nhân bằng khối lượng nguyên.
Câu 5: Khi đun nóng, đường bị phân hủy, biến đổi thành than (C) và nước (H2O). Như vậy, phân tử đường do những nguyên tử của nguyên tố nào tạo nên? Đường là đơn chất hay hợp chất?
A. Đường tạo nên từ 2 nguyên tố C và O. Đường là hợp chất.
B. Đường tạo nên từ 3 nguyên tố C, H và O. Đường là đơn chất.
C. Đường tạo nên từ nguyên tố C. Đường là đơn chất.
D. Đường tạo nên từ 3 nguyên tố C, H và O. Đường là hợp chất.
Câu 6: Trong số các công thức hóa học sau: O2, N2, Al, Al2O3, H2, AlCl3, H2O, P. Số đơn chất là
A. 4
B. 3
C. 5
D. 6
Câu 10: Chất có phân tử khối bằng nhau là (biết O = 16, N = 14, S = 32, C = 12):
A. O3 và N2.
B. CO và N2.
C. SO2 và O2.
D. NO2 và SO2.
Câu 11: Từ công thức hóa học của CuSO4 có thể suy ra được những gì?
A. CuSO4 do 3 nguyên tố Cu, O, S tạo nên.
B. Có 3 nguyên tử oxi trong phân tử.
C. Có 2 nguyên tử S trong phân tử
D. Tất cả đáp án.
Câu 12: Công thức hóa học của nguyên tố nhôm Al (III) và gốc sunfat (SO4) (II) là
A. Al3(SO4)2.
B. Al2(SO4)3.
C. AlSO4.
D. Al2SO4.
Câu 13: Hoá trị của S, nhóm (PO4) trong các công thức hóa học sau: H2S và H3PO4 lần lượt là:
A. III và II.
B. I và III.
C. III và I.
D. II và III.
Câu 14: Trong các câu sau, câu nào chỉ hiện tượng hóa học:
A. Đinh sắt bị gỉ trong không khí.
B. Dây tóc bóng đèn sáng.
C. Cồn trong lọ bị bay hơi.
D. Nước bốc hơi.
Câu 15: Trong các hiện tượng sau, đâu là hiện tượng vật lí?
A. Điều chế nhôm (Al) nguyên chất từ quặng boxit (Al2O3).
B. Người ta để nước biển bay hơi thu được muối ăn.
C. Trứng để lâu ngày bị thối gây mùi rất khó chịu.
D. Làm sữa chua từ sữa tươi.
Câu 16:
Câu 17: Cho sơ đồ phản ứng: Nhôm + khí oxi → Nhôm oxit, chất sản phẩm là
A. Nhôm
B. Oxi
C. Nhôm và oxi
D.Nhôm oxit.
Câu 18: Cho phương trình phản ứng: aAl + bHCl → cAlCl3 + dH2. Các hệ số a, b, c, d nhận các giá trị lần lượt là:
A. 2, 6, 2, 3.
B. 2, 6, 3, 3.
C. 2, 6, 3, 2.
D. 6, 2, 2, 3.
Câu 19: Phương trình hóa học nào sau đây cân bằng đúng?
A. HCl + Zn → ZnCl2 + H2↑
B. 2HCl + Zn → ZnCl2 + H2↑
C. 3HCl + Zn → ZnCl2 + H2↑
D. 2HCl + 2Zn → 2ZnCl2 + H2↑
Câu 20: Nếu nung 5 tấn canxi cacbonat sinh ra 2,2 tấn khí cacbonic và canxi oxit? Khối lượng canxi oxit là:
A. 7,2 tấn
B. 2,8 tấn
C. 3,2 tấn
D. 5,6 tấn
Câu 21: Trong một phản ứng hóa học, tổng khối lượng các chất tham gia phản ứng như thế nào với tổng khối lượng các chất tạo thành sau phản ứng?
A. Bằng nhau
B. Lớn hơn
C. Nhỏ hơn
D. Có thể lớn hơn hoặc nhỏ hơn tùy vào từng phản ứng
Câu 16: Cho sơ đồ phản ứng sau: Al + CuO Al2O3 + Cu. Phương trình cân bằng đúng là:
A. 2Al + 3CuO Al2O3 + 3Cu
B. 2Al + 2CuO Al2O3 + 3Cu
C. 2Al + 3CuO Al2O3 + 2Cu
D.4 Al + CuO Al2O3 + Cu
Câu 17: Hiđro và oxi tác dụng với nhau tạo thành nước. Phương trình hoá học ở phương án nào dưới đây đã viết đúng?
A. 2H + O H2O
B. H2 + O H2O
C. H2 + O2 2H2O
D. 2H2 + O2 2H2O
Câu 18: Điều kiện để một phản ứng hóa học xảy ra là:
A. không thể thiếu chất xúc tác.
B. các chất phản ứng phải tiếp xúc với nhau.
C. cần phải đun nóng.
D. cả 3 điều kiện trên.
Câu 19: Tỉ khối của hỗn hợp chứa N2 và O3 theo tỉ lệ 1 : 2 so với không khí là:
A.
B.
C.
D.
Câu 20: Tỉ khối của hỗn hợp X chứa 3,36 lít khí H2 và 6,72 lít khí N2 (đều đo ở đktc) so với khí heli là:
A. 4,83
B. 19,33
C. 33,18
D. 33,19
Câu 21: Dãy các chất khí đều nặng hơn không khí là:
A. SO2, Cl2, H2S.
B. N2, CO2, H2.
C. CH4, H2S, O2.
D. Cl2, SO2, N2.
Câu 22: Cho số mol của khí nitơ là 0,5 mol. Số mol của khí oxi là 0,5 mol. Kết luận nào sau đây là đúng?
A. Khối lượng của nitơ là 16.
B. Khối lượng của oxi là 14.
C. Nitơ và oxi có thể tích bằng nhau ở đktc.
D. Nitơ và oxi có khối lượng bằng nhau.
Câu 23: Nếu hai chất khí khác nhau mà có thể tích bằng nhau (đo cùng nhiệt độ và áp suất) thì:
A. Chúng có cùng số mol chất.
B. Chúng có cùng khối lượng.
C. Chúng có cùng số phân tử.
D. Không thể kết luận được điều gì cả.
Câu 24: Tính khối lượng của Fe trong 92,8 gam Fe3O4?
A. 67,2 gam
B. 25,6 gam
C. 80 gam
D. 10 gam
Câu 25: Thành phần phần trăm khối lượng của sắt trong Fe2O3 là:
A. 35%
B. 65% C. 30%
D. 70%
Câu 26: Tính số mol phân tử có trong 6,72 lít khí H₂ (đo ở đktc)?
A. 0,3 mol
B. 0,5 mol
C. 1,2 mol
D. 1,5 mol
Câu 27: Hợp chất A có khối lượng mol là 94, có thành phần các nguyên tố là: 82,98% K; còn lại là oxi. Công thức hoá học của hợp chất A là:
A. KO2
B. KO
C. K2O
D. KOH
Câu 28: A là hợp chất CxHy có tỉ khối hơi đối với H2 là 15 biết cacbon chiếm 80% khối lượng phân tử. Công thức phân tử của CxHy là:
A. CH4
B. C3H6
C. C2H6
D. C2H2.
Câu 29: Đốt cháy hoàn toàn 27 gam Al trong oxi thu được Al2O3. Tính khối lượng Al2O3 thu được và thể tích oxi (đktc) đã dùng.
A. 51g và 16,8 lít
B. 51g và 33,6 lít
C. 51g và 22,4 lít
D. 102g và 16,8 lít
Câu 30: Khử 48 gam đồng (II) oxit bằng hiđro được 36,48 gam đồng sau phản ứng. Hiệu suất của phản ứng trên là:
A. 95%.
B. 90%.
C. 94%.
D. 85%.
Xem thêm các bộ đề thi Hoá học lớp 8 chọn lọc, hay khác:
Các dạng bài tập Hóa học lớp 8 Học kì 1
Hệ thống kiến thức Hóa học lớp 8 Học kì 1
TOP 30 Đề thi Giữa Học kì 2 Hoá học lớp 8 năm 2023 có đáp án
