TOP 13 Đề thi Học kì 1 Hoá học 8 năm 2023 có đáp án
Bộ 13 Đề thi Học kì 1 Hóa học lớp 8 có đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 8 Học kì 1. Mời các bạn cùng đón xem:
Chỉ 100k mua trọn bộ Đề thi Hóa học 8 bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 1
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32, Cu=64)
I - TRẮC NGHIỆM (6 điểm)
Câu 1. Trong các mệnh đề sau, mệnh đề nào đúng?
A. Tổng sản phẩm các chất bằng tổng chất tham gia.
B. Trong một phản ứng, tổng số phân tử chất tham gia bằng tổng số phân tử chất tạo thành.
C. Trong một phản ứng hóa học, tổng khối lượng của các sản phẩm bằng tổng khối lượng của các chất phản ứng.
D. Không có mệnh đề nào đúng.
Câu 2. Trong các định nghĩa về nguyên tử sau đây, định nghĩa nào là đúng?
A. Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện.
B. Nguyên tử là hạt vô cùng nhỏ, bị phân chia trong các phản ứng hóa học.
C. Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện, gồm hạt nhân mang điện tích dương và vỏ tạo bởi electron mang điện tích âm.
D. Tất cả đều đúng.
Câu 3. Dãy công thức hóa học đúng là
A. CaO2, Na2O, H2SO4, Fe(OH)3.
B. Na2O, NaCl, CaO, H2SO4.
C. Na2O, P5O2, H2SO4, NaCl.
D Na2O, HSO4, Fe(OH)3, CaO2.
Câu 4. Cho hợp chất AxBy, trong đó A có hóa trị a, B có hóa trị b. Công thức quy tắc hóa trị là
A. a.x = b.y
B. a.b = x.y
C. a.y = b.x
D. a.b.x = b.y.a
Câu 5. Các công thức hóa học biểu diễn nhóm đơn chất là
A. Fe, CO2 , O2.
B. KCl , HCl , Mg
C. HCl, Al2O3, CO2.
D. Na , H2 , Ag
Câu 6. Cho các chất sau: Cl2; H2SO4; Cu(NO3)2. Phân tử khối của các chất lần lượt là
A. 71; 98; 188.
B. 70; 98; 18
C. 71; 188; 98.
D. 71; 180; 98
Câu 7. Cho biết khối lượng của cacbon bằng 3kg, khối lượng của CO2 bằng 11kg. Khối lượng của O2 tham gia phản ứng là
A. 9 kg
B. 8 kg
C. 7,9 kg
D. 14 kg
Câu 8. Oxit nào giàu oxi nhất (hàm lượng % oxi lớp nhất)?
A. Al2O3.
B. N2O3.
C. P2O5.
D. Fe3O4.
Câu 9. Các nguyên tử của cùng một nguyên tố hóa học có cùng:
A. Số proton trong hạt nhân.
B. Số nơtron.
C. Số điện tử trong hạt nhân.
D. Khối lượng.
Câu 10. Hiện tượng nào sau đây là hiện tượng hóa học?
A. Nhôm nung nóng chảy để đúc xoong, nồi...
B. Than cần đập vừa nhỏ trước khi đưa vào bếp lò.
C. Cồn để trong lọ không kín bị bay hơi.
D. Trứng để lâu ngày sẽ bị thối.
Câu 11. Trong công thức hóa học của hiđro sunfua (H2S) và khí sunfurơ (SO2), hóa trị của lưu huỳnh lần lượt là:
A. I và II.
B. II và IV.
C. II và VI.
D. IV và VI.
Câu 12. Dãy nào gồm các chất là hợp chất?
A. CaO; Cl2; CO; CO2
B. Cl2; N2; Mg; Al
C. CO2; NaCl; CaCO3; H2O
D. Cl2; CO2; Ca(OH)2; CaSO4
Câu 13. Hóa trị của nitơ trong hợp chất đi nitơ oxit (N2O) là?
A. I
B. II
C. IV
D. V
Câu 14. Magie oxit có công thức hóa học là MgO. Công thức hóa học của magie với clo hóa trị I là?
A. MgCl3
B. Cl3Mg
C. MgCl2
D. MgCl
Câu 15. Hiện tượng biến đổi nào dưới đây là hiện tượng hóa học?
A. Bóng đèn phát sáng, kèm theo tỏa nhiệt.
B. Hòa tan đường vào nước để được nước đường.
C. Đung nóng đường, đường chảy rồi chuyển màu đen, có mùi hắc.
D. Trời nắng, nước bốc hơi hình thành mây.
Câu 16. Khối lượng của 0,1 mol kim loại sắt là?
A. 0,28 gam
B. 5,6 gam
C. 2,8 gam
D. 0,56 gam
Câu 17. Cho phương trình hóa học sau: C + O2 → CO2. Tỉ lệ số mol phân tử của C phản ứng với số mol phân tử oxi là?
A. 1 : 2
B. 1 : 4
C. 2 : 1
D. 1 : 1
Câu 18: “Chất biến đổi trong phản ứng là.........., còn chất mới sinh ra gọi là.........”
A. chất xúc tác – sản phẩm
B. chất tham gia – chất phản ứng
C. chất phản ứng – sản phẩm
D. chất xúc tác – chất tạo thành
II- TỰ LUẬN
Câu 1 (1,0 điểm): Lập phương trình hoá học của các phản ứng sau:
a) K + H2O KOH + H2
b) Al2O3 + H2SO4 Al2(SO4)3 + H2O
Câu 2 (3,0 điểm): Cho 4,8 gam magie tác dụng với dung dịch axit clohiđric (HCl) dư, thu được dung dich magie clorua MgCl2 và khí H2.
a) Viết phương trình hóa học xảy ra.
b) Tính khối lượng HCl cần vừa đủ cho phản ứng trên.
c) Tính thể tích khí hiđro sinh ra (ở đktc) .
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 1
I-TRẮC NGHIỆM
|
1. C |
2. C |
3. B |
4. A |
5. D |
6. A |
7. B |
8. B |
9. A |
|
10. D |
11. B |
12. C |
13. A |
14. C |
15. C |
16. B |
17. D |
18. C |
Câu 1: Định luật bảo toàn khối lượng được phát biểu như sau:
“Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”.
→ Đáp án C
Câu 2: Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm.
→ Đáp án C
Câu 3: Công thức hóa học viết đúng gồm: Na2O, H2SO4, Fe(OH)3, NaCl, CaO.
→ Đáp án B
Câu 4: Theo quy tắc hóa trị ta có: a.x = b.y
→ Đáp án A
Câu 5: Đơn chất là chất chỉ tạo bởi một nguyên tố hóa học.
→ Đáp án D
Câu 6: Phân tử khối của Cl2 là 35,5.2 = 71
Phân tử khối của H2SO4 là 1.2 + 32 + 16.4 = 98
Phân tử khối của Cu(NO3)2 là 64 + (14 + 16.3).2 = 188
→ Đáp án A
Câu 7: Phương trình hóa học:
C + O2 CO2
Áp dụng định luật bảo toàn khối lượng ta có:
= 11 – 3 = 8 kg
→ Đáp án B
Câu 8: Hàm lượng % O trong oxit là:
→ Đáp án B
Câu 9: Các nguyên tử của cùng một nguyên tố hóa học có cùng số proton trong hạt nhân.
→ Đáp án A
Câu 10: Hiện tượng hóa học là hiện tượng mà chất biến đổi tạo ra chất khác.
→ Đáp án D
Câu 11: Hóa trị của S trong H2S là II
Hóa trị của S trong SO2 là IV.
→ Đáp án B
Câu 12: Hợp chất là chất tạo bởi từ hai nguyên tố hóa học trở nên.
→ Đáp án C
Câu 13: Gọi hóa trị của N trong N2O là x.
Theo quy tắc hóa trị, ta có: 2.x = 1.II → x = I.
→ Đáp án A
Câu 14: Gọi hóa trị của Mg trong hợp chất là x.
Xét công thức MgO, theo quy tắc hóa trị, ta có:
1.x = 1.II → x = II.
Gọi công thức hóa học của Mg với clo có dạng MgaClb.
Ta có: → a = 1; b = 2
→ Công thức cần tìm là MgCl2.
→ Đáp án C
Câu 15: Hiện tượng hóa học là hiện tượng mà chất biến đổi tạo ra chất khác.
A, B, D là hiện tượng vật lý.
C là hiện tượng hóa học vì đường đã chuyển thành chất khác.
→ Đáp án C
Câu 16: mFe = 0,1.56 = 5,6 gam
→ Đáp án B
Câu 17: Phương trình hóa học: C + O2 CO2↑
→ Tỉ lệ số mol phân tử của C phản ứng với số mol phân tử oxi là tỉ lệ trong phương trình và bằng 1 : 1.
→ Đáp án D
Câu 18: Chất biến đổi trong phản ứng là chất phản ứng (chất tham gia), còn chất mới sinh ra gọi là sản phẩm (chất tạo thành).
→ Đáp án C
II- TỰ LUẬN
Câu 1:
a) 2K + 2H2O → 2KOH + H2↑
b) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Câu 2:
a) Phương trình hóa học:
Mg + 2HCl → MgCl2 + H2↑
b) Theo bài,
Theo phương trình, ta có: = 0,4 mol
Khối lượng HCl cần dùng vừa đủ là: mHCl = 0,4.36,5 = 14,6 gam
c) Theo phương trình, ta có:
Thể tích khí hiđro sinh ra là: lít
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 2
(Cho C=12, O=16, H=1, Mg=32, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Zn=65, N=14, S=32)
I - TRẮC NGHIỆM (6 điểm)
Câu 1: Muốn thu khí NH3 vào bình thì thu bằng cách:
A. Đặt úp ngược bình.
B. Đặt đứng bình
C. Cách nào cũng được
D. Đặt nghiêng bình
Câu 2: Tỉ khối của khí A đối với khí nitơ (N2) là 1,675 .Vậy khối lượng mol của khí A tương đương:
A. 45g
B. 46g
C. 47g
D. 48g
Câu 3: Thành phần phần trăm theo khối lượng của nguyên tố S trong hợp chất SO3 là:
A. 40%
B. 60%
C. 20%
D. 80%
Câu 4: “Chất biến đổi trong phản ứng là.........., còn chất mới sinh ra gọi là.........”
A. chất xúc tác – sản phẩm
B. chất tham gia – chất phản ứng
C. chất phản ứng – sản phẩm
D. chất xúc tác – chất tạo thành
Câu 5: Đun nóng đường, đường chảy lỏng. Đây là hiện tượng:
A. vật lý
B. hóa học
C. sinh học
D. tự nhiên
Câu 6: Thể tích mol của chất khí là thể tích chiếm bởi N….. của khí đó. Từ thích hợp là:
A. nguyên tử
B. số mol
C. khối lượng
D. phân tử
Câu 7: Cho các khí sau: N2, H2, CO, SO2 khí nào nặng hơn không khí ?
A. Khí N2
B. Khí H2
C. Khí CO
D. Khí SO2.
Câu 8: Số mol của 0,56 gam khí nitơ là:
A. 0,01 mol
B. 0,02 mol
C. 0,025 mol
D. 0,1 mol
Câu 9: Cho phương trình: Cu + O2 CuO. Phương trình cân bằng đúng là:
A.2Cu + O2 CuO
B. 2Cu + 2O2 4CuO
C. Cu + O2 2CuO
D. 2Cu + O2 2CuO
Câu 10: Phát biểu nào sau đây là đúng ?
A. Thủy tinh nóng chảy thổi thành bình cầu là hiện tượng hóa học.
B. Công thức hóa học của Fe (III) và O (II) là Fe3O2.
C. Ở điều kiện tiêu chuẩn, 1 mol chất khí có thể tích là 22,4 lít.
D. Nguyên tử cùng loại có cùng số proton và số nơtron trong hạt nhân.
Câu 11: Trong các phương trình sau, phương trình nào cân bằng sai ?
A. 2Fe + 3Cl2 2FeCl3
B. 2H2 + O2 2H2O
C. 2Al + 3O2 2Al2O3
D. Zn + 2HCl ZnCl2 + H2
Câu 12: Cho sơ đồ phản ứng sau: Al + CuO --> Al2O3 + Cu . Phương trình cân bằng đúng là:
A. 2Al + 3CuO Al2O3 + 3Cu
B. 2Al + 2CuO Al2O3 + 3Cu
C. 2Al + 3CuO Al2O3 + 2Cu
D.4 Al + CuO Al2O3 + Cu
Câu 13: Tỉ khối của khí C đối với không khí là dC/KK < 1. Là khí nào trong các khí sau đây:
A. O2.
B. N2.
C. CO2.
D. H2S.
Câu 14: 11 gam CO2 có thể tích là:
A. 6,5 lít
B. 44 lít
C. 56,6 lít
D. 5,6 lít
Câu 15: Số mol phân tử N2 có trong 280g nitơ là:
A. 28 mol
B. 10 mol
C. 11 mol
D. 12 mol
Câu 16: Khí oxi nặng hơn khí hiđro:
A. 4 lần
B. 16 lần
C. 32 lần
D. 8 lần
Câu 17. Số electron trong nguyên tử Al (có số proton =13) là:
A. 10
B. 11
C. 12
D. 13.
Câu 18. Khối lượng của 0,1 mol kim loại kẽm là?
A. 0,65 gam
B. 5,6 gam
C. 6,5 gam
D. 0,56 gam
II- TỰ LUẬN (4 điểm)
Câu 1 (1,5 điểm): Cân bằng các phương trình sau:
a) K + O2 K2O
b) NaOH + Fe2(SO4)3 Fe(OH)3 + Na2SO4
c) BaCl2 + AgNO3 AgCl + Ba(NO3)2
Câu 2 (2,5 điểm): Đốt cháy 18g kim loại magie Mg trong không khí thu được 30g hợp chất magie oxit (MgO). Biết rằng Mg cháy là xảy ra phản ứng với khí oxi trong không khí.
a) Viết phương trình hóa học của phản ứng.
b) Tính khối lượng khí oxi đã phản ứng.
c) Tính thể tích dung dịch HCl 1M cần dùng để hòa tan hết chất rắn MgO ở trên.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. TRẮC NGHIỆM
|
1. A |
2. C |
3. A |
4. C |
5. A |
6. D |
7. D |
8. B |
9. D |
|
10. C |
11. C |
12. A |
13. B |
14. D |
15. B |
16. B |
17. D |
18. C |
Câu 1: Khí NH3 tan nhiều trong nước nên không thu khí bằng phương pháp đẩy nước mà thu khí bằng phương pháp đẩy không khí. Khí NH3 nhẹ hơn không khí nên thu khí bằng cách úp bình.
→ Đáp án A
Câu 2:
Ta có:
→ Đáp án C
Câu 3:
→ Đáp án A
Câu 4:
Chất biến đổi trong phản ứng là chất phản ứng (chất tham gia), còn chất mới sinh ra gọi là sản phẩm (chất tạo thành).
→ Đáp án C
Câu 5: Đun nóng đường, đường chảy lỏng thì đây là quá trình nóng chảy.
→ Đây là hiện tượng vật lý.
→ Đáp án A
Câu 6:
Thể tích mol của chất khí là thể tích chiếm bởi N phân tử của khí đó
→ Đáp án D
Câu 7: Các khí có tỉ khối so với không khí lớn hơn 1 thì nặng hơn không khí.
→ SO2 nặng hơn không khí.
→ Đáp án D
Câu 8:
Số mol khí N2 là:
→ Đáp án B
Câu 9:
2Cu + O2 2CuO
→ Đáp án D
Câu 10:
A. sai vì là hiện tượng vật lý.
B. sai vì công thức đúng là Fe2O3.
C. đúng.
D. Nguyên tử cùng loại có cùng số proton trong hạt nhân.
→ Đáp án C
Câu 11:
C cân bằng sai.
Đúng: 4Al + 3O2 2Al2O3
→ Đáp án C
Câu 12:
Phương trình hóa học:
2Al + 3CuO Al2O3 + 3Cu
→ Đáp án A
Câu 13:
Tỉ khối của khí C đối với không khí là dC/KK < 1 → Khí C nhẹ hơn không khí.
→ Khí C là N2.
→ Đáp án B
Câu 14:
Số mol khí CO2 là:
Thể tích khí CO2 là: lít
→ Đáp án D
Câu 15:
Số mol phân tử N2 là
→ Đáp án B
Câu 16:
→ Khí oxi nặng hơn khí hiđro 16 lần.
→ Đáp án B
Câu 17:
Số electron trong nguyên tử = số proton = 13.
→ Đáp án D
Câu 18: Khối lượng của 0,1 mol kim loại kẽm là:
mZn = 0,1.65 = 6,5 gam
→ Đáp án C
II. TỰ LUẬN
Câu 1:
a) 4K + O2 → 2K2O
b) 6NaOH + Fe2(SO4)3 → 2Fe(OH)3↓ + 3Na2SO4
c) BaCl2 + 2AgNO3 → 2AgCl↓ + Ba(NO3)2
Câu 2:
a) Phương trình hóa học:
2Mg + O2 2MgO
b) Áp dụng định luật bảo toàn khối lượng ta có:
= 30 – 18 = 12 gam
c) Số mol MgO là:
Phương trình hóa học:
Thể tích dung dịch HCl cần dùng là:
lít
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 3
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al =27, N=14, S=32)
I- TRẮC NGHIỆM (7 Điểm)
Câu 1. Trong các hiện tượng sau, hiện tượng nào là hiện tượng hóa học?
A. Sáng sớm, khi mặt trời mọc sương mù tan dần.
B. Hơi nước trong các đám mây ngưng tụ và rơi xuống tạo thành mưa.
C. Hòa tan muối vào nước tạo thành dung dịch nước muối.
D. Chuối chín
Câu 2. Trong các nhóm công thức hóa học sau, nhóm nào toàn đơn chất?
A. CH4, H2SO4, NO2, CaCO3.
B. K, N, Na, H2, O2.
C. Cl2, Br2, H2O, Na.
D. CH4, FeSO4, CaCO3, H3PO4.
Câu 3. Cho biết Fe (III), SO4 (II), công thức hóa học nào viết đúng?
A. FeSO4.
B. Fe(SO4)2.
C. Fe2SO4.
D. Fe2(SO4)3.
Câu 4. Phân tử khối của FeSO4 là:
A. 152g.
B. 152 đvC.
C. 152.
D. Cả B và C đều đúng.
Câu 5. Khi quan sát một hiện tượng, dấu hiệu nào cho thấy có phản ứng hóa học xảy ra?
A. Có chất kết tủa (chất không tan)
B. Có sự thay đổi màu sắc.
C. Có chất khí thoát ra (chất bay hơi).
D. Một trong số các dấu hiệu trên.
Câu 6. Có phương trình hóa học: 2H2 + O2 → 2H2O. Theo định luật bảo toàn khối lượng thì:
A. .
B.
C. .
D..
Câu 7. Phản ứng hóa học là:
A. Quá trình biến đổi từ chất này thành chất khác.
B. Hiện tượng chất biến đổi có tạo ra chất khác.
C. Hiện tượng chất biến đổi mà vẫn giữ nguyên là chất ban đầu.
D. Quá trình thay đổi hình dạng vật thể
Câu 8. Cho phương trình hóa học:
4Al + 3O2 → 2Al2O3.
Biết khối lượng của Al tham gia phản ứng là 1,35g và lượng Al2O3 thu được là 2,5g. Vậy lượng O2 đã tham gia phản ứng là bao nhiêu?
A. 1,25g.
B. 1,15g.
C. 1,1g.
D. 3,85g.
Câu 9. Để tính thể tích chất khí (đktc) ta vận dụng công thức nào?
A. n = m × M.
B. m = n × M.
C. V = n × 22,4.
D. V = n × 24.
Câu 10. Để tính được khối lượng chất tham gia hay sản phẩm ta vận dụng công thức nào?
A. m = n × M.
B. M = m : n.
C. m = n : M.
D. M = m : n.
Câu 11. Khí H2 nặng hay nhẹ hơn không khí bao nhiêu lần?
A. Nặng hơn không khí 0,069 lần.
B. Nhẹ hơn không khí 0,069 lần.
C. Nặng hơn không khí 14,5 lần.
D. Nhẹ hơn không khí 14,5 lần.
Câu 12. Trong công thức hóa học: CaCO3. Tỉ lệ số mol của các nguyên tố Ca : C : O là:
A. 1: 1: 1.
B. 1: 1: 2.
C. 1: 1: 3.
D. 2: 1: 3.
Câu 13. Quá trình sau đây là hiện tượng vật lí:
A. Nước đá chảy thành nước lỏng.
B. Hiđro tác dụng với oxi tạo nước
C. Đường cháy thành than
D. Củi cháy thành than.
Câu 14. Đốt lưu huỳnh ngoài không khí, lưu huỳnh hóa hợp với oxi tạo ra khí có mùi hắc là khí sunfurơ. Phương trình hóa học đúng để mô tả phản ứng trên là:
A. 2S + O2 SO2
B. 2S + 2O2 2SO2
C. S + 2O SO2
D. S + O2 SO2
Câu 15. Trong một phản ứng hóa học, tồng khối lượng các chất ……..bằng tổng khối lượng các chất tạo thành.
Cụm từ còn thiếu trong dấu ở (……) là:
A. sản phẩm
B. tạo thành
C. tham gia
D. hóa học
Câu 16. Hãy chọn hệ số thích hợp cho phương trình hóa học sau:
2Al + 3H2SO4 Al2(SO4)3 + ?H2
A. 3
B. 2
C. 1
D. 4
Câu 17. Hóa trị cùa Fe trong công thức Fe2(SO4)3 là:
A. I
B. II
C. III
D. IV
Câu 18. Công thức hóa học viết sai là:
A. NO2
B. K2O
C. MgCl
D. H2O
II- TỰ LUẬN (4 điểm)
Câu 1. (1 điểm) Lập công thức hóa học và tính phân tử khối của công thức vừa lập.
a) Fe (II) và Oxi.
b) Al (III) và nhóm SO4 (II).
Câu 2. Hoàn thành các phương trình hóa học sau: (2 điểm)
a) P + O2 P2O5
b) NaOH + H2SO4 Na2SO4 + H2O
c) Fe(OH)3 Fe2O3 + H2O
d) Al + CuSO4 Cu + Al2(SO4)3.
Câu 3. (1 điểm)
a) Tính số mol của 1,12 lít khí O2 ở điều kiện tiêu chuẩn?
b) Tính khối lượng của 0,25 mol CO2?
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I- TRẮC NGHIỆM
|
1. D |
2. B |
3. D |
4. B |
5. D |
6. A |
7. A |
8. B |
9. C |
|
10. A |
11. B |
12. C |
13. A |
14. D |
15. C |
16. A |
17. C |
18. C |
Câu 1:
Hiện tượng hóa học là hiện tượng chất này biến đổi thành chất mới.
→ Đáp án D
Câu 2: Đơn chất là những chất chỉ tạo bởi 1 nguyên tố hóa học.
→ Đáp án B
Câu 3: Gọi công thức cần tìm là Fex(SO4)y.
Ta có:
→ x = 2 và y = 3.
→ Công thức là Fe2(SO4)3.
→ Đáp án D
Câu 4:
Phân tử khối của FeSO4 là 56 + 32 + 16.4 = 152 đvC
→ Đáp án B
Câu 5:
Phản ứng hóa học xảy ra khi có sự xuất hiện một trong các dấu hiệu sau:
+ Có chất kết tủa.
+ Có chất khí thoát ra.
+ Có sự thay đổi màu sắc.
→ Đáp án D
Câu 6: Áp dụng định luật bảo toàn khối lượng ta có:
→ Đáp án A
Câu 7: Phản ứng hóa học là quá trình biến đổi chất này thành chất khác.
→ Đáp án A
Câu 8: Áp dụng định luật bảo toàn khối lượng ta có:
2,5 – 1,35 = 1,15 gam
→ Đáp án B
Câu 9: Ở điều kiện tiêu chuẩn, thể tích khí tính theo công thức: V = n.22,4 (lít)
→ Đáp án C
Câu 10: Công thức tính khối lượng chất là: m = n. M
Trong đó, n là số mol chất; M là phân tử khối của chất.
→ Đáp án A
Câu 11: Tỉ khối của H2 so với không khí là: .
→ Khí H2 nhẹ hơn không khí 0,069 lần
→ Đáp án B
Câu 12:
Tỉ lệ số mol của các nguyên tố Ca : C : O = 1 : 1 : 3.
→ Đáp án C
Câu 13:
Hiện tượng vật lý là hiện tượng chất biến đổi nhưng vẫn nguyên chất ban đầu.
Thí dụ: Chuyển từ trạng thái này sang trạng thái khác.
→ Đáp án A
Câu 14:
Phương trình hóa học:
S + O2 SO2
→ Đáp án D
Câu 15:
Trong một phản ứng hóa học, tồng khối lượng các chất tham gia bằng tổng khối lượng các chất tạo thành.
→ Đáp án C
Câu 16:
2Al + 3H2SO4 Al2(SO4)3 + 3H2↑
→ Đáp án A
Câu 17: Hóa trị cùa Fe trong công thức Fe2(SO4)3 là III.
→ Đáp án C
Câu 18: Công thức hóa học viết sai là MgCl.
Công thức đúng là MgCl2.
II- TỰ LUẬN
Câu 1:
a) Gọi công thức hóa học cần tìm là FexOy.
Theo quy tắc hóa trị, ta có: II.x = II.y
→ x = 1 và y = 1
→ Công thức là FeO.
Phân tử khối của FeO là: 56 + 16 = 72 đvC.
b) Gọi công thức hóa học cần tìm là Alx(SO4)y.
Theo quy tắc hóa trị, ta có: III.x = II.y
→ x = 2 và y = 3
→ Công thức là Al2(SO4)3.
Phân tử khối của Al2(SO4)3 là: 27.2 + (32 + 16.4).3 = 342 đvC.
Câu 2:
a) 4P + 5O2 2P2O5
b) 2NaOH + H2SO4 → Na2SO4 + 2H2O
c) 2Fe(OH)3 Fe2O3 + 3H2O
d) 2Al + 3CuSO4 → 3Cu + Al2(SO4)3.
Câu 3:
a)
b)
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 4
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32)
Câu 1: Khối lượng của 1 nguyên tử cacbon là:
A. 1,9926.10-23g
B. 1,9926g
C. 1,9926.10-23đvC
D. 1,9926đvC.
Câu 2: Hiện tượng hoá học khác với hiện tượng vật lý là:
A. Biến đổi về hình dạng.
B. Có sinh ra chất mới.
C. Chỉ biến đổi về trạng thái.
D. Khối lượng thay đổi.
Câu 3: Trong 1 phản ứng hoá học, các chất phản ứng và sản phẩm có cùng:
A. Số nguyên tố tạo ra chất.
B. Số phân tử của mỗi chất.
C. Số nguyên tử của mỗi nguyên tố.
D. Số phân tử trong mỗi chất.
Câu 4: Trong quá trình phản ứng, lượng chất phản ứng:
A. Giảm dần
B. Giữ nguyên.
C. Tăng
D. Cả A, B, C.
Câu 5: Số electron lớp ngoài cùng của nguyên tử Al (có số proton =13) là:
A. 1
B. 2
C. 3
D. 4.
Câu 6: Số lớp electron của nguyên tử Al (có số proton =13) là:
A. 1
B. 2
C. 3
D. 4.
Câu 7: Số e trong nguyên tử Al (có số proton =13) là:
A. 10
B. 11
C. 12
D. 13.
Câu 8: Tỉ lệ % khối lượng của các nguyên tố Ca, C, O trong CaCO3 lần lượt là:
A. 40%; 40%; 20%
B. 40%; 12%; 48%
C. 10% ; 80% ; 10%
D. 20% ; 40% ; 40%
Câu 9: Khối lượng của 1 đvC là:
A. 1,6605.10-24g
B. 6.1023g
C. 1,6605.10-23g
D. 1,9926.10-23g
Câu 10: Trong hợp chất AxBy . Hoá trị của A là m, hoá trị của B là n thì quy tắc hóa trị là:
A. m.A= n.B
B. m.x = n.y
C. m.n = x.y
D. m.y = n.x
Câu 11: Cho sơ đồ phản ứng: Fe(OH)y + H2SO4 → Fex(SO4)y + H2O. Biết sắt trong các hợp chất trên có hóa trị III thì hệ số của các chất trong phản ứng lần lượt là:
A. 1: 3:1:6
B. 2:3:1:6
C. 2:6:1:6
D. 1:6:2:6
Câu 12: Dãy nguyên tố kim loại là:
A. K, Na, Mn, Al, Ca.
C. Na, Mg, C, Ca, Na.
B. Ca, S, Cl, Al, Na.
D. Al, Na, O, H, S.
Câu 13: Công thức chuyển đổi giữa lượng chất và khối lượng là:
A. m = n.M
B. M = .
C. M = n.m.
D. M.m = n
Câu 14: Cho 5,6g sắt Fe tác dụng với dung dịch axit clohiđric HCl tạo ra 12,7g sắt (II) clorua FeCl2 và 0,2g khí H2. Khối lượng HCl đã dùng là:
A. 7,3g
B. 14,2g
C. 9,2g
D. 8,4g
Câu 15: Chất thuộc hợp chất hóa học là:
A. O2.
B. N2.
C. H2.
D. CO2.
Câu 16: Khí SO2 nặng hơn khí O2 bao nhiêu lần?
A. 1,5 lần.
B. 1,7 lần.
C. 2 lần.
D. 1,2 lần
Câu 17: Trong các vật sau, đâu là vật thể tự nhiên?
A. Nhà ở.
B. Quần áo.
C. Cây cỏ.
D. Đồ dùng học tập.
Câu 18: Nguyên tử N có hoá trị III trong phân tử chất nào sau đây?
A. N2O5
B. NO
C. N2O3.
D. NO2
Câu 19: Khối lượng của 0,5 mol CO2 là:
A. 22g
B. 28g
C. 11,2g
D. 44g
Câu 20: Đốt cháy quặng pirit sắt (FeS2) thu được sắt(III) oxit Fe2O3 và khí sunfurơ SO2. Phương trình phản ứng nào sau đây đã viết đúng?
A. 4FeS2 + 11O2 2Fe2O3 + 8SO2
B. 2FeS2 + O2 Fe2O3 + SO2
C. 4FeS2 + 11O2 Fe2O3 + 8SO2
D. FeS2 + O2 Fe2O3 + 2SO2
Câu 21: Số phân tử có trong 1 mol O2 là:
A. 6,02.1023
B. 12,04.1023
C. 6,04.1023
D. 18,06.1023.
Câu 22: Công thức tính thể tích chất khí (ở đktc):
A.
B. V = n.24
C. V = n.M
D. V = n.22,4
Câu 23: Chọn câu phát biểu đúng trong các câu sau:
A. Phản ứng hóa học là quá trình biến đổi từ chất này thành chất khác.
B. Trong phản ứng hóa học, có sự biến đổi từ nguyên tử này thành nguyên tử khác.
C. Trong phản ứng hóa học, liên kết giữa các phân tử tham gia phản ứng thay đổi.
D. Trong phản ứng hóa học, các nguyên tử bị phá vỡ.
Câu 24: 6,4 gam khí sunfurơ SO2 tương ứng với số mol phân tử là:
A. 0,01 mol
B. 0,1 mol
C. 0,2 mol
D. 0,5 mol
Câu 25: Hòa tan muối ăn vào nước, được dung dịch trong suốt. Cô cạn dung dịch, những hạt muối ăn lại xuất hiện. Quá trình này được gọi là:
A. hiện tượng hòa tan.
B. hiện tượng vật lí.
C. hiện tượng hóa học.
D. hiện tượng bay hơi
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1. A |
2. B |
3. C |
4. A |
5. C |
6. C |
7. D |
8. B |
9. A |
10. B |
|
11. B |
12. A |
13. A |
14. A |
15. D |
16. C |
17. C |
18. C |
19. A |
20. A |
|
21. A |
22. D |
23. A |
24. B |
25. B |
|
|
|
|
|
Câu 1: Khối lượng của 1 nguyên tử cacbon là 1,9926.10-23g.
→ Đáp án A
Câu 2: Hiện tượng hóa học khác với hiện tượng vật lý là có sự sinh ra chất mới.
→ Đáp án B
Câu 3:
Trong 1 phản ứng hoá học, các chất phản ứng và sản phẩm có cùng số nguyên tử của mỗi nguyên tố.
→ Đáp án C
Câu 4:
Trong quá trình phản ứng, lượng chất phản ứng giảm dần đồng thời lượng chất sản phẩm tăng dần.
→ Đáp án A
Câu 5: Sơ đồ nguyên tử của Al:
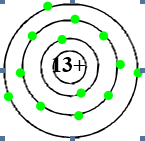
→ Lớp ngoài cùng của nguyên tử nhôm có 3 electron.
→ Đáp án C
Câu 6: Sơ đồ nguyên tử của Al:
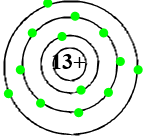
→ Nguyên tử nhôm có 3 lớp electron.
→ Đáp án C
Câu 7:
Số electron trong nguyên tử = số proton = 13
→ Đáp án D
Câu 8: Phân tử khối của CaCO3 là 40 + 12 + 16.3 = 100 đvC
Tỉ lệ % khối lượng của các nguyên tố Ca, C, O trong CaCO3 lần lượt là:
→ Đáp án B
Câu 9:
1 đvC = = 1,6605.10-24g.
→ Đáp án A
Câu 10: Theo quy tắc hóa trị, ta có: m.x = n.y
→ Đáp án B
Câu 11: Sắt có hóa trị III trong các hợp chất trong phương trình nên công thức hóa học của các hợp chất chứa sắt là Fe(OH)3, Fe2(SO4)3.
Phương trình hóa học:
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
Hệ số các chất trong phản ứng lần lượt là 2 : 3 : 1 : 6.
→ Đáp án B
Câu 12:
A. là dãy gồm các nguyên tố kim loại.
B. C là phi kim.
C. S và Cl là phi kim.
D. O, S, H là phi kim
→ Đáp án A
Câu 13: Công thức chuyển đổi giữa lượng chất và khối lượng là: m = n.M
→ Đáp án A
Câu 14:
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2↑
Áp dụng định luật bảo toàn khối lượng ta có:
→ mHCl = 12,7 + 0,2 – 5,6 = 7,3 gam
→ Đáp án A
Câu 15:
Hợp chất là những chất tạo bởi từ hai nguyên tố trở nên.
→ CO2 thuộc loại hợp chất.
→ Đáp án D
Câu 16:
Tỉ khối khí SO2 so với O2 là
→ Khí SO2 nặng hơn khí O2 2 lần.
→ Đáp án C
Câu 17: Vật thể tự nhiên là vật thể có sẵn trong thiên nhiên.
→ Cây cỏ là vật thể tự nhiên.
→ Đáp án C
Câu 18: Nguyên tử N trong phân tử N2O3 có hóa trị III vì:
Gọi công thức hóa của của N (III) với oxi là NxOy.
Theo quy tắc hóa trị, ta có: III.x = II.y
→ x = 2 và y = 3.
→ Công thức hóa học của hợp chất là N2O3.
→ Đáp án C
Câu 19:
Khối lượng của 0,5 mol CO2 là: 0,5.44 = 22 gam.
→ Đáp án A
Câu 20:
Phương trình hóa học:
4FeS2 + 11O2 2Fe2O3 + 8SO2↑
→ Đáp án A
Câu 21:
Số phân tử có trong 1 mol O2 là 6,02.1023.
→ Đáp án A
Câu 22:
Ở điều kiện tiêu chuẩn, công thức tính thể tích khí là: V = n.22,4 (lít).
→ Đáp án D
Câu 23:
Phản ứng hóa học là quá trình biến đổi từ chất này thành chất khác.
→ Đáp án A
Câu 24:
Số mol phân tử khí SO2 là:
→ Đáp án B
Câu 25:
- Hòa tan muối ăn vào nước, được dung dịch trong suốt → Quá trình hòa tan muối.
- Cô cạn dung dịch, những hạt muối ăn lại xuất hiện → Quá trình cô cạn muối hay làm bay hơi nước.
→ Đây là các hiện tượng vật lí.
→ Đáp án B
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 5
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32)
Câu 1: Trong các quá trình sau, đâu là hiện tượng hóa học ?
A. Nghiền bột gạo
B. Hòa tan đường vào nước được nước đường
C. Thanh sắt để lâu ngoài không khí bị gỉ
D. Cồn để trong lọ không bịt kín bị bay hơi
Câu 2: Cho phản ứng: A + B + C D. Biểu thức bảo toàn khối lượng nào sau đây là đúng ?
A. mA + mB = mC + mD
B. mA + mB + mC = mD
C. mA + mB + mD = mC
D. mA = mB + mC + mD
Câu 3: Cho sơ đồ phản ứng: Nhôm + Khí oxi Nhôm oxit, chất sản phẩm là
A. Nhôm
B. Oxi
C. Nhôm và oxi
D. Nhôm oxit
Câu 4: Cho phương trình hóa học: 2Cu + O2 2CuO.
Tỉ lệ số nguyên tử đồng : số phân tử oxi là:
A. 1:1
B. 1:2
C. 2:1
D. 2:1:2
Câu 5: Đơn chất là những chất được tạo nên
A. từ một nguyên tố hóa học
B. từ 2 nguyên tố hóa học trở lên
C. từ 3 nguyên tố trở lên
D. từ 4 nguyên tố hóa học trở lên
Câu 6: Hạt nhân nguyên tử được tạo bởi các loại hạt
A. Electron
B. Proton
C. Nơtron
D. Cả B và C
Câu 7: Kí hiệu hóa học của kim loại sắt là
A. fe
B. fE
C. FE
D. Fe
Câu 8. Tỉ khối của khí metan (CH4) đối với khí oxi là
A. 1
B. 0,5
C. 0,75
D.1,25
Câu 9: Chất nào sau đây làm vẩn đục nước vôi trong?
A. Nước.
B. Khí CO2.
C. Khí O2.
D. Khí H2.
Câu 10: Dãy các đơn chất là:
A. Al, S, H2O
B. H2SO4, HCl, HNO3.
C. O2, H2, N2
D. O, H, N
Câu 11: Nguyên tử Al có 13p. Số electron và nơtron lần lượt là:
A. 13e, 12n.
B. 13e, 13n.
C. 13e, 14n.
D. 14e, 13n.
Câu 12: Trong hợp chất SO3, S có hóa trị là:
A. VI
B. V
C. IV
D. III
Câu 13: Trong hợp chất SO2, % khối lượng của S là:
A. 25%
B. 50%
C. 75%
D. 80%
Câu 14: Thành phần phần trăm theo khối lượng của oxi trong hợp chất CuSO4 là:
A. 40%
B. 10%
C. 20%
D. 30%
Câu 15: Công thức hóa học của chất được tạo bởi Fe (II) và O là:
A. Fe2O2
B. Fe3O4
C. Fe2O3
D. FeO
Câu 16: Nước cất là:
A. Nguyên tử.
B. Đơn chất.
C. Chất tinh khiết.
D. Hỗn hợp.
Câu 17: Mối liên hệ giữa các chất theo định luật bảo toàn khối lượng là:
A. ∑mchất tham gia < ∑msản phẩm
B. ∑mchất tham gia > ∑msản phẩm
C. ∑mchất tham gia ≠ ∑msản phẩm
D. ∑mchất tham gia = ∑msản phẩm
Câu 18: Khí A có tỉ khối so với không khí là dA/KK ≈ 1,103. Vậy khí A là:
A. Cl2.
B. H2.
C. SO3.
D. O2
Câu 19: Thể tích của hỗn hợp khí gồm 0,05 mol CO2 và 0,05 mol O2 ở điều kiện tiêu chuẩn là:
A. 11,2 lít
B. 2,24 lít
C. 4,48 lít
D. 6,72 lít
Câu 20: Nguyên tố hóa học là:
A. Tập hợp các nguyên tử cùng loại.
B. Tập hợp các phân tử cùng loại.
C. Tập hợp các đơn chất cùng loại.
D. Tập hợp các chất cùng loại.
Câu 21: Nhóm chất nào sau đây gồm toàn hợp chất:
A. FeO, CuSO4, N2, H2.
B. CaO, H2SO4, HCl, Ca.
C. HNO3, H2S, Al2O3, H2O.
D. O2, HNO3, CaO, MgO.
Câu 22: Công thức hóa học nào sau đây viết sai?
A. HCl
B. H3PO4
C. FeO
D. Fe2O
Câu 23: Số mol của 11,2 gam Fe là
A. 0,5 mol
B. 0,25 mol
C. 0,2 mol
D. 2 mol
Câu 24: Hóa trị của nguyên tố N trong công thức hóa học NO2 là:
A. I
B. II
C. III
D. IV
Câu 25: Cho phương trình hóa học sau: 4P + 5O2 2P2O5. Tỷ lệ mol của các chất lần lượt là
A. 5:4:2
B. 4:5:2
C. 2:4:5
D. 5:2:4
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1. C |
2. B |
3. C |
4. C |
5. A |
6. D |
7. D |
8. B |
9. B |
10. C |
|
11. C |
12. A |
13. B |
14. A |
15. D |
16. C |
17. D |
18. D |
19. B |
10. A |
|
21. C |
22. D |
23. C |
24. D |
25. B |
|
|
|
|
|
Câu 1: Hiện tượng hóa học là hiện tượng chất này biến đổi thành chất mới.
→ Thanh sắt để lâu ngoài không khí bị gỉ là hiện tượng hóa học.
→ Đáp án C
Câu 2: Biểu thức bảo toàn khối lượng là: mA + mB + mC = mD.
→ Đáp án B
Câu 3: Sản phẩm là nhôm oxit có công thức hóa học là Al2O3.
→ Đáp án C
Câu 4: Tỉ lệ số nguyên tử đồng : số phân tử oxi là 2 : 1.
→ Đáp án C
Câu 5: Đơn chất là những chất được tạo nên từ một nguyên tố hóa học.
→ Đáp án A
Câu 6: Hạt nhân nguyên tử được tạo bởi hạt proton và nơtron.
→ Đáp án D
Câu 7: Kí hiệu của kim loại sắt là Fe.
→ Đáp án D
Câu 8:
Tỉ khối của khí CH4 đối với khí oxi là
→ Đáp án B
Câu 9: Chất làm đục nước vôi trong là khí CO2.
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
→ Đáp án B
Câu 10: Đơn chất là chất chỉ tạo bởi 1 nguyên tố hóa học.
→ Đáp án C
Câu 11:
Số electron = số proton = 13.
Số nơtron = Nguyên tử khối nhôm – số proton = 27 – 13 = 14
→ Đáp án C
Câu 12: Gọi hóa trị của S trong hợp chất SO3 là a.
Theo quy tắc hóa trị, ta có: a. 1 = II.3 → a = VI
→ Đáp án A
Câu 13:
→ Đáp án B
Câu 14:
→ Đáp án A
Câu 15: Gọi công thức hóa học của Fe (II) và O là FexOy.
Theo quy tắc hóa trị, ta có: II.x = II.y
→ x = y = 1
→ Công thức hóa học cần tìm là FeO.
→ Đáp án D
Câu 16: Nước cất là chất tinh khiết.
→ Đáp án C
Câu 17: Theo định luật bảo toàn khối lượng ta có:
∑mchất tham gia = ∑msản phẩm
→ Đáp án D
Câu 18:
Ta có: dA/KK ≈ 1,103 → MA = 29.1,103 = 32
→ Vậy khí A là khí O2.
→ Đáp án D
Câu 19: Tổng số mol các khí là: 0,05 + 0,05 = 0,1 mol
Thể tích hỗn hợp khí ở điều kiện tiêu chuẩn là: 0,1.22,4 = 2,24 lít
→ Đáp án B
Câu 20: Nguyên tố hóa học là tập hợp các nguyên tử cùng loại.
→ Đáp án A
Câu 21: Hợp chất là chất được tạo bởi từ hai nguyên tố hóa học trở nên.
→ Đáp án C
Câu 22: Công thức hóa học Fe2O viết sai vì theo công thức này sắt có hóa trị I.
Công thức hóa học đúng là FeO hay Fe2O3 hay Fe3O4.
→ Đáp án D
Câu 23: Số mol của 11,2 gam sắt là
→ Đáp án C
Câu 24: Gọi hóa trị của N trong công thức NO2 là a.
Theo quy tắc hóa trị, ta có: a.1 = 2.II → a = IV
→ Đáp án D
Câu 25:
Tỷ lệ mol của các chất lần lượt là 4 : 5 : 2.
→ Đáp án B
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 6
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al =27, N=14, S=32, Ag=108)
Câu 1: Trong nguyên tử, hạt nào mang điện tích âm?
A. Electron
B. Proton
C. Nơtron
D. Tất cả đều sai
Câu 2: Nguyên tử khối là khối lượng của một nguyên tử tính bằng đơn vị nào?
A. Gam
B. Kilogam
C. Đơn vị cacbon (đvC)
D. Cả 3 đơn vị trên.
Câu 3: Hiện tượng nào là hiện tượng hóa học trong các hiện tượng thiên nhiên sau đây:
A. Sáng sớm, khi mặt trời mọc sương mù tan dần.
B. Hơi nước trong các đám mây ngưng tụ và rơi xuống tạo ra mưa.
C. Cháy rừng tạo khói đen dày đặc gây ô nhiễm môi trường.
D. Khi mưa thường có sấm sét.
Câu 4: Nguyên tố X có nguyên tử khối bằng 3,5 lần nguyên tử khối của oxi. X là nguyên tố nào sau đây?
A. Ca
B. Na
C. K
D. Fe
Câu 5: Dãy nào gồm các chất là đơn chất?
A. CaO; Cl2; CO; CO2
B. N2; Cl2; C; Fe
C. CO2; MgCl2; CaCO3; HCl
D. Cl2; CO2; Ca(OH)2; CaSO4
Câu 6: Hóa trị của nitơ trong hợp chất nitơ đioxit (NO2) là?
A. I
B. II
C. IV
D. V
Câu 7: Magie oxit có công thức hóa học là MgO. Công thức hóa học của magie với nhóm (NO3) hóa trị I là?
A. Mg(NO3)2
B. (NO3)3Mg
C. MgNO3
D. Mg(NO3)3
Câu 8: Tính thể tích của 3.1023 phân tử khí oxi (O2) ở (đktc) là:
A. 8,96 lít.
B. 6,72 lít.
C. 4,48 lít.
D. 11,2 lít.
Câu 9: Khối lượng của 0,05 mol kim loại bạc là?
A. 10,8 gam
B. 1,08 gam
C. 108 gam
D. 5,4 gam
Câu 10: Cho phương trình hóa học sau: CH4 + 2O2 CO2 + 2H2O. Tỉ lệ số mol phân tử của CH4 phản ứng với số mol phân tử oxi là?
A. 1 : 2
B. 1: 3
C. 1: 4
D. 2: 1
Câu 11: Nguyên tố hóa học là gì?
A. Là tập hợp những nguyên tố cùng loại, có cùng số proton trong hạt nhân.
B. Là tập hợp những nguyên tử khác loại, có cùng số proton trong hạt nhân.
C. Là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân.
D. Là tập hợp những nguyên tử cùng loại, có cùng số proton và số nơtron trong hạt nhân.
Câu 12: Dãy chất nào sau đây chỉ gồm các hợp chất?
A. Cl2; Na2SO4; Na
B. O2; Ca; NaCl
C. NaCl; HCl; CaO
D. Ca(OH)2; P; Fe
Câu 13: Nguyên tố nào là nguyên tố phổ biến nhất (%) trên trái đất?
A. Zn
B. N
C. O
D. Al
Câu 14: Muốn tính thể tích chất khí ở đktc, ta dùng công thức nào sau đây?
A. V= 22,4.n
B. V= 22,4.m
C. V= 24.n
D. V= 22,4.M
Câu 15: Có phương trình hóa học: 4Na + O2 → 2Na2O. Tỉ lệ số nguyên tử, số phân tử trong phương trình hóa học là:
A. 1 : 2: 1
B. 4 :1 : 2.
C. 2: 2 :2 .
D. 4: 2: 1
Câu 16: Cho công thức hoá học của sắt (III) oxit là Fe2O3, thành phần % theo khối lượng của Fe là:
A. 30%
B. 50%
C. 70%
D. 90%
Câu 17: Hạt nhân nguyên tử được cấu tạo bởi hạt nào?
A. Proton và electron.
B. Proton và nơtron.
C. Nơtron và electron.
D. Proton, nơtron và electron.
Câu 18: Cách viết nào sau đây chỉ 3 nguyên tử oxi.
A. O3.
B. 3O2.
C. 3O.
D. 3O3.
Câu 19: Công thức đúng chuyển đổi giữa khối lượng chất và lượng chất là:
A. m = n. M.
B. M. n. m = 1.
C. M = m. n.
D. M = n : m.
Câu 20: Phân tử CH4 gồm mấy nguyên tử?
A. 5
B. 4
C. 3
D. 2
Câu 21: Cho 3,6 gam kim loại magie tác dụng vừa hết với 210 gam dung dịch axit clohiđric và thoát ra 0,3 gam khí hiđro. Khối lượng dung dịch magie clorua (MgCl2) sinh ra là:
A. 213g.
B. 213,3g.
C. 214,4g.
D. 214g
Câu 22: Chất khí A có , công thức hóa học của A là:
A. SO2.
B. CO2.
C. N2.
D. NH3.
Câu 23: Số phân tử của 14 gam khí nitơ là bao nhiêu?
A. 6.1023.
B. 1,5.1023.
C. 9.1023.
D. 3.1023.
Câu 24: Hỗn hợp nào dưới đây có thể tách riêng các chất, bằng cách cho hỗn hợp vào nước sau đó khuấy kỹ và lọc:
A. Đường và muối.
B. Bột than và bột sắt.
C. Cát và muối ăn.
D. Giấm và rượu.
Câu 25: 1 mol khí CO2 ở đktc có thể tích là:
A. 22,4 lít.
B. 33,6 lít.
C. 24 lít.
D. 11,2 lít.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1. A |
2. C |
3. C |
4. D |
5. B |
6. C |
7. A |
8. D |
9. D |
10. A |
|
11. C |
12. C |
13. C |
14. A |
15. B |
16. C |
17. B |
18. C |
19. A |
20. A |
|
21. B |
22. C |
23. D |
24. C |
25. A |
|
|
|
|
|
Câu 1: Trong nguyên tử, hạt electron mang điện tích âm.
→ Đáp án A
Câu 2: Nguyên tử khối là khối lượng của một nguyên tử tính bằng đơn vị cacbon (đvC).
→ Đáp án C
Câu 3: Hiện tượng hóa học là hiện tượng chất này biến đổi thành chất khác.
→ Cháy rừng tạo ra khói đen là hiện tượng hóa học.
→ Đáp án C
Câu 4:
Nguyên tử khối của X là: MX = 3,5.16 = 56
→ X là Fe
→ Đáp án D
Câu 5: Đơn chất là những chất chỉ tạo bởi một nguyên tố hóa học.
→ Đáp án B
Câu 6: Gọi hóa trị của N trong công thức NO2 là a.
Theo quy tắc hóa trị, ta có: a.1 = 2.II → a = IV
→ Đáp án C
Câu 7: Gọi hóa trị của Mg là a.
Theo quy tắc hóa trị, ta có: a. 1 = II. 1 → a = II.
Gọi công thức hóa học của Mg với nhóm (NO3) là Mgx(NO3)y.
Theo quy tắc hóa trị, ta có: II.x = I.y
→ x = 1 và y = 2.
→ Công thức hóa học cần tìm là Mg(NO3)2.
→ Đáp án A
Câu 8:
Số mol khí oxi là
Thể tích khí oxi là lít
→ Đáp án D
Câu 9: Khối lượng của 0,05 mol kim loại bạc là 0,05.108 = 5,4 gam
→ Đáp án D
Câu 10: Tỉ lệ số mol phân tử của CH4 phản ứng với số mol phân tử oxi là 1 : 2.
→ Đáp án A
Câu 11:
Nguyên tố hóa học là tập hợp những nguyên tử cùng loại, có cùng số proton trong hạt nhân.
→ Đáp án C
Câu 12: Hợp chất là những chất tạo được bởi từ hai nguyên tố hóa học trở nên.
→ Đáp án C
Câu 13: Nguyên tố O là nguyên tố phổ biến nhất trên trái đất.
→ Đáp án C
Câu 14: Ở điều kiện tiêu chuẩn, muốn tính thể tích chất khí ta dùng công thức sau:
V = n.22,4 (lít)
→ Đáp án A
Câu 15:
Tỉ lệ số nguyên tử, số phân tử trong phương trình hóa học là 4 : 1 : 2.
→ Đáp án B
Câu 16: Thành phần phần trăm theo khối lượng của Fe là:
→ Đáp án C
Câu 17: Hạt nhân nguyên tử được cấu tạo bởi hạt proton và nơtron.
→ Đáp án B
Câu 18:
Cách viết chỉ 3 nguyên tử oxi là 3O
→ Đáp án C
Câu 19: Công thức đúng chuyển đổi giữa khối lượng chất và lượng chất là:
m = n. M
→ Đáp án A
Câu 20: Phân tử CH4 gồm 5 nguyên tử, trong đó có 4H và 1C.
→ Đáp án A
Câu 21: Khối lượng dung dịch magie clorua là:
mdd = 3,6 + 210 – 0,3 = 213,3 gam
→ Đáp án B
Câu 22:
Nguyên tử khối của A là: MA = 14.2 = 28 đvC
→ Chất khí A là N2.
→ Đáp án C
Câu 23: Số phân tử của 14 gam khí nitơ là
→ Đáp án D
Câu 24:
Hỗn hợp nào dưới đây có thể tách riêng các chất, bằng cách cho hỗn hợp vào nước sau đó khuấy kỹ và lọc → 1 chất rắn tan hoàn toàn trong nước và 1 chất rắn không tan trong nước.
→ Đáp án C
Câu 25:
Ở điều kiện tiêu chuẩn, thể tích khí CO2 là 1.22,4 = 22,4 lít
→ Đáp án A
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 7
Câu 1: (1 điểm) Đơn chất là gì? Viết công thức hoá học của 2 đơn chất
Câu 2: (1 điểm) Hiện tượng hoá học là gì? Cho ví dụ?
Câu 3: (3 điểm) Lập PTHH của các phản ứng sau:
a. Mg + O2 MgO
b. Fe + Cl2 FeCl3
c. NaOH + CuCl2 Cu(OH)2 + NaCl
d. HCl + Mg MgCl2 + ?
e. Fe2O3 + HCl FeCl3 + H2O
f. Al + O2 Al2O3
Câu 4: ( 2 điểm) Một chất khí A có tỉ khối đối với H2 là 8, có thành phần các nguyên tố gồm: 75% C và 25% H. Hãy lập công thức hoá học của hợp chất A (Biết C = 12 , H = 1)
Câu 5: (3 điểm) Cho 13g kẽm tác dụng với HCl theo sơ đồ phản ứng
Zn + HCl ZnCl2 + H2
a. Lập PTHH của phản ứng.
b. Tính khối lượng HCl đã tham gia phản ứng
c. Tính thể tích khí H2 (ĐKTC) đã sinh ra sau phản ứng
(Biết Zn = 65 , H = 1 , Cl = 35,5)
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 8
Câu 1 (2,0 điểm)
a) Hãy cho biết thế nào là đơn chất? Hợp chất?
b) Trong số các công thức hóa học sau: CO2, O2, Zn, CaCO3, công thức nào là công thức của đơn chất? Công thức nào là công thức của hợp chất?
Câu 2 (1,0 điểm): Lập công thức hóa học và tính phân tử khối của:
a) Fe (III) và O.
b) Cu (II) và PO4 (III).
Câu 3 (3,0 điểm)
a) Thế nào là phản ứng hóa học? Làm thế nào để biết có phản ứng hóa học xảy ra?
b) Hoàn thành các phương trình hóa học cho các sơ đồ sau:
Al + O2 ![]() Al2O3
Al2O3
Na3PO4 + CaCl2 → Ca3(PO4)2 + NaCl
Câu 4 (2,0 điểm)
a) Viết công thức tính khối lượng chất, thể tích chất khí (đktc) theo số mol chất.
b) Hãy tính khối lượng và thể tích (đktc) của 0,25 mol khí NO2.
Câu 5 (1,0 điểm): Xác định công thức hóa học của hợp chất tạo bởi 40% S, 60% O. Khối lượng mol của hợp chất là 80 gam.
Câu 6 (1,0 điểm): Khi đốt dây sắt, sắt phản ứng cháy với oxi theo phương trình:
3Fe + 2O2 ![]() Fe3O4
Fe3O4
Tính thể tích khí O2 (đktc) cần dùng để phản ứng hoàn toàn với 16,8 gam Fe.
(Cho: Fe = 56; Cu = 64; P = 31; O = 16; N = 14; O = 16)
ĐÁP ÁN
Câu 1.
Đơn chất là những chất tạo bởi 1 nguyên tố hóa học.
Hợp chất là những chất tạo bởi 2 nguyên tố hóa học trở lên.
Công thức của đơn chất: O2, Zn
Công thức của hợp chất: CO2, CaCO3.
Câu 2
Fe2O3 = 2.56 + 3.16 = 160 (đvc)
Cu3(PO4)2 = 3.64 + 2(31 + 4.16) = 382 (đvc)
Câu 3
a) Khái niệm phản ứng hóa học: Quá trình biến đổi chất này thành chất khác gọi là phản ứng hóa học.
* Dấu hiệu nhận biết có phản ứng xảy ra: Chất mới tạo thành có tính chất khác với chất ban đầu về trạng thái, màu sắc, ... Sự tỏa nhiệt và phát sáng cũng có thể là dấu hiệu của phản ứng.
b) Mỗi phương trình viết đúng: 1,0 điểm
4Al + 3O2 ![]() 2Al2O3
2Al2O3
2Na3PO4 + 3CaCl2→ Ca3(PO4)2 + 6NaCl
Câu 4
a) Viết đúng mỗi công thức tính
- Công thức tính khối lượng khi biết số mol: m = n x M (gam).
- Công thức tính thể tích chất khí (đktc) khi biết số mol: V = n x 22,4 (lít).
b)
mNO2 = 0,25 x 46 = 11,5 gam.
VNO2 = 0,25 x 22,4 = 5,6 lít.
Câu 5
- Khối lượng mỗi nguyên tố trong 1 mol hợp chất:
nS = (40% x 80)/100% = 32 gam; nO = 80 – 32 = 48 gam
- Số mol nguyên tử từng nguyên tố có trong 1 mol hợp chất:
nS = 32 : 32 = 1 mol; nO = 48 : 16 = 3 mol
- CTHH của hợp chất: SO3
Câu 6
nFe = 16,8 : 56 = 0,3 mol
Theo PTHH: 3 mol Fe phản ứng hết với 2 mol O2
Vậy: 0,3 mol Fe phản ứng hết với x mol O2
x = 0,2 mol
VO2= 0,2 x 22,4 = 4,48 líT
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 9
I. Lí thuyết: (5,0 điểm)
Câu 1: (1,0 điểm) Nêu khái niệm nguyên tử là gì? Nguyên tử có cấu tạo như thế nào?
Câu 2: (1,0 điểm) Nêu khái niệm đơn chất là gì? Hợp chất là gì? Cho ví dụ minh họa?
Câu 3: (1,0 điểm) Công thức hóa học CuSO4 cho ta biết ý nghĩa gì? (Biết Cu = 64; S = 32; O = 16)
Câu 4: (1,0 điểm)
a. Khi cho một mẩu vôi sống (có tên là canxi oxit) vào nước, thấy nước nóng lên, thậm chí có thể sôi lên sùng sục, mẩu vôi sống tan ra. Hỏi có phản ứng hóa học xảy ra không? Vì sao?
b. Viết phương trình hóa học bằng chữ cho phản ứng tôi vôi, biết vôi tôi tạo thành có tên là canxi hiđroxit
Câu 5: (1,0 điểm) Nêu khái niệm thể tích mol của chất khí? Cho biết thể tích mol của các chất khí ở đktc?
II. Bài tập: (5,0 điểm)
Câu 6: (2,0 điểm) Cho sơ đồ của các phản ứng sau:
a. Na + O2 - - -- > Na2O
b. KClO3 - - - - > KCl + O2 ↑
Hãy viết thành phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phương trình hóa học lập được
Câu 7: (1,0 điểm) Để chế tạo mỗi quả pháo bông nhằm phục vụ cho các chiến sĩ biên phòng giữ gìn biên giới hải đảo ở Quần đảo Trường sa đón xuân về, người ta cho vào hết 600 gam kim loại Magie (Mg), khi pháo cháy trong khí oxi (O2) sinh ra 1000 gam Magie oxit (MgO)
a. Viết công thức về khối lượng của phản ứng?
b. Tính khối lượng khí oxi (O2) tham gia phản ứng?
Câu 8: (2,0 điểm) Hợp chất A có tỉ khối so với khí oxi là 2.
a. Tính khối lượng mol của hợp chất?
b. Hãy cho biết 5,6 lít khí A (ở đktc) có khối lượng là bao nhiêu gam?
ĐÁP ÁN
|
Nội dung |
Điểm |
|
I. Lý thuyết |
|
|
Câu 1 - Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện. - Nguyên tử gồm hạt nhân mang điện tích dương và vỏ tạo bởi một hay nhiều electron mang điện tích âm. |
0,5 điểm 0,5 điểm
|
|
Câu 2 - Đơn chất là những chất tạo nên từ một nguyên tố hóa học Ví dụ: Cu; H2 - Hợp chất là những chất tạo nên từ hai nguyên tố hóa học trở lên Ví dụ: H2O; H2SO4 |
0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm |
|
Câu 3 - Công thức hóa học CuSO4 cho ta biết: - Nguyên tố Cu; S; O tạo nên chất - Trong hợp chất có 1Cu; 1S; 4O - Phân tử khối: 64 + 32 + 16.4 = 160(đvC) |
0,25 điểm 0,25 điểm 0,25 điểm 0,25 điểm |
|
Câu 4 a. Có xảy ra phản ứng hóa học vì miếng vôi sống tan, phản ứng tỏa nhiệt nhiều làm nước sôi. b. Phương trình chữ: Canxi oxit + nước → Canxi hiđroxit |
0,5 điểm 0,5 điểm |
|
Câu 5 - Thể tích mol của chất khí là thể tích chiếm bởi N phân tử chất đó. - Ở đktc, thể tích mol của các chất khí đều bằng 22,4 lít |
0,5 điểm 0,5 điểm |
|
II. Bài tập |
|
|
Câu 6 a. 4Na + O2 Có tỉ lệ: Số nguyên tử Na: Số phân tử O2: Số phân tử Na2O = 4 : 1 : 2 b. 2KClO3 Có tỉ lệ: Số phân tử KClO3: Số phân tử KCl: Số phân tử O2 = 2 : 2 : 3 |
0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm |
|
Câu 7 a) Áp dụng theo định luật bảo toàn khối lượng, ta có công thức về khối lượng của phản ứng mMg + mO2 = mMgO b) Khối lượng khí oxi tham gia phản ứng: => mO2 = mMgO - mMg = 1000 - 600 = 400 (gam) |
0,5 điểm
0,5 điểm
|
|
Câu 8 a) Khối lượng mol của hợp chất A là: MA = dA/O2.MO2 = 2 . 32 = 64 (gam) b) Số mol của hợp chất A là: nA = V/22,4 = 5,6/22,4 = 0,25 (mol) Khối lượng của 5,6 lít khí A (ở đktc) là: mA = n.MA = 0,25 . 64 = 16 (gam) |
1,0 điểm
0,5 điểm
0,5 điểm |
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 10
I. Trắc nghiệm (2,0 điểm).
Chọn đáp án đúng nhất trong các phương án trả lời sau.
Câu 1. Các nguyên tử của cùng một nguyên tố hóa học có cùng:
A. Số proton trong hạt nhân.
B. Số nơtron
C. Số điện tử trong hạt nhân
D. Khối lượng
Câu 2. Hiện tượng nào sau đây là hiện tượng hóa học?
A. Nhôm nung nóng chảy để đúc xoong, nồi...
B. Than cần đập vừa nhỏ trước khi đưa vào bếp lò.
C. Cồn để trong lọ không kín bị bay hơi.
D. Trứng để lâu ngày sẽ bị thối.
Câu 3. Trong công thức hóa học của hiđrô sunfua (H2S) và khí sunfurơ (SO2), hóa trị của lưu huỳnh lần lượt là:
A. I và II
B. II và IV
C. II và VI.
D. IV và VI
Câu 4. Hỗn hợp khí gồm khí O2 và khí CO2 có tỉ khối đối với khí Hiđrô là 19, thành phần % các khí trong hỗn hợp lần lượt là:
A. 60%; 40%
B. 25%; 75%
C. 50%; 50%
D. 70%; 30%
II. Tự luận (8,0 điểm).
Câu 5. Hoàn thành các phương trình hóa học sau:
? + O2 → Al2O3
Fe + ? → FeCl3
Na + H2O → NaOH + H2
? + HCl → ZnCl2 + H2
CxHy + O2 → CO2 + H2O
Câu 6. Lập công thức hóa học của hợp chất gồm Al(III) liên kết với Cl(I). Tính thành phần phần trăm theo khối lượng các nguyên tố trong hợp chất đó?
Câu 7. a) Tính khối lượng, thể tích (ở đktc) và số phân tử CO2 có trong 0,5 mol khí CO2?
b) Đốt cháy hoàn toàn m gam chất X cần dùng 4,48 lít khí O2(đktc) thu được 2,24 lít CO2 (đktc) và 3,6 gam H2O. Viết sơ đồ phản ứng và tính khối lượng chất ban đầu đem đốt?
(Cho biết: C = 12, O = 16, S = 32, H = 1, Al = 27, Cl = 35,5)
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 11
Phần 1: Câu hỏi trắc nghiệm (3 điểm)
Khoanh vào chữ cái đặt trước câu trả lời đúng nhất (0,3đ)
Câu 1. Hạt nhân được cấu tạo bởi:
A. Notron và electron
B. Proton và electron
C. Proton và nơtron
D. Electron
Câu 2. Chất nào dưới đây là đơn chất?
| A. Muối ăn | B. Khí oxi | C. Đường | D. Axit sunfuric |
Câu 3. Trong P2O5, P hóa trị mấy
| A. I | B. II | C. IV | D. V |
Câu 4. Hiện tượng nào sau đây là hiện tượng hóa học?
A. Nước đun sôi để vào ngăn đá tủ lạnh, sau đó thấy nước đông cứng
B. Hòa tan một ít vôi sống vào nước
C. Sáng sớm thấy sương mù
D. Mở chai nước giải khát thấy bọt khí thoát ra
Câu 5. Khí nitơ tác dụng với khi hidro tạo thành khí amoniac NH3. Phương trình hóa học của phản ứng trên là:
A. N + 3H → NH3
B. N2+ 6H → 2NH3
C. N2 + 3H2 → 2NH3
D. N2 + H2 → NH3
Câu 6. Từ công thức hóa học Fe(NO3)2 cho biết ý nghĩa nào đúng?
(1) Hợp chất do 3 nguyên tố Fe, N, O tạo nên
(2) Hợp chất do 3 nguyên tử Fe, N, O tạo nên
(3) Có 1 nguyên tử Fe, 2 nguyên tử N và 3 nguyên tử O
(4) Phân tử khối bằng: 56 + 14.2 + 16.6 = 180 đvC
A. (1), (3), (4)
B. (2), (4)
C. (1), (4)
D. (2), (3), (4)
Câu 7. Hòa tan 3,6 gam Mg vào 10,95 gam axit clohidric HCl thu được magie clorua MgCl2 và 0,6 g H2. Tính khối lượng của magie clorua?
| A. 13,95 gam | B. 27,9 gam | C. 14,5 gam | D. 9,67 gam |
Câu 8. Khí SO2 nặng hay nhẹ hơn không khí bao lần
A. Nặng hơn không khí 2,2 lần
B. Nhẹ hơn không khí 3 lần
C. Nặng hơn không khí 2,4 lần
D. Nhẹ hơn không khí 2 lần
Câu 9. Tính %mK có trong phân tử K2CO3
| A. 56, 502% | B. 56,52% | C. 56,3% | D. 56,56% |
Câu 10. Phát biểu nào sau đây không đúng về phản ứng hóa học?
A. Phản ứng hóa học xảy ra sự thay đổi liên kết giữa các nguyên tử
B. Khi phản ứng hóa học xảy ra, lượng chất tham gia tăng dần theo thời gian phản ứng.
C. Một số phản ứng hóa học cần xúc tác để phản ứng xảy ra nhanh hơn.
D. Chất kết tủa hoặc chất khí bay lên là dấu hiệu thể hiện phản ứng hóa học xảy ra.
Phần 2. Tự luận (7 điểm)
Câu 1. Chọn hệ số thích hợp để cân bằng các phản ứng sau:
1) FeO + HCl → FeCl2 + H2O
2) Fe2O3 + H2SO4 → Fe2(SO4)3 + H2O
3) Cu(NO3)2 + NaOH → Cu(OH)2 + NaNO3
4) P + O2 → P2O5
Câu 2. Hãy tính:
a) Số mol CO2 có trong 11g khí CO2 (đktc)
b) Số gam của 2,24 lít khí SO2 (đktc)
c) Số gam của của 0,1 mol KClO3
d)Thể tích (đktc) của 9.1023 phân tử khí H2
Câu 3. Một hợp chất X của S và O có tỉ khối đối với không khí là 2,207
a) Tính MX
b) Tìm công thức hóa học của hợp chất X biết nguyên tố S chiếm 50% khối lượng.
Câu 4. Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Phương trình hoá học của phản ứng là S + O2 → SO2. Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất? Vì sao?
b) Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 1,5 mol nguyên tử lưu huỳnh.
c) Khí sunfurơ nặng hay nhẹ hơn không khí?
ĐÁP ÁN
Phần 1: Trắc nghiệm khách quan
| 1 C | 2 B | 3 D | 4 B | 5 C |
| 6 A | 7 A | 8 A | 9 B | 10 B |
Câu 1.
1) FeO + 2HCl → FeCl2 + H2O
2) Fe2O3 + 2H2SO4 → Fe2(SO4)3 + 2H2O
3) Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
4) 4P + 5O2 → 2P2O5
Câu 2.
a) Số mol CO2 có trong 11g khí CO2 (đktc)
nCO2 = 11/44 = 0,25 mol
b) Số gam của 2,24 lít khí N2O5 (đktc)
nN2O5 = 2,24/22,4 = 0,1 mol => mN2O5 = 0,1.108 = 10,8 gam
c) Số gam của của 0,1 mol KClO3
mKClO3 = 0,1. 122,5 = 12,15 gam
d)Thể tích (đktc) của 9.1023 phân tử khí H2
nH2 = 9.1023/6.1023 = 1,5 mol => V = 1,5.22,4 = 33,6 lít
Câu 3.
a) Phân tư khối của hợp chất X bằng: dM/29 = 2,207 => M = 2,207.29 = 64
b) Gọi công thức của hợp chát X là SxOy
Câu 4.
Lưu huỳnh (S) cháy trong không khí sinh ra khí sunfurơ (SO2). Phương trình hoá học của phản ứng là S + O2 → SO2. Hãy cho biết:
a) Những chất tham gia và tạo thành trong phản ứng trên, chất nào là đơn chất, chất nào là hợp chất? Vì sao?
Chất tham gia: S, O2
Đơn chất: S, O2
Hợp chất: SO2
Đơn chất là gồm 1 hay nhiều nguyên tử của 1 nguyên tố tạo thành
b)
Phương trình hóa học: S + O2 → SO2
Theo phương trình: 1mol 1mol
Theo đầu bài 1,5 mol x mol
=> nS = nO2 = 1,5 mol => VO2 = n.22,4 = 1,5.22,4 = 33,6 lít
Khí SO2 nặng hơn không khí: dSO2/29 = 64/29 = 2,2 lần
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 12
I. Phần trắc nghiệm (3,0 điểm).
Em hãy lựa chọn đáp án đúng trong các câu sau.
Câu 1. Dãy nào gồm các chất là hợp chất?
A. CaO; Cl2; CO; CO2
B. Cl2; N2; Mg; Al
C. CO2; NaCl; CaCO3; H2O
D. Cl2; CO2; Ca(OH)2; CaSO4
Câu 2. Hóa trị của Nitơ trong hợp chất đi nitơ oxit (N2O) là?
A. I
B. II
C. IV
D. V
Câu 3. Magie oxit có CTHH là MgO. CTHH của magie với clo hóa trị I là?
A. MgCl3
B. Cl3Mg
C. MgCl2
D. MgCl
Câu 4. Hiện tượng biến đổi nào dưới đây là hiện tượng hóa học?
A. Bóng đèn phát sáng, kèm theo tỏa nhiệt.
B. Hòa tan đường vào nước để được nước đường.
C. Đung nóng đường, đường chảy rồi chuyển màu đen, có mùi hắc.
D. Trời nắng, nước bốc hơi hình thành mây.
Câu 5. Khối lượng của 0,1 mol kim loại sắt là?
A. 0,28 gam
B. 5,6 gam
C. 2,8 gam
D. 0,56 gam
Câu 6. Cho phương trình hóa học sau: C + O2 → CO2. Tỉ lệ số mol phân tử của C phản ứng với số mol phân tử oxi là?
A. 1 : 2
B. 1: 4
C. 2: 1
D. 1: 1
II. Phần tự luận. (7,0 điểm)
Câu 1. (3,0 điểm) Em hãy lập PTHH cho các sơ đồ phản ứng sau?
1. NaOH + Fe2(SO4)3 ---> Fe(OH)3 + Na2SO4
2. Mg + AgNO3 ---> Mg(NO3)2 + Ag
3. Na + O2 ---> .........
4. ......... + HCl ---> AlCl3 + .......
Câu 2. (1,5 điểm) Em hãy tính khối lượng của:
a) 0,05 mol sắt từ oxit (Fe3O4)
b) 2,24 lít khí lưu huỳnh đi oxit SO2 ở đktc.
Câu 3. (2,5 điểm)
Đốt cháy hoàn toàn 1,2 gam cacbon trong không khí sinh ra khí cacbon đi oxit (CO2).
a. Viết PTHH của phản ứng. Biết cacbon đã phản ứng với oxi trong không khí.
b. Tính thể tích khí oxi trong không khí đã tham gia phản ứng và thể tích khí cacbon đi oxit sinh ra? Biết thể tích các chất khí đo ở đktc.
c. Ở nước ta, phần lớn người dân đều sử dụng than (có thành phần chính là cacbon) làm nhiên liệu cháy. Trong quá trình đó, sinh ra một lượng lớn khí thải cacbon đi oxit gây hiệu ứng nhà kính, ô nhiễm môi trường không khí. Em hãy đề suất giải pháp nhằm hạn chế khí thải cacbon đi oxit trên? Giải thích?
(Cho Fe = 56; C = 12; O = 16; S = 32)
ĐÁP ÁN
I. Phần trắc nghiệm. (3,0 điểm)
Với mỗi câu đúng, học sinh được 0,5 điểm.
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 | Câu 6 |
| C | A | C | C | B | D |
II. Phần tự luận. (7,0điểm)
|
Đáp án |
Điểm |
|
|
Câu 1 |
6NaOH + Fe2(SO4)3→ 2Fe(OH)3 + 3Na2SO4 Mg + 2AgNO3→ Mg(NO3)2+ 2 Ag 4 Na + O2 → 2Na2O Học sinh viết đúng CTHH của Na2O -Học sinh cân bằng đúng PTHH 2 Al + 6HCl → 2AlCl3+ 3H2 - Học sinh xác định đúng Al và H2 - Học sinh cân bằng đúng PTHH. (Trường hợp học sinh sai mũi tên kí hiệu trong PTHH cứ 2 PTHH trừ 0,25 điểm) |
0,5 0,5 1,0 0,5 0,5 1,0 0,5 0,5 |
|
Câu 2 |
a) Học sinh tính đúng MFe3O4= 3.56 + 4.16 = 232 đvC Tính đúng Khối lượng mH2SO4= n.M = 0,05.232 = 1,16g b) Học sinh tính đúng số mol SO2= 0,1 mol Tính đúng khối lượng m = n.M = 0,1.(32 +2.16) = 6,4 g |
0,5
0,5 0,5 |
|
Câu 3. |
HS tính số mol cacbon có trong 1,2 g cacbon mC = nC.MC => nc = mC : MC = 1,2 : 12 = 0,1 mol a)Viết và cân bằng PTHH: C + O2→CO2 Tính đúng: Theo PT: 1mol - 1 mol - 1 mol Theo ĐB: 0,1 mol – 0,1mol – 0,1mol b) Học sinh tính đúng thể tích Oxi và thể tích cacbon đi oxit Voxi= noxi . 22,4 = 0,1. 22,4 = 2,24 lít Vcacbonđioxit = ncacbonđioxit.22,4 = 0,1.22,4 = 2,24 lít Học nêu được giải pháp và giải thích Nội dung câu hỏi mở, tùy giáo viên cho điểm khích lệ học sinh hoặc thêm 1 điểm của câu hỏi này vào nội dung ở câu khác. |
0,25
0,25 0,5
0,25
0,25 1,0 |
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa Học 8
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hoá học lớp 8 năm 2022 - 2023 có đáp án Đề số 13
I. TRẮC NGHIỆM KHÁCH QUAN (4 điểm)
Đọc các câu sau và ghi chữ cái đứng trước vào câu trả lời đúng nhất vào bảng sau.
Câu 1: Muốn thu khí NH3 vào bình thì thu bằng cách:
A. Đặt úp ngược bình
B. Đặt đứng bình
C. Cách nào cũng được
D. Đặt nghiêng bình
Câu 2: Tỉ khối của khí A đối với khí nitơ (N2) là 1,675 .Vậy khối lượng mol của khí A tương đương:
A. 45g
B. 46g
C.47g
D.48g
Câu 3: Thành phần phần trăm theo khối lượng của nguyên tố S trong hợp chất SO2 là:
A. 40%
B. 60%
C. 20%
D. 50%
Câu 4: “Chất biến đổi trong phản ứng là.........., còn chất mới sinh ra gọi là.........”
A. chất xúc tác – sản phẩm
B. chất tham gia – chất phản ứng
C. chất phản ứng – sản phẩm
D. chất xúc tác – chất tạo thành
Câu 5: Đun nóng đường, đường chảy lỏng. Đây là hiện tượng:
A. vật lý
B. hóa học
C. sinh học
D. tự nhiên
Câu 6: Thể tích mol của chất khí là thể tích chiếm bởi N….. của khí đó. Từ thích hợp là:
A. nguyên tử
B. số mol
D. khối lượng
D.phân tử
Câu 7: Cho các khí sau: N2, H2, CO, SO2, khí nào nặng hơn không khí ?
A. Khí N2
B. Khí H2
C. Khí CO
D. Khí SO2
Câu 8: Số mol của 0,56 gam khí nitơ là:
A. 0,01 mol
B. 0,02 mol
C. 0,025 mol
D. 0,1 mol
Câu 9: Cho phương trình: Cu + O2→ CuO. Phương trình cân bằng đúng là:
A. 2Cu + O2 → CuO
B. Cu + O2 → 2CuO
C. 2Cu + 2O2→ 4CuO
D. 2Cu + O2 → 2CuO
Câu 10: Phát biểu nào sau đây là đúng ?
A. Thủy tinh nóng chảy thổi thành bình cầu là hiện tượng hóa học
B. Công thức hóa học của Fe(III) và O(II) là Fe3O2
C. Ở điều kiện tiêu chuẩn, 1 mol chất khí có thể tích là 22,4 lít
D. Nguyên tử cùng loại có cùng số proton và số nơtron trong hạt nhân
Câu 11: Trong các phương trình sau, phương trình nào cân bằng sai ?
A. 2Fe + 3Cl2→ 2FeCl3
B. 2H2 + O2 → 2H2O
C. 2Al + 3O2 → 2Al2O3
D. Zn + 2HCl → ZnCl2 + H2
II. TỰ LUẬN ( 6 điểm)
Câu 1( 1 điểm)Tính số mol của:
a) 142g Cl2;
b) 41,1 g H2SO4;
c) 9.1023 phân tử Na2CO3;
d)16,8 lít khí CO2 (đktc)
Câu 2: (1,5 điểm) Cân bằng các phương trình sau:
a) K + O2 ---> K2O
b) NaOH + Fe2(SO4)3 ---> Fe(OH)3 + Na2SO4
c) BaCl2 + AgNO3 ---> AgCl + Ba(NO3)2
Câu 3 (1,5 điểm) Một hợp chất khí có thành phần phần trăm theo khối lượng là 82,35% N và 17,65 % H Hãy cho biết công thức hóa học của hợp chất. Biết hợp chất này có tỉ khối với khí hiđro là 8,5.
Câu 4 (1 điểm) Đốt cháy 18g kim loại magie Mg trong không khí thu đuợc 30g hợp chất magie oxit (MgO). Biết rằng Mg cháy là xảy ra phản ứng với khí oxi trong không khí.
a) Viết công thức về khối lượng của phản ứng.
b) Tính khối lượng khí oxi đã phản ứng.
Câu 5 (1 điểm) Hợp chất D có thành phần là: 7 phần khối lượng nitơ kết hợp với 20 phần khối lượng oxi. Tìm công thức hóa học của hợp chất D.
(Biết N = 14; H= 1;C= 12; O= 16; S= 32; Cl= 35,5; Na = 23)
ĐÁP ÁN
Câu hỏi trắc nghiệm khách quan
| 1 A | 2 C | 3 D | 4 C | 5 A | 6 D |
| 7 D | 8 B | 9 D | 10 C | 11 C |
Câu hỏi tự luận
Câu 1 ( 1 điểm)Tính số mol của:
a) 142g Cl2;
nCl2 = 142/71 = 2 mol
b) 41,1 gam H2SO4;
nH2SO4 = 41,4/98 = 0,422 mol
c) 9.1023 phân tử Na2CO3;
1mol chứa 6.022.1023 ng tử) + 1mol chứa 6.022.1023 ng tử
⇒ 9.1023 phân tử có số mol là: 9.1023/6.022.1023 = 1,5 mol
+ nNa = 1,5.2= 3 mol + nNa= 1.5.2= 3 mol
+ nC = 1.5 mol + nC= 1,5 mol
+ nO= 1,5.3 = 4,5 mol
d)16,8 lít khí CO2 (đktc)
nCO2 = 16.8/22,4 = 0,75 mol
Câu 2:
a) 4K + O2 → 2K2O
b) Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4
c) BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl
Câu 3 (1,5 điểm)
MA=dA/H2.MH2 = 8,5.2 =17 gam
Khối lượng của mỗi nguyên tố trong 1 mol hợp chất là:
mN = (82,35.17)/100 = 14 gam và mH = (17,65.17)/100 = 3 gam
Số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất là:
nN = 14/14 = 1 mol và nH = 3/1 = 3 mol
Vậy công thức hoá học của hợp chất là NH3
Câu 4 (1 điểm)
a.
Phương trình hóa học :
2Mg + O2 → 2MgO
Áp dụng định luật bảo toàn khối lượng
Ta có: mMg + mO2 = mMgO
b.
mMg + mO2= mMgO
→18 + mO2= 30 → 18 + mO2= 30
⇔ mO2 = 30 − 18 = 12 (g)
Câu 5 (1 điểm)
Gọi Công thức hóa học của của D là NxOy
Vì D có 7 phần khối lượng N kết hợp với 20 phần oxi nên
x: y = 7/14 : 20/16 = 2:5
=> Công thức hóa học của D là N2O5
Để xem trọn bộ Đề thi Hóa học 8 có đáp án, Thầy/ cô vui lòng Tải xuống!
Xem thêm các bộ đề thi Hoá học lớp 8 chọn lọc, hay khác:
Đề cương Học kì 1 Hoá học lớp 8 năm 2023 chi tiết nhất
Bài tập Hóa học lớp 8 Học kì 1 có đáp án
Các dạng bài tập Hóa học lớp 8 Học kì 1
Hệ thống kiến thức Hóa học lớp 8 Học kì 1
TOP 30 Đề thi Giữa Học kì 2 Hoá học lớp 8 năm 2023 có đáp án
