Hệ thống kiến thức Hóa học lớp 8 Giữa học kì 2
Hệ thống kiến thức Hóa học lớp 8 Giữa học kì 2 chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hoá học 8 Giữa học kì 2. Mời các bạn cùng đón xem:
[Năm 2023] Hệ thống kiến thức Hóa học lớp 8 Giữa học kì 2
CHƯƠNG 4: OXI-KHÔNG KHÍ
I. TÍNH CHẤT CỦA OXI
1. Tính chất vật lí
Là chất khí, không màu, không mùi, ít tan trong nước, nặng hơn không khí. Oxi hóa lỏng ở nhiệt độ -183oC, oxi ở thể lỏng có màu xanh nhạt.
2. Tính chất hóa học
Oxi là một đơn chất phi kim hoạt động mạnh, đặc biệt là ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất.
a. Tác dụng với phi kim (S, N, P…)
S + O2 SO2 (cháy sáng ngọn lửa màu xanh nhạt)
b. Tác dụng với kim loại
Oxi có thể tác dụng với hầu hết các kim loại dưới tác dụng của nhiệt độ để tạo ra các oxit (trừ một số kim loại Au, Ag, Pt oxi không phản ứng
2Mg + O2 2MgO
2Zn + O2 2ZnO
c. Tác dụng với hợp chất
2H2S + 3O2 2SO2 + 2H2O
II. SỰ OXI HÓA - PHẢN ỨNG HÓA HỢP - ỨNG DỤNG CỦA OXI
1. Sự oxi hóa
Là sự tác dụng của oxi với một chất
2. Phản ứng hóa hợp
Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Phản ứng cần nâng nhiệt độ lên để khơi mào phản ứng lúc đầu, các chất sẽ cháy, tỏa nhiều nhiệt gọi là phản ứng tỏa nhiệt.
III. OXIT
1. Định nghĩa
Oxit là hợp chất của ha nguyên tố , trong đó có một nguyên tố là oxi
2. Phân loại:
a. Oxit axit:
Thường là oxit của phi kim và tương ứng với một axit
Vd: SO3 tương ứng với axit H2SO4
b. Oxit bazơ
Thường là oxit của kim loại và tương ứng với một bazơ
NaO tương ứng với NaOH
3. Cách gọi tên:
Tên oxit = tên nguyên tố + oxit
- Nếu kim loại có nhiều hóa trị
Tên oxit = tên kim loại (hóa trị) + oxit
VD: FeO: sắt (II) oxit
- Nếu phi kim có nhiều hóa trị
Tên gọi = tên phi kim + oxit
Dùng các tiền tố ( tiếp đầu ngữ) chỉ số nguyên tử
+ Mono: một
+ Đi: hai
+ Tri: ba
+ Tetra: bốn
+ Penta: năm
VD: CO: cacbon monooxit
IV. Điều chế khí oxi - Phản ứng phân hủy
1. Điều chế oxi
a. Trong phòng thí nghiệm
Đun nóng hợp chất giâu oxi và dễ bị phân hủy ở nhiệt độ cao như kali pemanganat KMnO4 hoặc kali clorat KClO3 trong ống nghiệm, oxi thoát ra theo
2KMnO4 K2MnO4 + MnO2 + O2
2KClO3 2KCl + 3O2
b. Trong công nghiệp
- Sản xuất từ không khí: hóa lỏng không khí ở nhiệt độ thấp và áp suất cao. Trước hết thu được Nitơ (-196°C) sau đó là Oxi (- 183°C)
- Sản xuất từ nước: điện phân nước
2. Phản ứng phân hủy
Là phản ứng hóa học trong đó từ môtj chất sinh ra nhiều chất mới.
VD: 2KMnO4 K2MnO4 + MnO2 + O2
V. KHÔNG KHÍ - SỰ CHÁY
1. Không khí
Không khí là một hỗn hợp khí trong đó oxi chiếm khoảng 1/5 thể tích. Cự thể oxi chiếm 21% thể tích, 78% nitơ, 1% là các khí khác
2. Sự cháy và sự oxi hóa chậm
- Sự cháy là sự oxi hóa có tỏa nhiệt và phát sáng
- Sự oxi hóa chậm là sự oxi hóa có tỏa nhiệt nhưng không phát sáng
- Trong điều kiện nhất định, sựu oxi hóa chậm có thể chuyển thành sự cháy
CHƯƠNG 5: HIDRO - NƯỚC
I. Tính chất - Ứng dụng của Hiđro
1. Tính chất vật lý
Là chất khí không màu, không mùi, không vị, nhẹ nhất trong các khí, tan rất ít trong nước
2. Tính chất hóa học
a. Tác dụng với oxi
2H2 + O2 2H2O
Hỗn hợp sẽ gây nổ nếu trộng hidrơ và oxi theo tỉ lệ thể tích 2:1
b. Tác dụng với đồng oxit CuO
Bột CuO màu đen chuyển thành lớp kim loại đồng màu đỏ gạch và có những giọt nước tạo thành trên thành cốc
H2 + CuO Cu +H2O
II. Điều chế khí Hiđro - Phản ứng thế
1. Điều chế hidro
a. Trong phòng thí nghiệm
Cho kim loại (Al, Fe,….) tác dụng với dung dịch axit (HCl, H2SO4)
VD: Fe + 2HCl → FeCl2 + H2
b. Trong công nghiệp
Hidro được điều chế bằng cách điện phân nước hoặc dùng than khử oxi của H2O
PT: 2H2O 2H2 + O2
2. Phản ứng thế
Phản ứng thế là phản ứng hóa học của đơn chất và hợp chất trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất
VD: Fe + 2HCl → FeCl2 + H2
III. Nước
1. Tính chất vật lý
Là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị. sôi ở 100°C (p = 760 mmHg), hóa rắn ở 0°C.
Có thể hòa tan được nhiều chất rắn (muối ăn, đường,…), chất lỏng (cồn, axit), chất khí (HCl,…)
2. Tính chất hóa học
Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
PTHH: K + H2O → KOH + H2
Tác dụng với mốt số oxit bazo như CaO, K2O,… tạo ra bazơ tương ứng Ca(OH)2, KOH,…
Dung dịch bazơ làm quỳ tím chuyển xanh
VD: K2O + H2O → 2KOH
Dung dịch axit làm quỳ tím chuyển đỏ
VD: SO3 + H2O → H2SO4
IV. Axit - Bazơ - Muối
1. Axit
a. Khái niệm
Phân tử axit gồm có một hay nhiều nguyên tử hihdro liên kết với gốc axit, các nguyên tử hidro này có thể thay thế bằng các nguyên tử kim loại
b. CTHH: gồm một hay nhiều nguyên tử H và gốc axit
c. Phân loại: 2 loại
- Axit không có oxi: HCl, H2S,…
- Axit có oxi: H2SO4, H2CO3,…
d. Tên gọi
- Axit không có oxi
Tên axit = axit + tên phi kim + hidric
VD: HCl: axit clohidric. Gốc axit tương ứng là clorua
- Axit có oxi
+ Axit có nhiều oxi:
Tên axit = axit + tên phi kim + ic
VD: H2SO4 : axit sunfuric. Gốc axit: sunfat
+ Axit có ít oxi:
Tên axit = axit + tên phi kim + ơ
VD: H2SO3 : axit sunfuro. Gốc axit sunfit
2. Bazơ
a. Khai niệm:
Phân tử bazơ gồm có môt nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH).
b. CTHH: M(OH)n, n: số hóa trị của kim loại
c. Tên gọi:
Tên bazơ = tên kim loại ( kèm hóa trị nếu có nhiều hóa trị) + hiđroxit
VD: Fe(OH)2: sắt (II) hidroxit
d. Phân loại
Bazơ tan trong nước gọi là kiềm. VD: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Bazơ không tan trong nước. VD: Cu(OH)2, Fe(OH)2, Fe(OH)3,…
3. Muối
a. Khái niệm
Phân tử muối có một hay nhiều nguyên tử kim loại liên kết với môht hay nhiều gốc axit
b. CTHH: gồm 2 phần: kim loại và gốc axit
VD: Na2SO4, CaCO3,…
c. Tên gọi
Tên muối = tên kim loại (kèm hóa trị nếu có nhiều hóa trị) + tên gốc axit
VD: Na2SO4 : natri sunfat
d. Phân loại
- Muối trung hòa: là muối mà trong gốc axit không có nguyên tử hiđro có thể thay thế bằng các nguyên tử kim loại
VD: Na2SO4, CaCO3,…
- Muối axit: là muối trong đó gốc axit còn nguyên tử hiđro H chưa được thay thế bằng nguyên tử kim loại. Hóa trị của gốc axit bằng số nguyên tử hidro đã được thay thế bằng các nguyên tử kim loại.
VD: NaHSO4, NaHS, NaHSO3,…
Đề thi Giữa học kì 2 Hoá học lớp 8 Trắc nghiệm + Tự luận năm 2023
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 Trắc nghiệm + Tự luận năm 2023 có đáp án đề số 1
I. TRẮC NGHIỆM (3 điểm): Hãy chọn đáp án đúng trong mỗi câu sau:
Câu 1. Trong phòng thí nghiệm, oxi được điều chế từ 2 chất nào sau đây?
A. CuO; Fe3O4
B. KMnO4; KClO3
C. Không khí; H2O
D. KMnO4; MnO2
Câu 2. Trong các phản ứng hóa học sau, phản ứng nào là phản ứng hóa hợp:
A. S + O2 SO2
B. CaCO3 CaO + CO2
C. CH4 + 2O2 CO2 + 2H2O
D. 2H2O 2H2 + O2
Câu 3. Trong các phản ứng sau, phản ứng nào xảy ra sự oxi hóa
A. CaO + H2O → Ca(OH)2
B. S + O2 SO2
C. K2O + H2O → 2KOH
D. CaCO3 CaO + CO2
Câu 4. Người ta thu khí oxi bằng cách đẩy không khí dựa vào tính chất nào sau đây của oxi:
A. Khí O2 nhẹ hơn khôngkhí
C. Khí O2 là khí không mùi.
B. Khí O2 dễ hoà tan trong nước.
D. Khí O2 nặng hơn không khí
Câu 5. Hiện tượng nào sau đây là sự oxi hóa chậm:
A. Đốt cồn trong không khí.
B. Sắt để lâu trong không khí bị gỉ.
C. Nước bốc hơi.
D. Đốt cháy lưu huỳnh trong khôngkhí.
Câu 6. Phản ứng nào dưới đây là phản ứng phân hủy
A. CuO + H2 Cu + H2O
B. CO2 + Ca(OH)2 CaCO3 + H2O
C. CaO + H2O Ca(OH)2
D. Ca(HCO3)2 CaCO3 + CO2 + H2O
II. TỰ LUẬN(7 điểm)
Câu 1: Cho các chất sau: SO2, Fe2O3, Al2O3, P2O5. Đọc tên và hãy cho biết những chất nào là oxit bazơ, là oxit axit?
Câu 2: Hoàn thành phản ứng sau:
a) S + O2
b) Fe + O2
c) P + O2
d) CH4 + O2
Câu 3: Đốt cháy hoàn toàn 16,8 gam Sắt (Fe) trong không khí
a) Tính khối lượng sản phẩm thu được?
b) Tính thể tích khí oxi, và thể tích không.khí cần dùng ở đktc? (biết rằng oxi chiếm 20% thể tích không khí)
c) Tính khối lượng KMnO4 cần dùng để điều chế đủ oxi cho phản ứng trên? Biết rằng lượng oxi thu được hao hụt 20%
Cho biết: Fe = 56, O = 16, K = 39, Mn = 55
ĐÁP ÁN ĐỀ SỐ 1
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
B |
A |
B |
D |
B |
D |
Câu 1: Đáp án B
Trong phòng thí nghiệm, khí oxi đươc điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao như KMnO4 và KClO3
Câu 2: Đáp án A
- Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ 2 hay nhiều chất ban đầu. => Phản ứng A
Câu 3: Đáp án B
Sự tác dụng của oxi với 1 chất là sự oxi hóa
Câu 4: Đáp án D
Thu khí oxi bằng hai cách: đẩy không khí hoặc đẩy nước
Oxi đẩy không khí ra khỏi lọ vì oxi nặng hơn không khí.
Câu 5: Đáp án B
Sự oxi hóa chậm là sự oxi hóa có tỏa nhiệt nhưng không phát sáng, thường xảy ra trong tự nhiên : các đồ vật bằng gang, thép trong tự nhiên dần biến thành oxit, sự oxi hóa chậm các chất hữu cơ trong cơ thể diễn ra liên tục,…
Câu 6: Đáp án D
Phản ứng phân hủy là phản ứng hoá học trong đó 1 chất sinh ra hai hay nhiều chất mới
II. TỰ LUẬN (7 điểm)
Câu 1:
Oxit axit: SO2, P2O5
SO2: Lưu huỳnh đioxit
P2O5: điphotpho pentaoxit
Oxit bazơ: Fe2O3, Al2O3
Fe2O3: Sắt (III) oxit
Al2O3: Nhôm oxit
Câu 2:
a) S + O2 SO2
b) 3Fe + 2O2 Fe3O4
c) 4P + 5O2 2P2O5
d) CH4 + 2O2 CO2 + 2H2O
Câu 3:
a/ Số mol Fe là : nFe = 16,8: 56 = 0,3 mol
PTPƯ:
3Fe + 2O2 Fe3O4 (1)
0,3 mol → 0,2mol → 0,1 mol
Từ (1) ta có số mol Fe3O4 = 0,1mol
→ m Fe3O4 = n.M = 0,1.232 = 23,2gam
b/ Từ (1) ta có số mol O2 đã dùng nO2 = 0,2 mol
Thể tích khí oxi đã dùng ở đktc: VO2 = n.22,4 = 0,2.22,4 = 4,48 lít
Thể tích không khí đã dùng: Vkk = 5. VO2= 5.4,48 = 22,4 lít.
c/ PTPƯ
2 KMnO4 K2MnO4 + MnO2 + O2 (2)
0,4444mol ← 0,222mol
Vì lượng Oxi thu được hao hụt 10% nên số mol O2 cần có là:
nO2 = 0,2mol.100/90 = 0.222 mol
Từ (2) ta có số mol KMnO4 = 0,444mol
Khối lượng KMnO4 bị nhiệt phân
mKMnO4 = n.M = 0,444.158 = 70.152 gam
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 Trắc nghiệm + Tự luận năm 2023 có đáp án đề số 2
I. TRẮC NGHIỆM (3 điểm): Hãy chọn đáp án đúng trong mỗi câu sau:
Câu 1: Chất có công thức hóa học nào sau đây là oxit?
A. ZnO
B. Zn(OH)2
C. ZnCO3
D. ZnSO4
Câu 2: Đốt cháy hoàn toàn khí metan (CH4) trong khí oxi (vừa đủ). Sản phẩm của phản ứng là:
A. CO2.
B. H2O.
C. CO2 và H2O.
D. CO2, H2O và O2.
Câu 3: Cho các phương trình hóa học của các phản ứng sau:
1) CaCO3 CaO + CO2
2) Fe + S FeS
3) Zn + 2HCl ZnCl2 + H2
4) 2Fe + 3Cl2 2FeCl3
Trong các phản ứng trên: số phản ứng hóa hợp, phản ứng phân hủy lần lượt là:
A. 3; 1.
B. 2; 1.
C. 1; 3.
D. 1; 2.
Câu 4: Thành phần thể tích của không khí gồm:
A. 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
B. 21% khí nitơ, 78% khí oxi, 1% các khí khác (CO2, hơi nước, khí hiếm,...).
C. 21% các khí khác, 78% khí nitơ, 1% khí oxi.
D. 21% khí oxi, 78% các khí khác, 1% khí nitơ.
Câu 5: Đốt cháy hoàn toàn 2,24 lít khí CH4 trong bình chứa khí oxi. Thể tích khí oxi (đo ở đktc) cần dùng là:
A. 2,24 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 6,72 lít.
Câu 6: Dãy chất nào sau đây gồm toàn oxit bazơ?
A. SO3; P2O5.
B. Na2O; SO3.
C. SO2; CaO.
D. Na2O; CaO.
II. TỰ LUẬN (7 điểm)
Câu 1 (1 điểm):
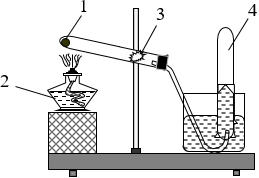
Cho hình vẽ mô tả thí nghiệm điều chế khí oxi trong phòng thí nghiệm. Hãy xác định 1, 2, 3, 4?
Câu 2 (1 điểm): Giải thích tại sao: Khi nhốt một con dế mèn vào một lọ nhỏ rồi đậy nút kín, sau một thời gian con vật sẽ chết dù có đủ thức ăn?
Câu 3 (1 điểm): Cho các oxit có công thức hóa học sau: SO2; Fe2O3, CO2, CaO. Chất nào thuộc loại oxit bazơ, chất nào thuộc loại oxit axit. Gọi tên các oxit đó?
Câu 4 (2 điểm): Hoàn thành các phương trình hoá học của các phản ứng sau (ghi rõ điều kiện phản ứng nếu có):
a) S + O2 ………
b) Fe + O2 ……..
c) KMnO4 K2MnO4 + MnO2 + …..
d) ……. KCl + O2.
Câu 5 (2 điểm): Đốt cháy hoàn toàn 2,48 gam photpho trong bình chứa khí oxi, tạo thành điphotpho pentaoxit.
a) Tính khối lượng hợp chất tạo thành?
b) Nếu trong bình chứa 4 gam khí oxi. Hỏi sau khi phản ứng kết thúc chất nào còn dư và dư bao nhiêu gam?
(Cho nguyên tử khối của các nguyên tố: P = 31; O = 16; C =12; H = 1)
ĐÁP ÁN ĐỀ SỐ 2
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
|
Đáp án |
A |
C |
B |
A |
C |
D |
Câu 1:Đáp án A
Oxit là hợp chất của 2 nguyên tố, trong đó có 1 nguyên tố là oxi => ZnO
Câu 2: Đáp án C
CH4 + 2O2 CO2 + 2H2O
Do oxi là vừa đủ nên sản phẩm chỉ là CO2, H2O (không còn oxi dư)
Câu 3: Đáp án B
- Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ 2 hay nhiều chất ban đầu. => Phản ứng 2 và 4
- Phản ứng phân hủy là phản ứng hoá học trong đó 1 chất sinh ra hai hay nhiều chất mới
=> phản ứng 1
Câu 4: Đáp án A
Câu 5: Đáp án C
CH4 + 2O2 CO2 + 2H2O
nCH4 = 2,24 : 22,4 = 0,1 mol
nO2 = 0,1.2 = 0,2 mol
VO2 = 0,2. 22,4 = 4,48 lít
Câu 6:Đáp án D
Oxit bazơ là oxit của kim loại và tương ứng với 1 bazơ.
II. TỰ LUẬN (7 điểm)
Câu 1: (1): KMnO4 hoặc KClO3; (2): đèn cồn; (3): bông; (4): Khí oxi
Câu 2: Vì trong quá trình hô hấp của chúng cần oxi cho quá trình trao đổi chất (quá trình này góp phần vào sự sinh tồn của người và động vật), khi ta đậy nút kín có nghĩa là sau một thời gian trong lọ sẽ hết khí oxi để duy trì sự sống. Do đó con vật sẽ chết.
Câu 3: Oxit bazơ là: Fe2O3 (Sắt (III) oxit), CaO (canxi oxit)
Oxit axit là: SO2 (Lưu huỳnh đioxit), CO2 (cacbon đioxit/ khí cacbonic)
Câu 4:
a) S + O2 SO2
b) 3Fe + 2O2 Fe3O4
c) 2KMnO4 K2MnO4 + MnO2 + O2
d) 2KClO3 2KCl + 3O2
Câu 5:
a) Số mol của P là:
4P + 5O2 2P2O5 (1)
Theo PTHH: 4 -------> 2 (mol)
Theo bài ra: 0,08 -------> 0,04 (mol)
Khối lượng P2O5 tạo thành là:
b) Số mol của oxi là:
Xét tỉ lệ: O2 dư, P phản ứng hết.
4P + 5O2 2P2O5
Theo PTHH: 4 5 (mol)
Theo bài ra: 0,08
Số mol oxi tham gia phản ứng là:
Số mol oxi còn dư sau phản ứng:
(dư) = 0,125 – 0,1 = 0,025 (mol)
Khối lượng oxi còn dư là: m = 0,025 . 32 = 0,8 (g)
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 Trắc nghiệm + Tự luận năm 2023 có đáp án đề số 3
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
Câu 1: Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành đỏ?
A. H3PO4, HNO3, HCl, NaCl, H2SO4
B. H3PO4, HNO3, KCl, NaOH, H2SO4
C. H3PO4, HNO3, HCl, H3PO3, H2SO4
D. H3PO4, KNO3, HCl, NaCl, H2SO4
Câu 2: Cho các phản ứng sau
1) Cu + 2AgNO3 Cu(NO3)2 + 2Ag
2) Na2O + H2O 2NaOH
3) Fe + 2HCl FeCl2 + H2
4) CuO+ 2HCl CuCl2 + H2O
5) 2Al + 3H2SO4 Al2(SO4)3 + 3H2
6) Mg +CuCl2 MgCl2 + Cu
7) CaO + CO2 CaCO3
8) HCl+ NaOH NaCl+ H2O
Số phản ứng thuộc loại phản ứng thế là:
A. 3
B. 4
C. 5
D. 6
Câu 3: Dãy các chất gồm toàn oxit axit là:
A. MgO, SO2
B. CaO, SiO2
C. P2O5, CO2
D. FeO, ZnO
Câu 4: Phương pháp điều chế khí oxi trong phòng thí nghiệm là:
A. Đun nóng KMnO4 hoặc KClO3 ở nhiệt độ cao
B. Đi từ không khí
C. Điện phân nước
D. Nhiệt phân CaCO3
Câu 5: Cho các oxit: CaO; Al2O3; N2O5; CuO; Na2O; BaO; MgO; P2O5; Fe3O4; K2O. Số oxit tác dụng với nước tạo bazơ tương ứng là:
A. 3
B. 4
C. 5
D. 2
Câu 6: Cho 11,2 gam Fe vào dung dịch chứa 0,25 mol H2SO4. Thể tích khí thu được ở đktc là:
A. 4,48 lít
B. 5,6 lít
C. 8,96 lít
D. 11,2 lít
II. TỰ LUẬN (7 điểm)
Câu 1: Hoàn thành các phương trình hóa học sau:
a) CH4 + O2
b) P + O2
c) CaCO3
d) H2 + CuO
Câu 2: Cho các oxit có công thức: Fe2O3, MgO, CO2, SO3, P2O3, K2O, NO2
Cho biết đâu là oxit bazơ, đâu là oxit axit và gọi tên các oxit trên.
Câu 3: Dùng khí hidro để khử hết 50g hỗn hợp A gồm đồng(II) oxit và sắt(III) oxit. Biết trong hỗn hợp sắt(III) oxit chiếm 80% khối lượng.
a) Viết các phương trình hóa học
b) Tính thể tích khí H2 cần dùng ở đktc.
ĐÁP ÁN ĐỀ SỐ 3
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
Câu 1: Đáp án C
Dãy các dung dịch axit làm quì chuyển thành đỏ
Câu 2 : Đáp án B
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.Nên các phản ứng thế là: 1,3,5,6
Câu 3: Đáp án C
Câu 4: Đáp án A
Trong phòng thí nghiệm, khí oxi đươc điều chế bằng cách đun nóng những hợp chất giàu oxi và dễ bị phân hủy ở nhiệt độ cao như KMnO4 và KClO3
Câu 5: Đáp án B
Oxit bazơ tác dụng với nước tạo bazơ tương ứng: CaO; Na2O; BaO; K2O
Câu 6: Đáp án A
Fe + H2SO4 FeSO4 + H2
nFe = 11,2 : 56 = 0,2 mol
= 0,25 mol
Vì 0,2 :1 < 0,25 : 1 => Fe là chất hết, H2SO4 dư
Số mol H2 tính theo chất hết
= 0,2 mol
= 0,2.22,4 = 4,48 lít
II. TỰ LUẬN (7 điểm)
Câu 1:
a) CH4 + O2 CO2 + 2H2O
b) 4P + 5O2 2P2O5
c) CaCO3 CaO + CO2
d) H2 + CuO Cu + H2O
Câu 2:
Fe2O3 : sắt (III) oxit
MgO: magie oxit
K2O : kali oxit
- Oxit axit: CO2, SO3, P2O3, NO2
CO2: cacbon đioxit ( khí cacbonic)
SO3: lưu huỳnh trioxit
P2O3 : điphotpho trioxit
NO2 : nito đioxit
Câu 3:
a) Phương trình hóa học
H2 + CuO Cu + H2O
3H2 + Fe2O3 2Fe + 3H2O
b) mFe2O3 = 50.80% = 40 gam => nFe2O3 = 40:160 = 0,25 mol
mCuO = 50-40 =10 gam => nCuO= 0,125 mol
0,125 mol 0,125 mol
3H2 + Fe2O3 2Fe + 3H2O
0,75 mol 0,25 mol
nH2 = 0,125 + 0,75= 0,875 mol
VH2 =0,875. 22,4 = 19,6 lít
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hoá học 8
Thời gian làm bài: 45 phút
Đề thi Giữa học kì 2 Hoá học lớp 8 Trắc nghiệm + Tự luận năm 2023 có đáp án đề số 4
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
Câu 1. Để thu khí hiđro trong phòng thí nghiệm bằng cách đẩy nước người ta dựa vào tính chất nào của khí hiđro ?
A. Nhẹ hơn không khí.
C. Không tác dụng với không khí.
B. Không tác dụng với nước.
D. Nhẹ hơn không khí và ít tan trong nước.
Câu 2. Phản ứng thế là phản ứng giữa hợp chất với:
A. H2
B. O2
C. Cu
D. Đơn chất
Câu 3: Hỗn hợp của hiđro nổ mạnh nhất khi tỉ lệ H2: O2 là :
A. 1:1
B. 2:1
C. 3:1
D. 4:1
Câu 4: Cho 13g Zn vào dung dịch chứa 0,5 mol HCl. Thể tích khí H2(đktc) thu được là:
A. 1,12lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Câu 5: Dãy chất nào tác dụng với nước:
A. SO3, CaO, P2O5
B. Al2O3, SO3, CaO
C. Na2O, CuO, P2O5
D. CuO, Al2O3, Na2O
Câu 6: Khí X có tỷ khối với H2 là 8,5. X là khí nào cho dưới đây:
A. SO2
B. NH3
C. O2
D. Cl2
II. TỰ LUẬN (7 điểm)
Câu 1: Trong các oxit sau, oxit nào tác dụng với nước. Nếu có hãy viết phương trình phản ứng : K2O, Al2O3, P2O5, SO3, CaO
Câu 2: Hoàn thành các phương trình phản ứng sau:
a. ZnO +H2
b. KMnO4 K2MnO4 + MnO2 + …..
c. S + O2
d. Mg + O2
Câu 3: Cho 3,25 g Zn tác dụng với một lượng HCl vừa đủ. Dẫn toàn bộ lượng khí sinh ra cho đi qua 6g CuO đun nóng.
a) Viết phương trình hoá học xảy ra?
b) Tính khối lượng Cu thu được sau phản ứng và cho biết chất nào là chất khử? Chất oxi hoá?
c) Chất nào còn dư sau phản ứng hiđro khử CuO? Khối lượng dư là bao nhiêu?
ĐÁP ÁN ĐỀ 4
I. TRẮC NGHIỆM ( 3 điểm) (0,5 điểm/câu đúng)
Câu 1: Đáp án B
Câu 2: Đáp án D
Câu 3: Đáp án B
Hỗn hợp khí hi đro và oxi là hỗn hợp nổ, sẽ nổ mạnh nhất nếu trộn H2 và O2 theo tỉ lệ về thể tích đúng như hệ số các chất trong phương trình hóa học
2H2 + O2 2H2O
Câu 4: Đáp án D
nH2 = 13: 65 = 0,2 mol
Zn + 2HCl ZnCl2 + H2
0,2 0,5 0,2 (mol)
Vì 0,2:1 < 0,5 :2
Zn hết, HCl dư H2 tính theo Zn
= 0,2 mol = 0,2.22,4 = 4,48 lít
Câu 5: Đáp án A
SO3 + H2O H2SO4
CaO + H2O Ca(OH)2
P2O5 + 3H2O 2H3PO4
Câu 6: Đáp án B
MX = 8,5.2 =17 X là NH3
II. TỰ LUẬN (7 điểm)
Câu 1: Các oxit tác dụng với nước
K2O + H2O 2KOH
P2O5 + 3H2O 2H3PO4
SO3 + H2O H2SO4
CaO + H2O Ca(OH)2
Câu 2:
a. ZnO + H2 Zn + H2O
b. 2KMnO4 K2MnO4 + MnO2 + O2
c. S + O2 SO2
d. 2Mg + O2 2MgO
Câu 3:
a) Viết phương trình hóa học:
Zn + 2HCl ZnCl2 + H2
H2 + CuO Cu + H2O
b) nZn = 3,25 : 65 = 0,05 mol => nH2 = 0,05 mol
nCuO = 6 : 80 = 0,075 mol
Vì 0,05 : 1< 0,075 : 1
CuO dư, H2 hết nên tính số mol Cu theo H2
H2 + CuO Cu + H2O
0,05 mol 0,05 mol
nCu = 0,05 mol mCu = 0,05.64 = 3,2 gam
Trong phản ứng trên H2 chiếm O của CuO => H2 là chất khử
CuO nhường O cho H2 CuO là chất oxi hóa
c) Trong phản ứng H2 khử CuO, CuO dư
nCuO dư = 0,075 – 0,05 = 0,025 mol
mCuO dư = 0,025.80 = 2 gam
Xem thêm các bộ đề thi Hoá học lớp 8 chọn lọc, hay khác:
TOP 30 Đề thi Học kì 2 Hoá học lớp 8 năm 2023 có đáp án
Đề cương Học kì 2 Hoá học lớp 8 năm 2023 chi tiết nhất
Bài tập Hóa học lớp 8 Học kì 2 có đáp án
