Công thức Lewis của CCl4 theo chương trình mới
Vietjack.me giới thiệu đến bạn Công thức Lewis của CCl4 theo chương trình mới giúp bạn nắm vững kiến thức và học tốt môn Hóa hơn.
Công thức Lewis của CCl4 theo chương trình mới
1. Công thức Lewis của CCl4
a) Cách 1: Viết công thức Lewis dựa vào công thức electron
Từ công thức electron, thay 1 cặp electron dùng chung bằng 1 gạch nối giữa hai nguyên tử ta được công thức Lewis
Từ công thức electron của CCl4 ta thấy mỗi nguyên tử Cl liên kết với nguyên tử C bằng 1 cặp electron, ta thay mỗi cặp electron này bằng một gạch nối “–”. Ta được công thức Lewis của CCl4 là:
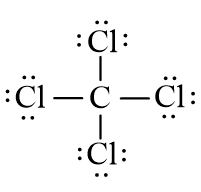
b) Cách 2: Thực hiện lần lượt theo các bước sau
Bước 1: Tính tổng số electron hóa trị trong phân tử
C có 4 electron hóa trị, Cl có 7 electron hóa trị. Trong phân tử CCl4 có 1 nguyên tử C và 4 nguyên tử Cl.
Vậy tổng số electron hóa trị = 4.1 + 7.4 = 32 electron.
Bước 2: Xác định nguyên tử trung tâm và vẽ sơ đồ khung biểu diễn liên kết giữa nguyên tử trung tâm với các nguyên tử xung quanh qua các liên kết đơn. Nguyên tử trung tâm thường là nguyên tử cần nhiều electron nhất để đạt octet.
Vẽ một gạch (một liên kết) từ nguyên tử trung tâm tới mỗi nguyên tử xung quanh.
Trong phân tử CCl4, C cần nhiều electron hơn để đạt octet. Vì vậy C là nguyên tử trung tâm, còn các nguyên tử Cl được xếp xung quanh:
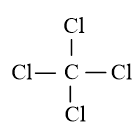 (1)
(1)
Bước 3: Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
32 – 2.4 = 24 electron.
Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn trong sơ đồ.
Trong công thức (1), xung quanh mỗi nguyên tử Cl mới có 2 electron nên cần phải bổ sung 6 electron vào mỗi nguyên tử này. Ta được công thức (2)
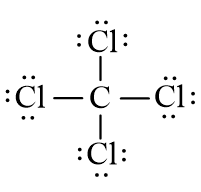 (2)
(2)
Số electron hóa trị còn lại = 24 – 6.4 = 0
Nguyên tử trung tâm C đã đạt octet.
Vậy công thức (2) chính là công thức Lewis của CCl4.
- Nhận xét:
+ 1,7 > ∆χ(C – Cl) = |2,55 – 3,16| = 0,61 > 0,4 ⇒ Liên kết C – Cl trong phân tử CCl4 thuộc loại liên kết cộng hóa trị phân cực. Liên kết C – Cl phân cực về phía nguyên tử Cl.
2. Công thức electron của CCl4
- Sự hình thành phân tử CCl4:
Nguyên tử C có cấu hình electron là: 1s22s22p3 ⇒ có 4 electron hóa trị, cần thêm 4 electron để đạt octet.
Nguyên tử Cl có cấu hình electron là: 1s22s22p63s23p5 ⇒ có 7 electron hóa trị, cần thêm 1 electron để đạt octet.
Khi hình thành phân tử CCl4, nguyên tử C góp chung với mỗi nguyên tử Cl một electron để tạo thành 1 cặp electron dùng chung, vì có 4 nguyên tử Cl nên có tất cả 4 cặp electron dùng chung của C và các nguyên tử Cl.
- Công thức electron của CCl4 là:
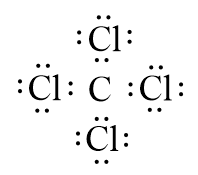
- Nhận xét:
+ Phân tử CCl4 có 4 cặp electron dùng chung giữa nguyên tử C và các nguyên tử Cl. Cặp electron chung lệch về phía nguyên tử Cl.
+ Trong phân tử CCl4, mỗi nguyên tử Cl còn 3 cặp electron tự do.
3. Cách viết công thức cấu tạo
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
- Công thức cấu tạo của CCl4 là:
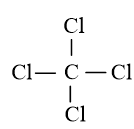
- Nhận xét:
+ Trong phân tử CCl4 có 4 liên kết đơn C – Cl.
+ Phân tử CCl4 có cấu trúc tứ diện.
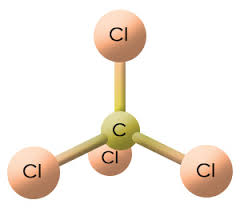
4. Bài tập mở rộng về CCl4
Câu 1. Số liên kết đơn trong phân tử CCl4 là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án đúng là: D
Công thức cấu tạo của CCl4 là:
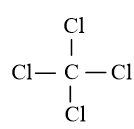
Trong phân tử CCl4 có 4 liên kết đơn C – Cl.
Câu 2. Liên kết trong phân tử CCl4 thuộc loại liên kết
A. cộng hóa trị phân cực
B. cộng hóa trị không phân cực.
C. cho – nhận.
D. ion
Hướng dẫn giải
Đáp án đúng là: A
1,7 > ∆χ(C – Cl) = |2,55 – 3,16| = 0,61 > 0,4 ⇒ Liên kết C – Cl trong phân tử CCl4 thuộc loại liên kết cộng hóa trị phân cực. Liên kết C – Cl phân cực về phía nguyên tử Cl.
Tham khảo các loạt bài Hóa học khác:
Công thức Lewis của PCl3 theo chương trình mới
Công thức Lewis của NCl3 theo chương trình mới
Công thức Lewis của CCl4 theo chương trình mới
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
