Công thức Lewis của SO2 theo chương trình mới
Vietjack.me giới thiệu đến bạn Công thức Lewis của SO2 theo chương trình mới giúp bạn nắm vững kiến thức và học tốt môn Hóa hơn.
Công thức Lewis của SO2 theo chương trình mới
1. Công thức Lewis của SO2
a) Cách 1: Viết công thức Lewis dựa vào công thức electron
- Từ công thức electron của SO2 ta thấy nguyên tử S liên kết với hai nguyên tử O bằng 3 cặp electron, thay mỗi cặp electron này bằng một gạch nối. Ta được công thức Lewis của SO2 là:
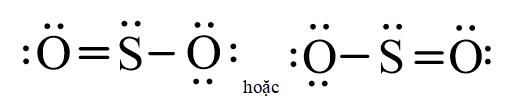
- Trong liên kết giữa S và một nguyên tử O, nguyên tử S đóng góp một cặp electron nên S là nguyên tử cho, còn nguyên tử O không đóng góp electron nên đóng vai trò nhận. Để biểu diễn liên kết cho – nhận người ta dùng một mũi tên được hướng từ nguyên tử cho sang nguyên tử nhận để phân biệt với các liên kết còn lại.
Công thức Lewis của SO2 có thể được biểu diễn như sau:
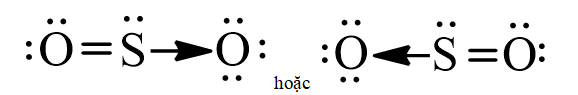
b) Cách 2: Viết công thức Lewis dựa vào quy tắc
Bước 1: Tính tổng số electron hóa trị trong phân tử
S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO2 có 1 nguyên tử S và 2 nguyên tử O.
Vậy tổng số electron hóa trị = 6 + 6.2 = 18 electron.
Bước 2. Vẽ khung phân tử tạo bởi liên kết đơn giữa các nguyên tử
Trong phân tử SO2, S có độ âm điện nhỏ hơn, vì vậy S là nguyên tử trung tâm, còn các nguyên tử O được xếp xung quanh:
O – S – O (1)
Bước 3. Tính số electron hóa trị chưa tham gia liên kết bằng cách lấy tổng số electron trừ số electron tham gia tạo liên kết.
Số electron hóa trị chưa tham gia liên kết trong sơ đồ là:
18 – 2.2 = 14 electron.
Hoàn thiện octet cho các nguyên tử có độ âm điện lớn hơn trong sơ đồ.
Trong công thức (1), xung quanh mỗi nguyên tử O mới có 2 electron nên cần phải bổ sung 6 electron vào mỗi nguyên tử này. Ta được công thức (2)
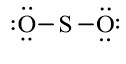 (2)
(2)
Số electron hóa trị còn lại: 14 – 6.2 = 2 electron.
Ta đặt electron này vào nguyên tử trung tâm S.
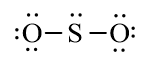
Nguyên tử S có 6 electron hóa trị, chưa đạt octet.
Bước 4. Chuyển cặp electron chưa liên kết trên nguyên tử xung quanh thành electron liên kết sao cho nguyên tử trung tâm thỏa mãn quy tắc octet.
Vì S chưa đạt octet, cần chuyển một cặp electron của một nguyên tử O thành cặp electron chung giữa S và O
Công thức Lewis của phân tử SO2 thu được là:
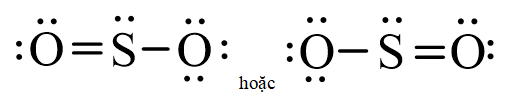
Nhận xét:
+ ∆χ(S = O) = |2,58 – 3,44| = 0,86 > 0,4 ⇒ liên kết S = O trong phân tử SO2 thuộc loại liên kết cộng hóa trị phân cực. Liên kết phân cực về phía nguyên tử O.
+ Phân tử SO2 có cấu tạo góc
2. Công thức electron của SO2
- Sự tạo thành phân tử SO2:
+ Nguyên tử sulfur (S) có cấu hình electron là 1s22s22p63s23p4 ⇒ S có 6 electron ở lớp ngoài cùng ⇒ Cần nhận thêm 2 electron để đạt được cấu hình electron bền vững giống khí hiếm.
+ Cấu hình electron của O là: 1s22s22p4 ⇒ O có 6 electron ở lớp ngoài cùng ⇒ Cần nhận thêm 2 electron để đạt được cấu hình electron bền vững của khí hiếm.
+ Nguyên tử S và một nguyên tử O sẽ góp chung 2 electron để tạo thành 2 cặp electron dùng chung. Khi đó nguyên tử S và một nguyên tử O đó đã đạt octet.
+ Còn một nguyên tử O chưa đạt octet, S sẽ sử dụng một cặp electron chưa liên kết làm cặp electron chung với nguyên tử O còn lại. Nguyên tử S đóng góp cặp electron nên S là nguyên tử cho, còn nguyên tử O không đóng góp electron nên đóng vai trò nhận.
Vậy công thức electron của SO2 là:
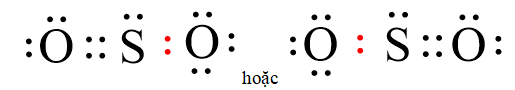
- Nhận xét: Từ công thức electron ta thấy:
+ Phân tử SO2 có ba cặp electron dùng chung. Trong đó có hai cặp electron do một nguyên tử O và nguyên tử S cùng đóng góp. Một cặp electron giữa nguyên tử S và nguyên tử O còn lại chỉ do nguyên tử S đóng góp.
+ Trong phân tử SO2 có một nguyên tử O còn 2 cặp electron riêng, một nguyên tử O còn 3 cặp electron riêng, nguyên tử S còn 1 cặp electron riêng.
3. Công thức cấu tạo của SO2
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
- Công thức cấu tạo của SO2 là:
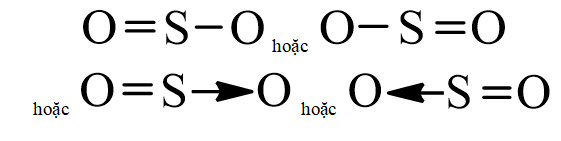
- Nhận xét: Trong phân tử SO2 có 1 liên kết đôi S = O và một liên kết đơn S – O.
4. Bài tập mở rộng về SO2
Câu 1. Số liên kết σ trong phân tử SO2 là
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải
Đáp án đúng là: B
Phân tử SO2 có một liên kết đơn (là liên kết σ) và một liên kết đôi (gồm một liên kết σ và một liên kết π). Như vậy phân tử SO2 gồm hai liên kết σ và một liên kết π.
Câu 2. Chất nào sau đây có liên kết cộng hóa trị phân cực
A. K2O
B. H2S
C. NaCl
D. SO2
Cho biết độ âm điện của các nguyên tử nguyên tố như sau:
|
Nguyên tử |
K |
O |
H |
S |
Na |
Cl |
|
Độ âm điện |
0,82 |
3,44 |
2,2 |
2,58 |
0,93 |
3,16 |
Hướng dẫn giải
Đáp án đúng là: D
K2O: ∆χ= |0,82 – 3,44| = 2,62 > 1,7 ⇒ Liên kết K – O trong phân tử K2O là liên kết ion.
H2S: ∆χ = |2,2 – 2,58| = 0,38 < 0,4 ⇒ Liên kết H – S trong phân tử H2S là liên kết cộng hóa trị không phân cực.
NaCl: ∆χ= |0,93 – 3,16| = 2,23 > 1,7 ⇒ Liên kết Na – Cl trong phân tử NaCl là liên kết ion.
SO2: 1,7 > ∆χ = |2,58 – 3,44| = 0,86 > 0,4 ⇒ liên kết S = O trong phân tử SO2 thuộc loại liên kết cộng hóa trị phân cực. Liên kết phân cực về phía nguyên tử O.
Tham khảo các loạt bài Hóa học khác:
Công thức Lewis của CO theo chương trình mới
Công thức Lewis của SO3 theo chương trình mới
Công thức Lewis của HNO3 (Nitric acid) theo chương trình mới
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
