Giải Hóa 10 Bài 7 (Kết nối tri thức): Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Với giải bài tập Hóa 10 Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 7.
Giải bài tập Hóa lớp 10 Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Video giải bài tập Hóa lớp 10 Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Lời giải:
Trong một chu kì: theo chiều tăng dần điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
I. Thành phần của các oxide và hydroxide
Lời giải:
Nguyên tố gallium thuộc nhóm IIIA ⇒ Có công thức oxide và hydroxide (ứng với hóa trị cao nhất) lần lượt là Ga2O3 và Ga(OH)3.
Nguyên tố selenium thuộc nhóm VIA ⇒ Có công thức oxide và hydroxide (ứng với hóa trị cao nhất) lần lượt là SeO3 và H2SeO4.
II. Tính chất của oxide và hydroxide
Hoạt động 1 trang 41 Hóa học 10: Phản ứng của oxide với nước
1. Viết phương trình hóa học của các phản ứng xảy ra trong các thí nghiệm trên.
2. So sánh tính acid – base của các oxide và hydroxide tương ứng.
Lời giải:
1. Các phản ứng hóa học:
Na2O + H2O ⟶ 2NaOH
MgO + H2O ⟶ Mg(OH)2
P2O5 + 3H2O ⟶ 2H3PO4
2. So sánh tính acid – base của các oxide và hydroxide tương ứng.
Na2O; MgO là basic oxide; P2O5 là acidic oxide.
NaOH là base mạnh, Mg(OH)2 là base yếu, H3PO4 là acid trung bình.
Chiều giảm dần tính base và tăng dần tính acid của các oxide và hydroxide tương ứng:
Oxide: Na2O; MgO; P2O5
Hydroxide: NaOH; Mg(OH)2; H3PO4.
Hoạt động 2 trang 41 Hóa học 10: Phản ứng của muối với dung dịch acid
Chuẩn bị: dung dịch Na2CO3; dung dịch HNO3 loãng; ống nghiệm.
Thêm từng giọt dung dịch Na2CO3 vào ống nghiệm chứa dung dịch HNO3.
Quan sát hiện tượng và thực hiện yêu cầu sau:
a) Viết phương trình hóa học của phản ứng.
b) Hãy so sánh độ mạnh, yếu giữa acid HNO3 và H2CO3.
Lời giải:
a) Phương trình hóa học của phản ứng:
Na2CO3 + 2HNO3 ⟶ 2NaNO3 + CO2↑ + H2O
b) Sau phản ứng H2CO3 sinh ra phân hủy ngay thành CO2 và H2O.
⇒ Acid HNO3 là acid mạnh và acid H2CO3 là acid yếu.
Câu hỏi 2 trang 42 Hóa học 10: Trong các chất dưới đây, chất nào có tính acid yếu nhất?
Lời giải:
Đáp án đúng là: D
Các nguyên tố Si (Z = 14), P (Z = 15), S (Z = 16), Cl (Z = 17) có điện tích tăng dần và cùng thuộc chu kì 3 nên tính acid của hydroxide ứng với hóa trị cao nhất tăng dần.
Sắp xếp tính acid: H2SiO3 < H3PO4 < H2SO4 < HClO4
⇒ Acid H2SiO3 có tính acid yếu nhất.
Câu hỏi 3 trang 42 Hóa học 10: Dãy gồm các chất có tính base tăng dần là
Lời giải:
Đáp án đúng là: A
Các nguyên tố Na (Z = 11), Mg (Z = 12), Al (Z = 13) thuộc cùng chu kỳ 3, được xếp lần lượt theo chiều tăng của điện tích hạt nhân.
Trong một chu kì theo chiều tăng của điện tích hạt nhân tính base của hydroxide tương ứng giảm dần.
⇒ Dãy gồm các chất có tính base tăng dần là Al(OH)3 < Mg(OH)2 < NaOH.
B. Tính acid – base của các hydroxide.
D. Cấu hình electron lớp ngoài cùng của nguyên tử.
Lời giải:
Đáp án đúng là: C
Khối lượng nguyên tử không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Lý thuyết Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
I. Thành phần của các oxide và hydroxide
Hóa trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen tăng từ I đến VII khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố fluorine ở chu kì 2), do đó thành phần của các oxide và hydroxide có sự lặp lại theo chu kì.
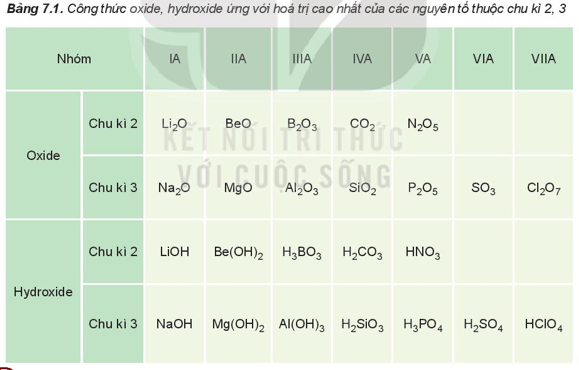
Ví dụ: Nguyên tố calcium thuộc nhóm IIA của bảng tuần hoàn. Viết công thức hóa học của oxide, hydroxide (ứng với hóa trị cao nhất) của nguyên tố trên.
Hướng dẫn giải:
Nguyên tố calcium (Ca) thuộc nhóm IIA.
→ Hóa trị cao nhất của Ca là II.
Công thức hóa học của oxide là CaO, của hydroxide là Ca(OH)2.
II. Tính chất của oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
Nhận xét:
Hydroxide của các nguyên tố nhóm IA thể hiện tính base mạnh, hydroxide ứng với hóa trị cao nhất của các nguyên tố nhóm VIIA (trừ fluorine) thể hiện tính acid mạnh.
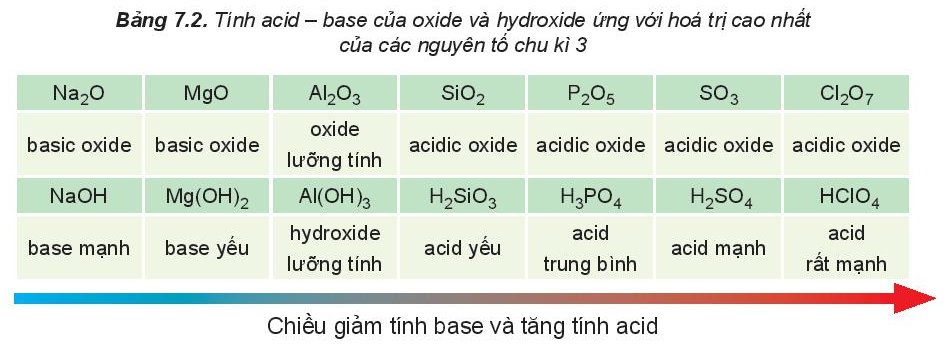
Ví dụ: Cho các nguyên tố P (Z = 15), S (Z = 16), Cl (Z = 17). So sánh tính acid của hydroxide (ứng với hóa trị cao nhất) của các nguyên tố trên.
Hướng dẫn giải:
P (Z = 15): [Ne]3s23p3 → P thuộc chu kì 3, nhóm VA.
Hóa trị cao nhất của P là V →Công thức hydroxide (ứng với hóa trị cao nhất) là H3PO4.
S (Z = 16): [Ne]3s23p4 →S thuộc chu kì 3, nhóm VIA.
Hóa trị cao nhất của S là VI → Công thức hydroxide (ứng với hóa trị cao nhất) là H2SO4.
Cl (Z = 17): [Ne]3s23p5 →Cl thuộc chu kì 3, nhóm VA.
Hóa trị cao nhất của Cl là VII → Công thức hydroxide (ứng với hóa trị cao nhất) là HClO4.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
→ So sánh tính acid: H3PO4 < H2SO4 < HClO4.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Lý thuyết Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Trắc nghiệm Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
