Giải Hóa 10 Bài 3 (Kết nối tri thức): Cấu trúc lớp vỏ electron nguyên tử
Với giải bài tập Hóa 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 3.
Giải bài tập Hóa lớp 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Video giải bài tập Hóa lớp 10 Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Lời giải:
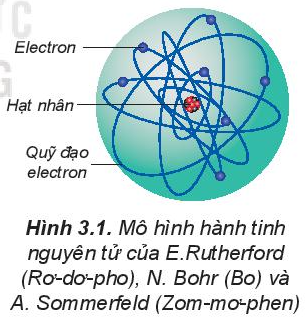
- Theo mô hình hành tinh nguyên tử: Các electron chuyển động xung quanh hạt nhân nguyên tử theo những quỹ đạo tròn hay bầu dục, giống như quỹ đạo của các hành tinh quay xung quanh Mặt Trời.
- Theo mô hình hiện đại: Trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Tuy nhiên, người ta có thể xác định được vùng không gian xung quanh hạt nhân mà ở đó xác suất có mặt (xác suất tìm thấy) electron là lớn nhất (khoảng 90%). Vùng không gian xung quanh hạt nhân tìm thấy electron có thể hình dung như một đám mây electron, được gọi là orbital nguyên tử (kí hiệu là AO).

- Cấu hình electron của nguyên tử và cách viết cấu hình electron của 20 nguyên tố đầu tiên trong bảng tuần hoàn tuần theo: nguyên tí vững bền, nguyên lí Pauli và quy tắc Hund.
+ Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s ...
+ Nguyên lí Pauli: Các phân lớp 1s, 2s, 2p, 3s đều chứa tối đa các electron nên trong mỗi AO có 2 electron (kí hiệu ↑, ↓) có chiều quay ngược nhau được viết là ↑↓.
+ Quy tắc Hund: Phân lớp 3p chỉ có 2 electron nên các electron phải phân bố sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (↑).
I. Chuyển động của electron trong nguyên tử
Lời giải:
Theo mô hình hiện đại: Trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Tuy nhiên, người ta có thể xác định được vùng không gian xung quanh hạt nhân mà ở đó xác suất có mặt (xác suất tìm thấy) electron là lớn nhất (khoảng 90%). Vùng không gian xung quanh hạt nhân tìm thấy electron có thể hình dung như một đám mây electron, được gọi là orbital nguyên tử (kí hiệu là AO).

Câu hỏi 2 trang 22 Hóa học 10: Orbital s có dạng
Lời giải:
Đáp án đúng là: C
Orbital s có dạng hình cầu.
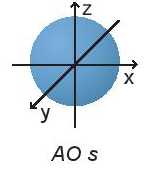
Câu hỏi 3 trang 22 Hóa học 10: Quan sát Hình 3.3 và nêu sự định hướng của các AO p trong không gian.
Lời giải:
Orbital p có dạng hình số 8 nổi và có 3 sự định hướng:
+ Orbital px định hướng theo trục x.
+ Orbital py định hướng theo trục y.
+ Orbital pz định hướng theo trục z.
II. Lớp và phân lớp electron
Câu hỏi 4 trang 23 Hóa học 10: Hãy cho biết tổng số electron tối đa chứa trong:
Lời giải:
a) Phân lớp p có 3 AO px, py, pz 
Mỗi AO chứa tối đa 2 electron
⇒ Tổng số electron tối đa chứa trong phân lớp p là 2.3 = 6 electron
b) Phân lớp d có 5 AO 
Mỗi AO chứa tối đa 2 electron
⇒ Tổng số electron tối đa chứa trong phân lớp d là 2.5 = 10 electron
Lời giải:
Đáp án đúng là: C
Em cần nhớ:
- Trong lớp electron thứ n có n2 AO (n ≤ 4)
- Mỗi AO chứa tối đa 2 electron
Lớp L (n = 2) có 22 = 4 AO ⇒ Tổng số electron tối đa bằng 4.2 = 8 electron
Lớp M (n = 3) có 32 = 9 AO ⇒ Tổng số electron tối đa bằng 9.2 = 18 electron.
III. Cấu hình electron của nguyên tử
Câu hỏi 6 trang 24 Hóa học 10: Cấu hình electron của nguyên tử có Z = 16 là
Lời giải:
Đáp án đúng là: C
Nguyên tử có Z = 16 nên nguyên tử có 16 electron.
⇒ Cấu hình electron là 1s22s22p63s23p4.
Lời giải:
- Cấu hình electron của nguyên tử có Z = 8 là 1s22s22p4, được biểu diễn theo ô orbital là:
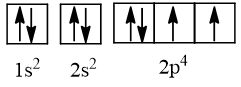
- Cấu hình electron của nguyên tử có Z = 11 là 1s22s22p63s1, được biểu diễn theo ô orbital là:
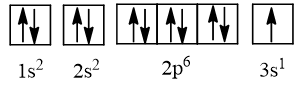
Lời giải:
Ta có: Z = 14 ⇒ Nguyên tử silicon có 14 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền cho đến electron cuối cùng
1s22s22p63s23p2.
⇒ Cấu hình electron của nguyên tử silicon có Z = 14: 1s22s22p63s23p2, được biểu diễn theo ô orbital là:
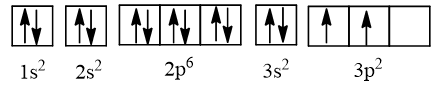
Lưu ý:
- Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s ...
- Nguyên lí Pauli: Các phân lớp 1s, 2s, 2p, 3s đều chứa tối đa các electron nên trong mỗi AO có 2 electron (kí hiệu ↑, ↓) có chiều quay ngược nhau được viết là ↑↓.
- Quy tắc Hund: Phân lớp 3p chỉ có 2 electron nên các electron phải phân bố sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (↑).
Lời giải:
Chlorine có Z = 17 nên nguyên tử chlorine có 17 electron.
- Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng:
1s 2s 2p 3s 3p 4s …
- Điền các electron vào các phân lớp electron theo nguyên lí vững bền:
1s22s22p63s23p5.
⇒ Cấu hình electron của nguyên tử chlorine là: 1s22s22p63s23p5.
⇒ Lớp ngoài cùng có 7 electron.
⇒ Chlorine là phi kim.
Lời giải:
- Cấu hình electron nguyên tử của nitrogen (Z = 7) là 1s22s22p3.
⇒ Lớp ngoài cùng có 5 electron.
⇒ Nitrogen là phi kim.
- Cấu hình electron nguyên tử của oxygen (Z = 8) là 1s22s22p4.
⇒ Lớp ngoài cùng có 6 electron.
⇒ Oxygen là phi kim.
- Cấu hình electron nguyên tử của aluminium (Z = 13) là 1s22s22p63s23p1.
⇒ Lớp ngoài cùng có 3 electron.
⇒ Aluminium là kim loại.
Lý thuyết Cấu trúc lớp vỏ electron nguyên tử
I. Chuyển động của electron trong nguyên tử
Đầu thế kỉ XX, người ta vẫn cho rằng các electron chuyển động xung quanh hạt nhân nguyên tử theo những quỹ đạo tròn hay bầu dục, giống như quỹ đạo của các hành tinh quay xung quanh Mặt Trời.
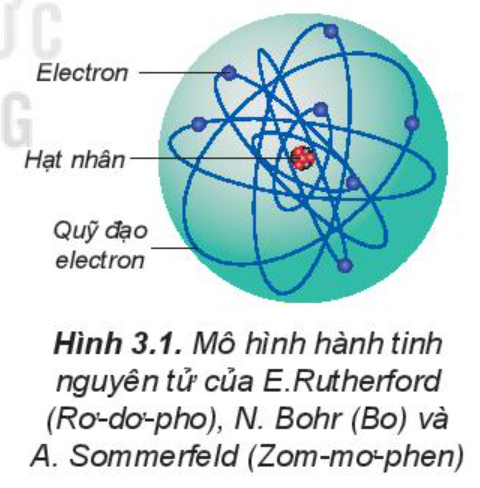
Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Vùng không gian xung quanh hạt nhân có xác suất tìm thấy electron là lớn nhất (khoảng 90%) và có thể hình dung vùng không gian đó như một đám mây electron, được gọi là orbital nguyên tử (kí hiệu là AO).

1. Hình dạng orbital nguyên tử
Dựa trên sự khác nhau về hình dạng, sự định hướng của orbital trong nguyên tử để phân loại orbital thành orbital s, orbital p, orbital d và orbital f. Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.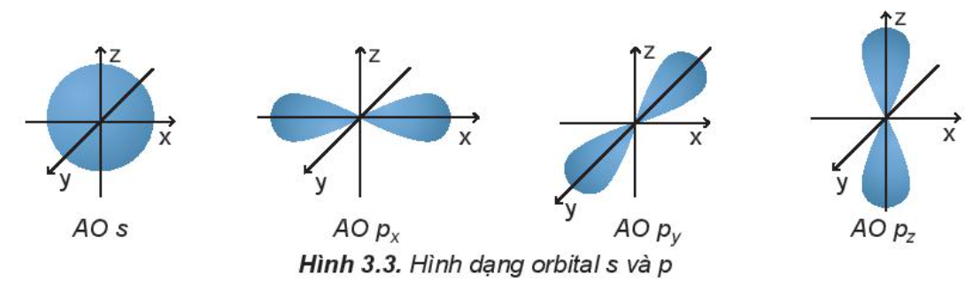
2. Ô orbital
Một AO được biểu diễn bằng một ô vuông, gọi là ô orbital .
Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau. Nếu orbital có 1 electron thì biểu diễn bằng một mũi tên đi lên (), nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước ().
II. Lớp và phân lớp electron
Trong nguyên tử, các electron sắp xếp thành từng lớp và phân lớp theo các mức năng lượng từ thấp đến cao.
1. Lớp electron
Những electron ở lớp gần hạt nhân bị hút mạnh hơn về phía hạt nhân, vì thế có năng lượng thấp hơn so với những electron ở lớp xa hạt nhân.
Các electron thuộc cùng một lớp có mức năng lượng gần bằng nhau.
Số thứ tự lớp từ trong ra ngoài và được biểu thị bằng các số nguyên n = 1, 2, 3, …, 7 với tên gọi là các chữ cái in hoa như sau:
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
O |
P |
Q |
2. Phân lớp electron
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái thường, theo thứ tự: s, p, d, f.
Các electron trên cùng một phân lớp có mức năng lượng bằng nhau.
Số phân lớp trong mỗi lớp bằng số thứ tự của lớp (n ≤ 4):
Lớp thứ nhất (lớp K, với n = 1) có một phân lớp, được kí hiệu là 1s.
Lớp thứ hai (lớp L, với n = 2) có hai phân lớp, được kí hiệu là 2s và 2p.
Lớp thứ ba (lớp M, với n = 3) có ba phân lớp, được kí hiệu là 3s, 3p và 3d.
Lớp thứ tư (lớp N, với n = 4) có bốn phân lớp, được kí hiệu là 4s, 4p, 4d và 4f.
Các electron ở phân lớp s gọi là electron s, các electron ở phân lớp p gọi là electron p, …
3. Số lượng orbital trong một phân lớp, trong một lớp
Trong một phân lớp, các orital có cùng mức năng lượng.
- Phân lớp s có 1 AO s:

- Phân lớp p có 3 AO px, py, pz:

- Phân lớp d có 5 AO:

- Phân lớp f có 7 AO:
|
|
|
|
|
|
|
|
Trong lớp electron thứ n có n2 AO (n ≤ 4).
Ví dụ 1: Lớp L (n = 2) có 2 phân lớp 2s và 2p.
Trong đó, phân lớp 2s có 1 AO, phân lớp 2p có 3 AO nên tổng số orbital trong lớp L là:
1 + 3 = 4 hay 22 AO.
Ví dụ 2: Cho biết tổng số electron tối đa trong các phân lớp s, p, d và f.
Hướng dẫn:
Trong 1 orbital chỉ chứa tối đa 2 electron.
Phân lớp s có 1 AO Số electron tối đa trong phân lớp s là: 1×2 = 2.
Phân lớp p có 3 AO Số electron tối đa trong phân lớp p là: 3×2 = 6.
Phân lớp d có 5 AO Số electron tối đa trong phân lớp d là: 5×2 = 10.
Phân lớp f có 7 AO Số electron tối đa trong phân lớp f là: 7×2 = 14.
Ví dụ 3: Lớp electron có số electron tối đa gọi là lớp electron bão hòa. Tính tổng số electron tối đa trong mỗi lớp L và M.
Hướng dẫn:
Lớp L (n = 2) có hai phân lớp 2s và 2p, có n2 = 22 = 4 AO.
Tổng số electron tối đa trong lớp L là: 4×2 = 8 (electron).
Lớp M (n = 3) có ba phân lớp 3s, 3p và 3d, có n2 = 32 = 9 AO.
Tổng số electron tối đa trong lớp M là: 9×2 = 18 (electron).
III. Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
Quy tắc Hund (Hun): Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
Cấu hình electron của nguyên tử cho biết số lớp electron, thứ tự phân lớp electron và số electron trong mỗi lớp và mỗi phân lớp.
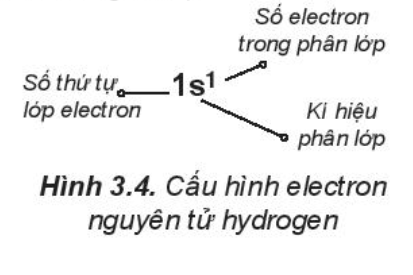
1. Viết cấu hình electron của nguyên tử
Bước 1: Xác định số electron trong nguyên tử.
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng: 1s 2s 2p 3s 3p 4s …
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng.
Ví dụ 1: Viết cấu hình electron của nguyên tử nitrogen (Z = 7).
- Tổng số electron của nguyên tử N là 7.
- Viết thứ tự các lớp và phân lớp electron: 1s22s22p3.
- Có thể thay 1s2 bằng kí hiệu [He]. Cấu hình electron của nguyên tử N là 1s22s22p3 hoặc [He]2s22p3 hoặc (2, 5).
Electron cuối cùng điền vào phân lớp p nên nitrogen là nguyên tố p.
Ví dụ 2: Viết cấu hình electron của nguyên tử potassium (Z = 19).
- Tổng số electron của nguyên tử K là 19.
- Viết thứ tự các lớp và phân lớp electron: 1s22s22p63s23p64s1.
- Có thể thay 1s22s22p63s23p6 bằng kí hiệu [Ar]. Cấu hình electron của nguyên tử K là 1s22s22p63s23p64s1 hoặc [Ar]4s1 hoặc (2, 8, 8, 1).
Electron cuối cùng điền vào phân lớp s nên potassium là nguyên tố s.
2. Biểu diễn cấu hình electron theo ô orbital
Ví dụ: Cấu hình electron của nguyên tử nitrogen có Z = 7: 1s22s22p5 có thể được biểu diễn theo ô orbital như sau:
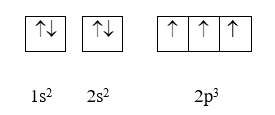
Hai ô orbital 1s và 2s có đủ 2 electron được biểu diễn bằng hai mũi tên ngược chiều nhau (nguyên lí Pauli). 3 electron còn lại được sắp xếp vào 3 orbital 2p bằng 3 mũi tên đi lên để số electron độc thân là tối đa (quy tắc Hund).
3. Đặc điểm của lớp electron ngoài cùng
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
- Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He).
- Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại.
- Các nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim.
- Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim.
Ví dụ: Nguyên tử nguyên tố X có Z = 17.
Cấu hình electron của nguyên tử X là: 1s22s22p63s23p5 hoặc [Ne]3s23p5.
Nguyên tử nguyên tố X có 7 electron lớp ngoài cùng X là nguyên tố phi kim.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
