Giải Hóa 10 Bài 18 (Kết nối tri thức): Ôn tập chương 5
Với giải bài tập Hóa 10 Bài 18: Ôn tập chương 5 sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 18.
Giải bài tập Hóa lớp 10 Bài 18: Ôn tập chương 5
I. Hệ thống hóa kiến thức
Hệ thống hóa kiến thức trang 89 Hóa học 10: Hoàn thành các nội dung còn thiếu sau đây:
Chất phản ứng ⟶ Sản phẩm, ΔrHo298 > 0 (phản ứng …?... nhiệt)
ΔrHo298< 0 (phản ứng …?... nhiệt)
Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành (ở điều kiện chuẩn):
ΔrHo298=................?.................
Tính biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí) theo năng lượng liên kết (ở điều kiện chuẩn):
ΔrHo298=....................?......................
Lời giải:
Chất phản ứng ⟶ Sản phẩm, ΔrHo298 > 0 (phản ứng thu nhiệt)
ΔrHo298< 0 (phản ứng tỏa nhiệt)
Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành (ở điều kiện chuẩn):
ΔrHo298=∑ΔfHo298(sp)−∑ΔfHo298(cd)
Tính biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí) theo năng lượng liên kết (ở điều kiện chuẩn):
ΔrHo298=∑Eb(cd)−∑Eb(sp)
II. Luyện tập
Câu hỏi 1 trang 89 Hóa học 10: Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ) ⟶ P (s, trắng) ΔrHo298 = 17,6 kJ
A. thu nhiệt, P đỏ bền hơn P trắng.
B. thu nhiệt, P trắng bền hơn P đỏ.
C. toả nhiệt, P đỏ bền hơn P trắng.
D. toả nhiệt, P trắng bền hơn P đỏ.
Lời giải:
Đáp án đúng là: A
ΔrHo298> 0 ⇒ Phản ứng thu nhiệt.
ΔrHo298= ΔfHo298(P, trắng) - ΔfHo298(P, đỏ) > 0
⇒ ΔfHo298(P, trắng) > ΔfHo298(P, đỏ)
⇒ P trắng có mức năng lượng cao hơn tức là kém bền hơn P đỏ.
Câu hỏi 2 trang 89 Hóa học 10: Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
CO (g) + 12 O2 (g) ⟶ CO2 (g) ΔrHo298 = -283,0 kJ
Biết nhiệt tạo thành chuẩn của CO2: ΔfHo298 (CO2 (g)) = –393,5 kJ/mol.
Nhiệt tạo thành chuẩn của CO là
Lời giải:
Đáp án đúng là: A
ΔrHo298= ΔfHo298(CO2(g)).1 – [ΔfHo298(CO(g)) + ΔfHo298(O2(g)).12]
⇒ - 283 = - 393,5.1 – [ΔfHo298(CO(g)) + 0. 12]
⇒ ΔfHo298(CO(g)) = - 110,5 kJ
Lời giải:
Đáp án đúng là: A
Khối lượng của glucose trong 500 mL dung dịch glucose 5% là
mglucose = 500.1,02.5100= 25,5 gam
Oxi hóa 180 gam (1mol) glucose toả ra nhiệt lượng là 2 803,0 kJ.
⇒ Oxi hóa 25,5 gam glucose toả ra nhiệt lượng là 25,5.2803180=397,09 kJ
Vậy năng lượng tối đa từ phản ứng oxi hóa hoàn toàn glucose mà bệnh nhân đó có thể nhận được là +397,09 kJ.
Câu hỏi 4 trang 90 Hóa học 10: Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
Biến thiên enthalpy của phản ứng C3H8(g) ⟶ CH4(g) + C2H4(g) có giá trị là
Lời giải:
Đáp án đúng là: C
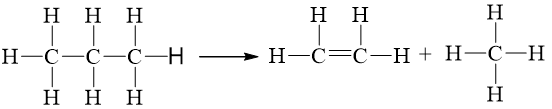
∑Eb(cd)=2.Eb(C – C) + 8.Eb(C – H) = 2.346 + 8.418 = 4036 kJ
∑Eb(sp)=1.Eb(C = C) + 8.Eb(C – H) = 1.612 + 8.418 = 3956 kJ
⇒ ΔrHo298=∑Eb(cd)−∑Eb(sp)= 4036 – 3956 = +80 kJ
CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) ΔrHo298 = – 890,3 kJ
Lời giải:
ΔrHo298= [ΔfHo298(CO2(g))+ΔfHo298(H2O(l)).2] - [ΔfHo298(CH4(g))+ΔfHo298(O2(g)).2]
⇒ – 890,3 = [(– 393,5) + (– 285,8.2)] – [ΔfHo298(CH4(g)) + 0.2]
⇒ ΔfHo298(CH4(g))= – 74,8 kJ/mol
C2H5OH(l) + 3O2(g) ⟶ 2CO2(g) + 3H2O(l) ΔrHo298 = – 1 365 kJ
C57H110O6(s) + 1632 O2(g) ⟶ 57 CO2(g) + 55H2O(l) ΔrHo298 = – 35 807 kJ
Lời giải:
Đốt cháy 46 gam (1mol) C2H5OH tỏa ra lượng nhiệt là 1 365 kJ
⇒ Đốt cháy 1000 gam (1 kg) C2H5OH tỏa ra lượng nhiệt là 1000.136546=29674 kJ.
Đốt cháy 890 gam (1mol) C57H110O6 tỏa ra lượng nhiệt là 35 807 kJ.
⇒ Đốt cháy 1000 gam (1kg) C57H110O6 tỏa ra lượng nhiệt là 1000.35807890=40232,6kJ.
So sánh:
Nhiệt tỏa ra khi đốt cháy hoàn toàn 1 kg tristearin có trong mỡ lợn > khi đốt cháy hoàn toàn 1 kg cồn.
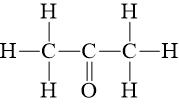
Câu hỏi 7 trang 90 Hóa học 10: Biết CH3COCH3 có công thức cấu tạo:
CH3COCH3(g) + 4O2(g) ⟶ 3CO2(g) + 3H2O(g)
Lời giải:
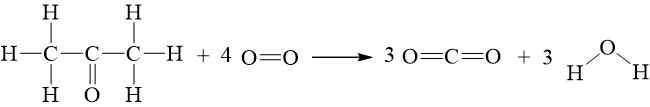
∑Eb(cd)=2.Eb(C – C) + 6.Eb(C – H) + 1.Eb(C = O) + 4.Eb(O = O)
= 2.346 + 6.418 + 1.732 + 4. 494 = 5908 kJ
∑Eb(sp)=6.Eb(C = O) + 6.Eb(O – H) = 6.732 + 6.459 = 7146 kJ
⇒ ΔrHo298=∑Eb(cd)−∑Eb(sp)= 5908 – 7146 = - 1238 kJ
C3H8(g) + 5O2(g) ⟶ 3CO2(g) + 4H2O(1) ΔrHo298= –2 220 kJ
C4H10(g) + 132O2(g) ⟶ 4CO2(g) + 5H2O (1) ΔrHo298 = –2 874 kJ
Lời giải:
Gọi x là số mol của propane trong bình gas.
⇒ 2x là số mol của butane trong bình gas.
Khối lượng 12 kg khí gas bằng 44x + 58.2x = 12.1000 (gam) ⇒ x = 75 (mol)
1 mol propane cháy tỏa ra 2 220 kJ nhiệt lượng.
1 mol butane cháy tỏa ra 2 874 kJ nhiệt lượng.
Tổng nhiệt lượng tỏa ra khi đốt cháy hoàn toàn một bình gas 12kg là:
75.2220 + 2.75.2874 = 597600 kJ
Số ngày mà hộ gia đình sử dụng hết bình gas là
597600.0,810000 ≈ 48 ngày
Lý thuyết Ôn tập chương 5
I. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Ví dụ: Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
II. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ).
Ở điều kiện chuẩn: ΔrHo298=∑ΔfHo298(sp)−∑ΔfHo298(cđ).
Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hóa học.
Ví dụ: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
CO(g) + 12O2(g) → CO2(g)
biết nhiệt tạo thành chuẩn ΔfHo298 của CO2(g) là –393,5 kJ/mol, của CO(g) là –110,5 kJ/mol.
Hướng dẫn giải:
ΔrHo298=ΔfHo298(CO2(g))−[ΔfHo298(CO)(g))+12ΔfHo298(O2(g))
= –393,5 – (–110,5 + 0×![]() ) = –283 (kJ).
) = –283 (kJ).
III. Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết
Biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí), bằng hiệu số giữa tổng năng lượng liên kết của các chất đầu và tổng năng lượng liên kết của các sản phẩm (ở cùng điều kiện nhiệt độ và áp suất).
Ở điều kiện chuẩn: ΔrHo298= ∑Eb(cđ) – ∑Eb(sp).
Ví dụ: Tính biến thiên enthalpy chuẩn của phản ứng
C3H8(g) → CH4(g) + C2H4(g)
biết năng lượng liên kết (ở điều kiện chuẩn):

Hướng dẫn giải:
→ ΔrHo298= 3Eb (C–C) + 8Eb (C–H) – 4Eb (C–H) – 2Eb (C=C) – 4Eb (C–H)
= 3×346 + 8×418 – 4×418 – 2×612 – 4×418 = –186 (kJ).
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 22: Hydrogen halide. Muối halide
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức