Giải Hóa 10 Bài 13 (Kết nối tri thức): Liên kết hydrogen và tương tác Van der waals
Với giải bài tập Hóa 10 Bài 13: Liên kết hydrogen và tương tác Van der waals sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 13.
Giải bài tập Hóa lớp 10 Bài 13: Liên kết hydrogen và tương tác Van der waals
Video giải bài tập Hóa lớp 10 Bài 13: Liên kết hydrogen và tương tác Van der waals
Lời giải:
Em cần nhớ:
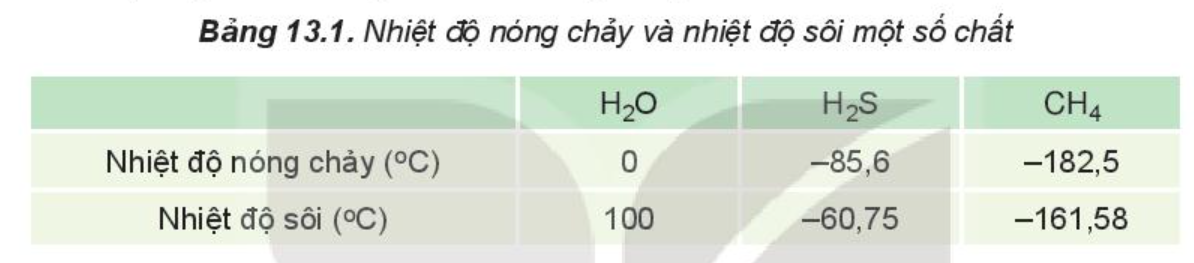
Nhiệt độ nóng chảy và nhiệt độ sôi của một chất phụ thuộc chính vào hai yếu tố: Khối lượng phân tử và liên kết giữa các phân tử
+ Khối lượng phân tử càng lớn nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
+ Liên kết giữa các phân tử càng mạnh thì nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
Ta có:
- Các phân tử H2O tạo được liên kết hydrogen với nhau do trong phân tử liên kết O-H phân cực mạnh, nguyên tử O còn cặp electron chưa liên kết.
- Các phân tử H2S và CH4 không tạo được liên kết hydrogen với nhau.
⇒ Nhiệt độ sôi của H2O lớn hơn nhiều so với H2S và CH4.
- Khối lượng phân tử H2S (34 amu) lớn gần gấp đôi khối lượng phân tử của CH4 (16 amu).
- Liên kết S-H phân cực hơn liên kết C-H nên tương tác van der Waals giữa các phân tử H2S mạnh hơn tương tác van der Waals giữa các phân tử CH4.
⇒ Nhiệt độ sôi của H2S hớn hơn nhiệt độ sôi của CH4.
II. Liên kết hydrogen
Câu hỏi 1 trang 66 Hóa học 10: Vẽ sơ đồ biểu diễn liên kết hydrogen giữa:
a) hai phân tử hydrogen fluoride (HF).
b) phân tử hydrogen fluoride (HF) và phân tử ammonia (NH3).
Lời giải:
a)
![]()
b)
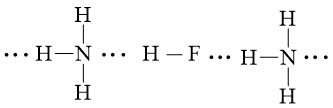
Lời giải:
Những nguyên tử H không gắn nguyên tử O thì không tham gia vào liên kết hydrogen.
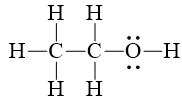
Vì để tham gia vào liên kết hydrogen, nguyên tử hydrogen phải liên kết với các nguyên tử có độ âm điện lớn như F, O, N, … và các nguyên tử tử này phải có ít nhất 1 cặp electron hóa trị chưa tham gia liên kết.
Trong phân tử ethanol chỉ có nguyên tử O còn cặp electron hóa trị chưa tham gia liên kết.
⇒ Chỉ có nguyên tử H gắn vào O trong ethanol tham gia vào liên kết hydrogen.
III. Tương tác Van der waals
Câu hỏi 3 trang 67 Hóa học 10: Hãy giải thích sự khác nhau về nhiệt độ sôi của butane và isobutane.
Lời giải:
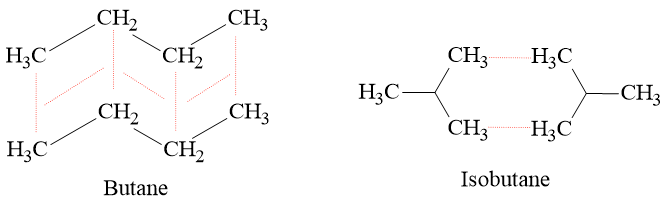
Butane và isobutane là hợp chất cộng hóa trị không phân cực và có cùng công thức phân tử là C4H10. Tuy nhiên diện tích tiếp xúc của các phân tử butane lớn hơn dẫn đến tương tác van der Waals lớn hơn so với các phân tử isobutane.
⇒ Năng lượng cần để phá vỡ lực liên phân tử (tương tác van der Waals) giữa các phân tử butane nhiều hơn isobutane nên có nhiệt độ sôi cao hơn.
Lời giải:
Để so sánh được tính chất vật lí giữa các phân tử, chúng ta cần nắm được những ý sau:
- Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
- Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực được hình thành giữa các phân tử hay nguyên tử.
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Lý thuyết Liên kết hydrogen và tương tác van der waals
I. Mở đầu
Các tính chất vật lí của các chất có liên kết cộng hóa trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng của phân tử và mức độ phân cực của liên kết cộng hóa trị trong phân tử.
Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hóa trị hay liên kết kim loại. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals (Van đơ Van).
II. Liên kết hydrogen
1. Bản chất của liên kết hydrogen
Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
Ví dụ:
 Một số kiểu tạo thành liên kết hydrogen:
Một số kiểu tạo thành liên kết hydrogen:
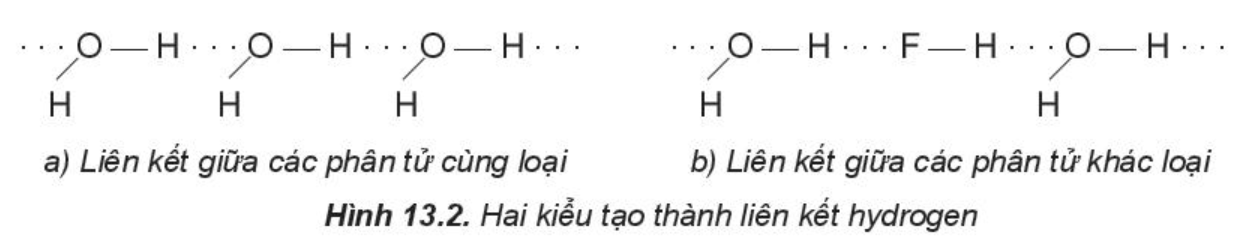
Chú ý:
- Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N …
+ Nguyên tử F, O, N, … liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
2. Vai trò và ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
Ví dụ: Do ảnh hưởng của liên kết hydrogen nên nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4.
III. Tương tác van der Waals
1. Khái niệm tương tác van der Waals
Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Ví dụ:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
2. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
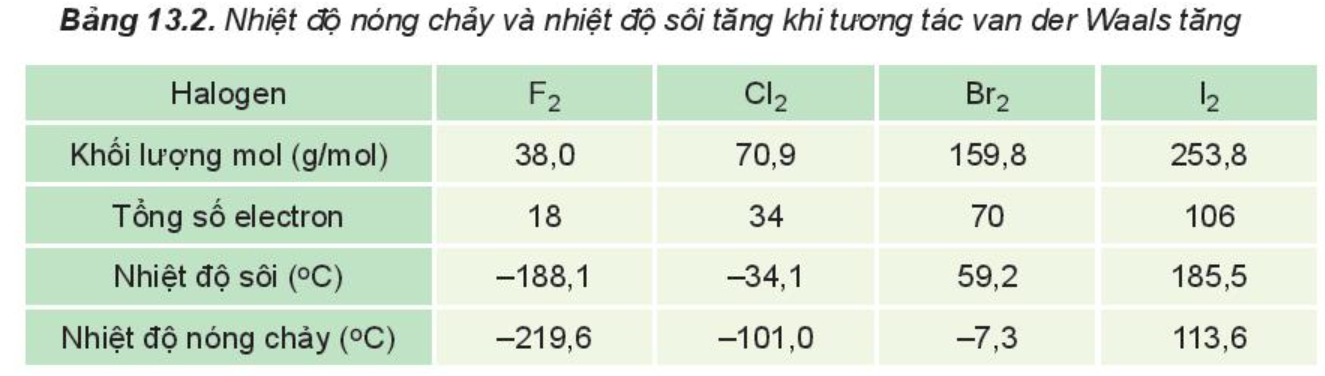
Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
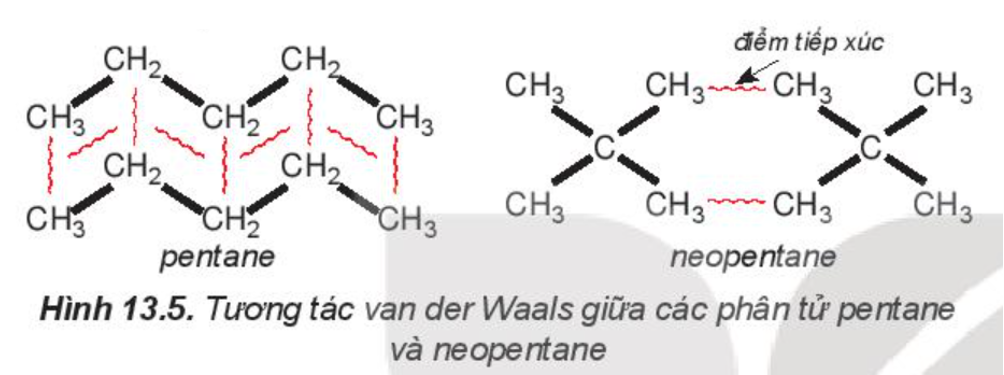
Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 15: Phản ứng oxi hóa – khử
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Lý thuyết Bài 13: Liên kết hydrogen và tương tác van der waals
Trắc nghiệm Bài 13: Liên kết hydrogen và tương tác van der Waals
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
