Giải Hóa 10 Bài 17 (Kết nối tri thức): Biến thiên enthalpy trong các phản ứng hóa học
Với giải bài tập Hóa 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 17.
Giải bài tập Hóa lớp 10 Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Lời giải:
Phản ứng giữa đường glucose với oxygen tạo ra carbon dioxide, hơi nước là phản ứng tỏa nhiệt. Năng lượng tạo ra dưới dạng nhiệt của phản ứng này cung cấp cho cơ thể, giúp cơ thể hoạt động hiệu quả và ta cảm thấy khỏe hơn.
I. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
Em hãy dự đoán phản ứng này toả nhiệt hay thu nhiệt.
Lời giải:
Phản ứng này là phản ứng thu nhiệt vì cần cung cấp nhiệt độ để sự phân hủy KMnO4 xảy ra, nếu ngừng đun nóng thì phản ứng dừng lại.
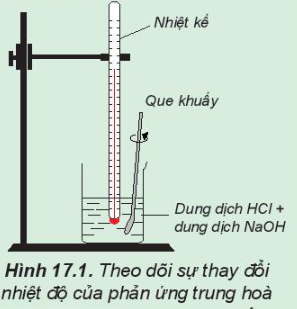
Hoạt động trang 82 Hóa học 10: Theo dõi sự thay đổi nhiệt độ của phản ứng trung hoà
- Dùng ống đong khác lấy 50 mL dung dịch NaOH 0,5 M cho vào cốc phản ứng. Khuấy nhẹ.
Theo dõi sự thay đổi nhiệt độ của dung dịch và trả lời câu hỏi:
Lời giải:
1. Sau khi rót dung dịch NaOH vào cốc thì nhiệt độ trên nhiệt kế tăng dần.
HCl + NaOH → NaCl + H2O
⇒ Phản ứng tỏa nhiệt.
2. Nếu thay các dung dịch HCl và NaOH bằng các dung dịch loãng hơn thì nhiệt độ tăng chậm hơn.
II. Biến thiên enthalpy của phản ứng
Câu hỏi 2 trang 83 Hóa học 10: Cho các phương trình nhiệt hoá học:
(1) CaCO3(s) → CaO(s) + CO2(g) ΔrHo298=+176,0 kJ
(2) C2H4(g) + H2(g) → C2H6(g) ΔrHo298=−137,0 kJ
(3) Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(s) ΔrHo298=−851,5 kJ
Trong các phản ứng trên, phản ứng nào toả nhiệt, phản ứng nào thu nhiệt?
Lời giải:
ΔrHo298> 0 ⇒ Phản ứng thu nhiệt.
⇒ Phản ứng thu nhiệt: (1)
ΔrHo298 < 0 ⇒ Phản ứng tỏa nhiệt.
⇒ Phản ứng tỏa nhiệt: (2), (3).
Câu hỏi 3 trang 83 Hóa học 10: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
CO (g) + 12O2 (g) ⟶ CO2 (g) ΔrHo298=−283,0 kJ
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là bao nhiêu?
Lời giải:
1 mol khí ở điều kiện chuẩn tương đương 24,79 L
Phản ứng đốt cháy 1 mol hay 24,79L khí carbon monoxide (CO) tỏa ra nhiệt lượng là 283,0kJ.
⇒ Nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là:
2,479.283,024,79=28,3 kJ
Lời giải:
Một số biện pháp để đảm bảo an toàn khi thực hiện quá trình tôi vôi:
- Mặc đồ bảo hộ (quần áo, đi giày kín, đeo kính bảo hộ, đeo khẩu trang) khi thực hiện quá trình tôi vôi.
- Làm rào chắn, biển báo để cảnh báo những người không liên quan tránh xa hố vôi tôi.
- Cởi bỏ quần áo, vệ sinh sạch sẽ khi kết thúc quá trình tôi vôi.
III. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Câu hỏi 5 trang 86 Hóa học 10: Cho phản ứng:
C (kim cương) ⟶ C (graphite) ΔrHo298=−1,9 kJ
a) Ở điều kiện chuẩn, kim cương hay graphite có mức năng lượng thấp hơn?
Lời giải:
a) C (kim cương) ⟶ C (graphite) ΔrHo298=−1,9 kJ
⇒ ΔrHo298 = ΔfHo298(graphite) - ΔfHo298(kim cương) < 0
⇒ ΔfHo298(graphite) < ΔfHo298(kim cương)
⇒ Dạng graphite có mức năng lượng thấp hơn kim cương.
⇒ Graphite bền vững hơn.
b) Trong phản ứng xác định nhiệt tạo thành của CO2(g): C(s) + O2(g) → CO2(g).
Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định
⇒ Trong phản ứng xác định nhiệt tạo thành của CO2(g) carbon ở dạng graphite vì graphite là dạng bền vững hơn.
C2H6 (g) + 72O2 (g) to→ 2CO2 (g) + 3H2O (l) (1)
Lời giải:
Tổng nhiệt tạo thành các chất đầu là:
∑ΔfHo298(cd)= ΔfHo298(C2H6(g)).1+ΔfHo298(O2(g)).72= (-84,7.1) + 0.72= - 84,7 (kJ)
Tổng nhiệt tạo thành các chất sản phẩm là:
∑ΔfHo298(sp)=ΔfHo298(CO2(g)).2+ΔfHo298(H2O(l)).3
= (-393,5.2) + (-285,8.3) = - 1644,4 (kJ)
⇒ Biến thiên enthalpy của phản ứng:
ΔrHo298=∑ΔfHo298(sp)−∑ΔfHo298(cd)= - 1559,7 (kJ)
IV. Tính biến thiên enthalpy của phản ứng theo liên kết năng lượng liên kết
b) Giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Lời giải:
a) ΔrHo298=[Eb(N≡N).1+Eb(O=O).1]−Eb(N=O).2
= [945.1 + 494.1] – 607.2 = 225 (kJ)
b) ΔrHo298 = 225 kJ > 0 ⇒ Phản ứng thu nhiệt.
Tức là 1 mol N2 (g) phản ứng với 1 mol O2 (g) cần cung cấp 225kJ nhiệt lượng
⇒ Nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Lời giải:
Phương trình hóa học:
C4H10 (g) + 132O2 (g) to→ 4CO2 (g) + 5H2O (g)
∑Eb(cd)= 3.Eb (C – C) + 10.Eb (C – H) + 132.Eb (O = O)
= 3.346 + 10.418 + 132.494 = 8429 kJ
∑Eb(sp)= 8.Eb (C = O) + 10.Eb (O – H) = 8.732 + 10.459 = 10446 kJ
Biến thiên enthalpy của phản ứng đốt cháy butane là:
ΔrHo298=∑Eb(cd)−∑Eb(sp)= 8429 – 10446 = -2017 kJ.
Lý thuyết Biến thiên enthalpy trong các phản ứng hóa học
I. Phản ứng tỏa nhiệt, phản ứng thu nhiệt
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
 Ví dụ:
Ví dụ:
Khi than, củi cháy, không khí xung quanh ấm hơn do phản ứng tỏa nhiệt.
Pha viên sủi vitamin C vào nước, khi viên sủi tan, thấy nước trong cốc mát hơn, đó là do xảy ra phản ứng thu nhiệt.
Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
II. Biến thiên enthalpy của phản ứng
1. Biến thiên enthalpy
Hầu hết các quá trình hóa học trong thực tế xảy ra ở điều kiện áp suất không đổi. Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện này gọi là biến thiên enthalpy của phản ứng (nhiệt phản ứng), kí hiệu là DrH.
Phương trình hóa học kèm theo trạng thái của các chất và giá trị DrH gọi là phương trình nhiệt hóa học.
Ví dụ: Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng, tỏa ra nhiệt lượng 571,6 kJ. Phản ứng trên có biến thiên enthalpy ΔrH0298 = –571,6 kJ, biểu diễn bằng phương trình nhiệt hóa học như sau:
2H2(g) + O2(g) → 2H2O(l) ΔrH0298 = –571,6 kJ
Ví dụ 2: Phản ứng nhiệt phân hoàn toàn 1 mol Cu(OH)2, tạo thành 1 mol CuO và 1 mol H2O, thu vào nhiệt lượng 9,0 kJ. Phản ứng trên có biến thiên enthalpy ΔrH0298 = +9,0 kJ và biểu diễn bằng phương trình nhiệt hóa học như sau:
Cu(OH)2(s) to→ CuO(s) + H2O(l) ΔrH0298 = +9,0 kJ
2. Biến thiên enthalpy chuẩn
Biến thiên enthalpy chuẩn là nhiệt tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/l (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 25oC (298K), kí hiệu ΔrHo298.
Ví dụ: Phản ứng đốt cháy hoàn toàn 1 mol carbon graphite trong khí oxygen dư (ở điều kiện chuẩn) tạo ra 1 mol CO2, nhiệt lượng tỏa ra là 393,5 kJ. Phương trình nhiệt hóa học của phản ứng được viết như sau:
C(graphite) + O2(g) to→ CO2(g) ΔrHo298 = –393,5 kJ
3. Ý nghĩa của biến thiên enthalpy
Dấu của biến thiên enthalpy cho biết phản ứng tỏa nhiệt hay thu nhiệt:
ΔrHo298 > 0: phản ứng thu nhiệt.
ΔrHo298 < 0: phản ứng tỏa nhiệt.
Chú ý: Gía trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều.
Ví dụ: Xét 2 phản ứng
CH4(g) + 2O2(g) to→ CO2(g) + 2H2O(l) ΔrHo298 = –890 kJ
CH3OH(l) + ![]() O2(g) to→ CO2(g) + 2H2O(l) ΔrHo298 = –726 kJ
O2(g) to→ CO2(g) + 2H2O(l) ΔrHo298 = –726 kJ
Vậy, khi đốt 1 mol methane (16 g) tỏa ra nhiệt lượng nhiều hơn đốt 1 mol methanol (32 g).
Chú ý: Các phản ứng xảy ra ở nhiệt độ phòng thường là phản ứng tỏa nhiệt, các phản ứng thu nhiệt thường xảy ra khi đun nóng.
III. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
1. Khái niệm nhiệt tạo thành
Nhiệt tạo thành (DfH) của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định.
Nhiệt tạo thành chuẩn (ΔrHo298) là nhiệt tạo thành ở điều kiện chuẩn.
Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0. Ví dụ: ΔfHo298(O2(g))=0 kJ.
Ví dụ 1: Nước lỏng được tạo thành từ khí hydrogen và khí oxygen theo phản ứng:
H2(g) + 12O2(g) → H2O(l)
Ở điều kiện chuẩn, cứ 1 mol H2O(l) tạo thành từ 1 mol H2(g) và 12 mol O2(g) giải phóng nhiệt lượng là 285,8 kJ.
Như vậy, nhiệt tạo thành của nước lỏng: ΔfHo298(H2O(l))=−285,8 kJ/mol.
Ví dụ 2: Phản ứng 12N2(g) + 12O2(g) → NO(g) có biến thiên enthalpy: ΔfHo298(H2O(l))=+90,3kJ/mol. Giá trị > 0, tức phản ứng này là phản ứng thu nhiệt.
2. Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành
Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ).
Ở điều kiện chuẩn: ΔrHo298=∑ΔfHo298(sp)−∑ΔfHo298(cđ).
Trong tính toán cần lưu ý đến hệ số của các chất trong phương trình hóa học.
Ví dụ 1: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
SO2(g) + 12O2(g) → SO3(l)
biết nhiệt tạo tạo thành ΔfHo298 của SO2(g) là –296,8 kJ/mol, của SO3(l) là – 441,0 kJ/mol.
Hướng dẫn giải:
ΔrHo298=ΔfHo298(SO3(l))−[ΔfHo298(SO2)(g))+12ΔfHo298(O2(g))
= – 441,0 – (–296,8 + 0×12) = –144,2 (kJ).
Ví dụ 2: Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn
4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g)
biết nhiệt tạo thành ΔfHo298 của các chất FeS2(s), Fe2O3(s) và SO2(g) lần lượt là –177,9 kJ/mol, –825,5 kJ/mol và –296,8 kJ/mol.
Hướng dẫn giải:
Tổng nhiệt tạo thành các chất ban đầu là:
ΔfHo298(cđ) = ΔfHo298(FeS2(s))×4+ΔfHo298(O2(g))×11 = (–177,9)×4 + 0×11 = –711,6 (kJ).
Tổng nhiệt tạo thành các chất sản phẩm là:
ΔrHo298(sp)=ΔfHo298(Fe2O3(s))×2+ΔfHo298(SO2(g))×8
= (–825,5)×2 + (–296,8)×8 = –4025,4 (kJ).
Vậy, biến thiên enthalpy của phản ứng:
ΔrHo298=∑ΔfHo298(sp)−∑ΔfHo298(cđ) = –4025,4 – (–711,6) = –3313,8 (kJ).
IV. Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết
Biến thiên enthalpy của phản ứng (mà các chất đều ở thể khí), bằng hiệu số giữa tổng năng lượng liên kết của các chất đầu và tổng năng lượng liên kết của các sản phẩm (ở cùng điều kiện nhiệt độ và áp suất).
Ở điều kiện chuẩn: ΔrHo298= ∑Eb(cđ) – ∑Eb(sp).
Ví dụ 1: Tính biến thiên enthalpy chuẩn của phản ứng
H2(g) + Cl2(g) → 2HCl(g)
biết Eb (H–H) = 436 kJ/mol, Eb (Cl–Cl) = 243 kJ/mol, Eb (H–Cl) = 432 kJ/mol.
Hướng dẫn giải:
Biến thiên enthalpy chuẩn của phản ứng là:
ΔrHo298 = Eb (H–H) + Eb (Cl–Cl) – 2×Eb (H–Cl) = 436 + 243 – 2×432 = –185 (kJ).
Phản ứng tỏa nhiệt vì khi tạo thành 2 liên kết H–Cl tỏa ra năng lượng lớn hơn năng lượng cần thiết để phá vỡ liên kết H–H và Cl–Cl.
Ví dụ 2: Xác định biến thiên enthalpy chuẩn của phản ứng
C2H4(g) + H2(g) → C2H6(g)
biết năng lượng liên kết (ở điều kiện chuẩn):

Hướng dẫn giải:
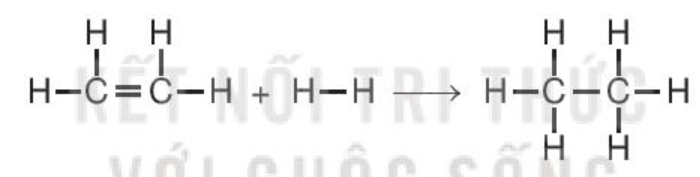
→ ΔrHo298 = Eb (C=C) + 4Eb (C–H) + Eb (H–H) – Eb (C–C) – 6Eb (C–H)
= 612 + 4×418 + 436 – 346 – 6×418 = –134 (kJ).
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 22: Hydrogen halide. Muối halide
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Lý thuyết Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Trắc nghiệm Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức