Giải Hóa 10 Bài 23 (Kết nối tri thức): Ôn tập chương 7
Với giải bài tập Hóa 10 Bài 23: Ôn tập chương 7 sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 23.
Giải bài tập Hóa lớp 10 Bài 23: Ôn tập chương 7
I. Hệ thống hóa kiến thức
Hệ thống hóa kiến thức trang 117 Hóa học 10: Hoàn thành các nội dung còn thiếu sau đây:

Lời giải:
HALOGEN
1. Nguyên tử halogen
- Cấu hình lớp electron ngoài cùng của các nguyên tử halogen: ns2np5.
- Xu hướng nhận 1 electron trở thành ion halide: X + 1e ⟶ X- thể hiện tính oxi hóa của X.
2. Đơn chất halogen
- Xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi từ F2 đến I2: tăng dần
Giải thích: Tương tác van der Waals giữa các phân tử tăng và khối lượng phân tử tăng.
- Xu hướng biến đổi tính oxi hoá của các halogen: giảm dần
Giải thích: Độ âm điện giảm dần từ F đến I nên khả năng nhận electron giảm dần từ F đến I.
- Các phản ứng hoá học được sử dụng để điều chế chlorine:
Trong công nghiệp:
2NaCl + 2H2O dp dd→co mang ngan xop 2NaOH + H2 + Cl2.
Trong phòng thí nghiệm:
MnO2 + 4HCl (đặc) to→ MnCl2 + Cl2 + 2H2O
Hoặc
2KMnO4 + 16HCl (đặc) ⟶ 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3. Hydrogen halide
- Sự biến đổi nhiệt độ sôi của các halogen halide từ HF đến HI: giảm từ HF đến HCl, tăng HCl đến HI.
Giải thích: HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen ; còn từ HCl đến HI, nhiệt độ sôi tăng do:
+ Lực tương tác van der Waals giữa các phân tử tăng
+ Khối lượng phân tử tăng.
- Xu hướng biến đổi tính acid từ HF đến HI tăng dần.
Giải thích: năng lượng liên kết giữa hydrogen với halogen giảm dần từ HF đến HI nên độ linh động của nguyên tử hydrogen tăng dần từ HF đến HI.
4. Muối halide
- Cách phân biệt các ion F-, Cl-, Br-, I- trong dung dịch muối và acid: dùng dung dịch AgNO3.
- Sắp xếp các ion Cl-, Br-, I- theo thứ tự tính khử tăng dần: Cl-, Br-, I-.
II. Luyện tập
Câu hỏi 1 trang 118 Hóa học 10: Liên kết trong phân tử nào sau đây có độ phân cực lớn nhất?
Lời giải:
Đáp án đúng là: A
Liên kết trong phân tử HF có độ phân cực lớn nhất. Vì:
Đi từ F đến I độ âm điện giảm dần.
⇒ Fluorine là nguyên tố halogen có độ âm điện lớn nhất
⇒ Phân tử H – F sẽ phân cực nhất so với H – Cl, H – Br, H – I.
Lời giải:
Đáp án đúng là: C
Trong nhóm halogen, từ F đến I, bán kính nguyên tử tăng dần do số lớp electron tăng dần, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
Câu hỏi 3 trang 118 Hóa học 10: Trong dãy đơn chất từ F2 đến I2, chất có tính oxi hoá mạnh nhất là
Lời giải:
Đáp án đúng là: A
Trong dãy đơn chất từ F2 đến I2, chất có tính oxi hoá mạnh nhất là F2. Vì F2 có độ âm điện lớn nhất ⇒ Khả năng nhận electron là lớn nhất ⇒ Tính oxi hóa mạnh nhất.
Tính oxi hóa: F2 > Cl2 > Br2 > I2
Lời giải:
Đáp án đúng là: C
Khi tiến hành điều chế và thu khí Cl2 vào bình, để ngăn khí Cl2 thoát ra ngoài gây độc, cần đậy miệng bình thu khí Cl2 bằng bông có tẩm dung dịch NaOH. Vì NaOH hấp thụ được khí Cl2 tạo thành nước Javel.
Phương trình hóa học:
Cl2 + 2NaOH ⟶ NaCl + NaClO + H2O
Khối lượng muối hộ gia đình thu được là
Lời giải:
Đáp án đúng là: D
Ta có, 1 L nước biển chứa 30 g NaCl.
⇒ 200 000 L nước biển chứa 200000.301=6000000g NaCl = 6000 kg NaCl
Do hiệu suất quá trình làm muối thành phẩm đạt 60% nên khối lượng muối hộ gia đình thu được là 6000.60100=3600kg
Kí hiệu của nguyên tố X và Y lần lượt là
Lời giải:
Đáp án đúng là: A
Giả sử X là fluorine (F), Y là chlorine.
NaF + AgNO3 không phản ứng
NaCl + AgNO3 ⟶ AgCl↓ + NaNO3
⇒ nAgCl = 0,574143,5=0,004mol
⇒ nNaCl = nAgCl = 0,004 mol
⇒ mNaCl = 0,004.58,5 = 0,234 < 0,402
⇒ thỏa mãn.
Vậy kí hiệu của nguyên tố X và Y lần lượt là F và Cl.
Lý thuyết Ôn tập chương 7
I. Halogen
1. Nguyên tử halogen
Cấu hình lớp electron ngoài cùng của các nguyên tử halogen có dạng: ns2np5 (có 7 electron ở lớp ngoài cùng).
→ Xu hướng: dễ nhận thêm 1 electron để đạt được cấu hình electron bền của khí hiếm gần nhất:
X + 1e → X-
2. Đơn chất halogen
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do:
+ Tương tác van der Waals giữa các phân tử tăng.
+ Khối lượng phân tử tăng.
- Tính oxi hóa giảm dần từ fluorine đến iodine.
- Các phản ứng hóa học được sử dụng để diều chế chlorine:
+ Trong công nghiệp:
2NaCl + 2H2Odpdd, co mang ngan→ 2NaCl + H2 + Cl2.
+ Trong phòng thí nghiệm:
MnO2 + 4HCl(đặc) MnCl2 + Cl2 + 2H2O
2KMnO4 + 16HCl(đặc) → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3. Hydrogen halide
- Nhiệt độ sôi của các hydrogen halide
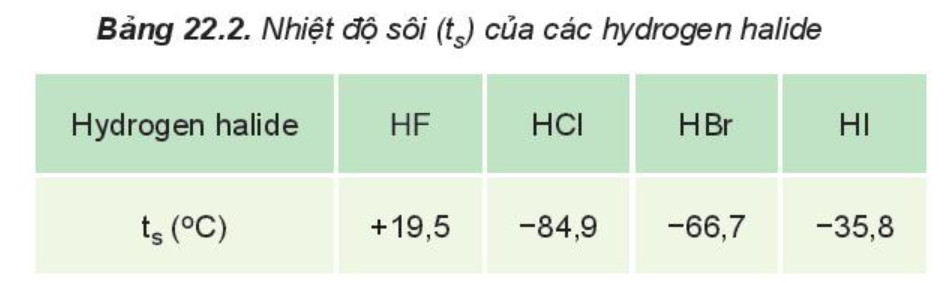
Giải thích:
HF lỏng có nhiệt độ sôi cao bất thường là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen: .
Từ HCl đến HI, nhiệt độ sôi tăng do:
- Lực tương tác van der Waals giữa các phân tử tăng.
- Khối lượng phân tử tăng.
- Xu hướng biến đổi tính acid:
Trong dãy hydrohalic acid, tính acid tăng từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh).
4. Muối halide
- Phân biệt các ion F-, Cl-, Br-, I- trong dung dịch muối và acid:
Dùng dung dịch silver nitrate (AgNO3) để phân biệt các ion halide (X-).
Trong đó:
+ Khi X- là F- thì không thấy sự biến đổi, do không có phản ứng hóa học xảy ra.
+ Khi X- là Cl- thì xuất hiện kết tủa trắng silver chloride (AgCl).
+ Khi X- là Br- thì xuất hiện kết tủa màu vàng nhạt silver bromide (AgBr).
+ Khi X- là I- thì xuất hiện kết tủa màu vàng silver iodide (AgI).
Ví dụ: Phân biệt các dung dịch: NaF, NaCl, NaBr, NaI.
Dùng dung dịch AgNO3.
+ Không có hiện tượng gì là dung dịch NaF.
+ Xuất hiện kết tủa màu trắng là dung dịch NaCl.
NaCl + AgNO3 NaNO3 + AgCl¯
+ Xuất hiện kết tủa màu vàng nhạt là dung dịch NaBr.
NaBr + AgNO3 NaNO3 + AgBr¯
+ Xuất hiện kết tủa màu vàng là dung dịch NaI.
NaI + AgNO3 NaNO3 + AgI¯
- Tính khử của các ion halide tăng dần theo thứ tự Cl- < Br- < I-.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 1: Thành phần của nguyên tử
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
