Giải Hóa 10 Bài 20 (Kết nối tri thức): Ôn tập chương 6
Với giải bài tập Hóa 10 Bài 20: Ôn tập chương 6 sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 20.
Giải bài tập Hóa lớp 10 Bài 20: Ôn tập chương 6
I. Hệ thống hóa kiến thức
Hệ thống hóa kiến thức trang 101 Hóa học 10:
Hoàn thành các nội dung còn thiếu sau đây:
Tốc độ phản ứng:
Xét phản ứng hóa học dạng tổng quát: aA + bB → cC + dD.
Biểu thức tốc độ trung bình của phản ứng: vtb = …?...
Nếu phản ứng trên là một phản ứng đơn giản thì biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: v = …?...
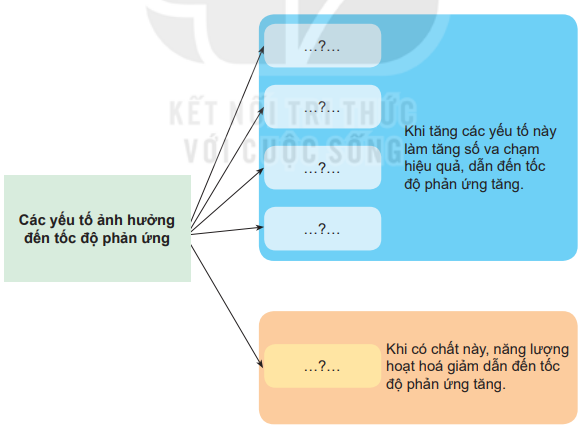
Các yếu tố ảnh hưởng đến tốc độ phản ứng
Lời giải:
Tốc độ phản ứng:
Xét phản ứng hoá học dạng tổng quát: aA + bB ⟶ cC + dD.
Biểu thức tốc độ trung bình của phản ứng:
Vtb=−1a.ΔCAΔt=−1b.ΔCBΔt=1c.ΔCCΔt=1d.ΔCDΔt
Nếu phản ứng trên là một phản ứng đơn giản thì biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: v = k.CaA.CbB
Các yếu tố ảnh hưởng đến tốc độ phản ứng
+ Nồng độ
+ Áp suất
+ Nhiệt độ
+ Diện tích tiếp xúc
⇒ Khi tăng các yếu tố này làm tăng số va chạm hiệu quả, dẫn đến tốc độ phản ứng tăng.
+ Chất xúc tác: Khi có chất này, năng lượng hoạt hoá giảm dẫn đến tốc độ phản ứng tăng.
II. Luyện tập
Lời giải:
(a) Đốt cháy nhiên liệu: xảy ra với tốc độ nhanh.
(b) Sắt bị gỉ: xảy ra với tốc độ chậm.
(c) Trung hòa acid – base: xảy ra với tốc độ nhanh.
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
(b) Thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1 M có cùng thể tích.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 °C).
Lời giải:
(a) Khi thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều
⇒ tăng diện tích tiếp xúc của Zn với dung dịch acid.
⇒ Tốc độ phản ứng tăng
(b) Khi thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1 M có cùng thể tích
⇒ Nồng độ acid giảm.
⇒ Tốc độ phản ứng giảm.
(c) Khi thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50 °C)
⇒ Số lần va chạm hiệu quả tăng.
⇒ Tốc độ phản ứng tăng.
Câu hỏi 3 trang 102 Hóa học 10: Hydrogen peroxide phân huỷ theo phản ứng:
Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
a) Vẽ đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian.
b) Tính tốc độ trung bình của phản ứng (theo cm3/min) trong các khoảng thời gian:
- Từ 0 ÷ 15 phút; - Từ 15 ÷ 30 phút;
- Từ 30 ÷ 45 phút; - Từ 45 ÷ 60 phút.
Nhận xét sự thay đổi tốc độ trung bình theo thời gian.
Lời giải:
a) Đồ thị mô tả sự phụ thuộc của thể tích khí oxygen theo thời gian
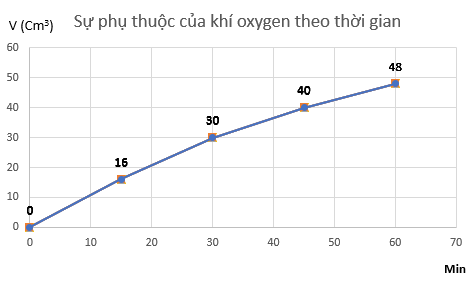
b) Tốc độ trung bình của phản ứng từ 0 ÷ 15 phút là:
vtb=16−015−0=1,07 cm3/min
Tốc độ trung bình của phản ứng từ 15 ÷ 30 phút là:
vtb=30−1630−15=0,93 cm3/min
Tốc độ trung bình của phản ứng từ 30 ÷ 45 phút là:
vtb=40−3045−30=0,67 cm3/min
Tốc độ trung bình của phản ứng từ 45 ÷ 60 phút là:
vtb=48−4060−45=0,53 cm3/min
⇒ Tốc độ trung bình giảm dần theo thời gian.
Lời giải:
Chuẩn bị:
- Zn dạng hạt
- Quỳ tím
- Sulfuric acid loãng 0,1M
- 2 ống nghiệm
- 1 Đèn cồn
- 1 kẹp gỗ
Tiến hành:
- Cho vào 2 ống nghiệm mỗi ống khoảng 5 mL sulfuric acid loãng 0,1M.
- Cho vào mỗi ống nghiệm mẩu quỳ tím và cho vào mỗi ống 2 gam Zn.
- Đun nóng 1 ống nghiệm.
Hiện tượng:
- Ban đầu, khi cho quỳ tím vào 2 ống nghiệm thì quỳ tím chuyển sang màu đỏ.
- Ống nghiệm bị đun nóng khí thoát ra nhanh hơn, quỳ tím nhạt màu nhanh chóng.
Phương trình hóa học:
Zn + 2HCl ⟶ ZnCl2 + H2↑
Kết luận: Khi tăng nhiệt độ thì tốc độ phản ứng tăng.
Cách 2: Tiến hành thí nghiệm trong bình phản ứng ở hai nhiệt độ khác nhau. Một bình ở nhiệt độ phòng, một bình được ngâm trong nước nóng.
Thiết kế thí nghiệm để đo tốc độ thoát khí như Hình a:
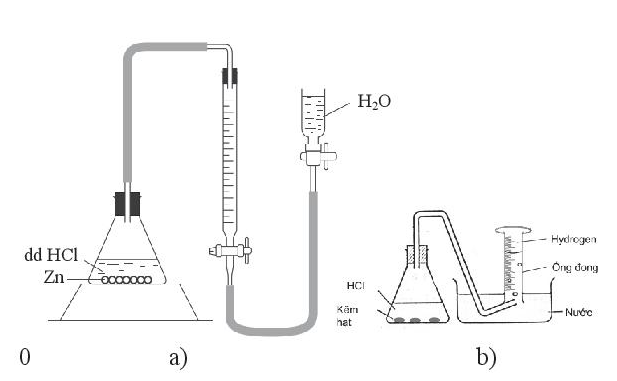
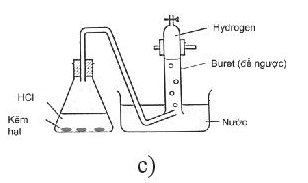
Thí nghiệm thứ 2 thiết kế tương tự nhưng bình phản ứng được ngâm trong nước nóng (có thể dùng bể điều nhiệt) (Hình b, c).
Các bước đo thể tích khí hydrogen thoát ra theo thời gian như sau:
Bước 1: Lắp bộ dụng cụ như Hình 20.1a. Cho nước vào bình chứa (chú ý không cho quá đầy), nước sẽ chuyển sang buret.
Bước 2. Cho khoảng 0,2g kẽm hạt vào bình tam giác.
Bước 3.
- Rót dung dịch HCl vào bình tam giác rồi đậy nút có ống thông với buret.
- Bắt đầu bấm giờ và đọc ngay giá trị Vo (ứng với thời điểm ban đầu t = 0).
- Di chuyển bình chứa nước sao cho mực chất lỏng trong bình chứa và trong buret luôn bằng nhau. Cứ sau mỗi khoảng thời gian (ví dụ 30 giây) lại đọc thể tích khí trong buret (Vt). Ghi giá trị Vt tại các thời điểm khác nhau.
Lời giải:
γ = vT+10vT ⇒ v2v1=γT2−T110
⇔ 0,0680,017=245 − T210
⇒ T2 = 25oC
⇒ Vậy phải giảm xuống đến 25 oC thì tốc độ phản ứng là 0,017 mol/(L.min) .
Lý thuyết Ôn tập chương 6
I. Tốc độ phản ứng
Xét phản ứng hóa học dạng tổng quát: aA + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng:
vtb=−1a⋅ΔCAΔt=−1b⋅ΔCBΔt=1c⋅ΔCCΔt=1d⋅ΔCDΔt
Trong đó: DCA, DCB, DCC, DCD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian Dt.
Nếu phản ứng trên là một phản ứng đơn giản thì biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng: v=k⋅(CA)a⋅(CB)b.
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng
1. Nồng độ
Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng.
2. Áp suất
Đối với phản ứng có sự tham gia của chất khí, khi áp suất tăng, tốc độ phản ứng tăng.
3. Nhiệt độ
Khi nhiệt độ phản ứng tăng dẫn đến số va chạm hiệu quả giữa các chất phản ứng tăng, làm tốc độ phản ứng tăng.
4. Diện tích bề mặt tiếp xúc
Để tăng tốc độ phản ứng, ta có thể tăng diện tích bề mặt tiếp xúc của chất phản ứng bằng cách làm giảm kích thước hạt rắn hoặc tạo những hạt xốp.
5. Chất xúc tác
Chất xúc tác làm tăng tốc độ phản ứng nhưng nó không bị biến đổi về lượng và chất sau phản ứng.
Ví dụ: Cho khoảng 2 g zinc (kẽm) dạng hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây (các điều kiện khác giữ nguyên) thì tốc độ phản ứng sẽ thay đổi thế nào (tăng lên, giảm xuống hay không đổi)?
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
(b) Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 1M có cùng thể tích.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
Hướng dẫn giải:
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
→Làm tăng diện tích bề mặt tiếp xúc của chất phản ứng, do đó làm tăng tốc độ phản ứng.
(b) Thay dung dịch H2SO4 2M bằng dung dịch H2SO4 1M có cùng thể tích.
→Nồng độ H2SO4 giảm, do đó làm giảm tốc độ phản ứng.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
→Khi nhiệt độ phản ứng tăng dẫn đến số va chạm hiệu quả giữa các chất phản ứng tăng, làm tốc độ phản ứng tăng.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 22: Hydrogen halide. Muối halide
Bài 1: Thành phần của nguyên tử
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
