Giải Hóa 10 Bài 9 (Kết nối tri thức): Ôn tập chương 2
Với giải bài tập Hóa 10 Bài 9: Ôn tập chương 2 sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 9.
Giải bài tập Hóa lớp 10 Bài 9: Ôn tập chương 2
I. Hệ thống hóa kiến thức
Hệ thống hóa kiến thức trang 45 Hóa học 10:
1. Cấu tạo bảng tuần hoàn
a) Điền các cụm từ “số lớp electron”; “điện tích hạt nhân” và “số electron hóa trị” vào chỗ trống thích hợp trong các mệnh đề sau theo đúng các nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn.
- …?... tăng dần.
- Cùng …? … ⇒ cùng chu kì (hàng).
- Cùng …?... ⇒ cùng nhóm (cột).
b) Trong bảng tuần hoàn (đến năm 2016) có bao nhiêu nguyên tố, bao nhiêu chu kì, bao nhiêu nhóm?
Lời giải:
a)
- Điện tích hạt nhân tăng dần.
- Cùng số lớp electron ⇒ cùng chu kì (hàng).
- Cùng số electron hóa trị ⇒ cùng nhóm (cột).
b) Trong bảng tuần hoàn hiện nay có 118 nguyên tố, 7 chu kì, 18 cột (8 cột nhóm A và 10 cột nhóm B) chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi nhóm là 1 cột, riêng nhóm VIIIB gồm 3 cột.
2. Xu hướng biến đổi trong bảng tuần hoàn
Điền các đại lượng và tính chất dưới đây vào bên trong các mũi tên (theo chiều tăng dần) để thấy xu hướng biến đổi của các đại lượng và tính chất đó.
- Bán kính nguyên tử
- Giá trị độ âm điện
- Tính kim loại
- Tính phi kim
- Tính acid – base của các oxide và hydroxide
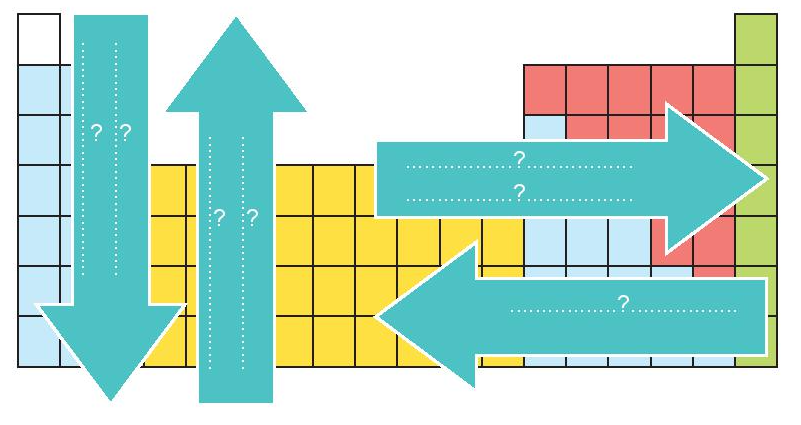
Lời giải:
3. Bảng tuần hoàn và cấu tạo nguyên tử
Điền các cụm từ “số proton”; “số lớp electron”; “số Z”; “số thứ tự nhóm A”; “số electron”; “số thứ tự chu kì”; “số hiệu nguyên tử”; “số electron lớp ngoài cùng” thích hợp thay cho các số sau đây để cho thấy ý nghĩa của bảng tuần hoàn các nguyên tố hóa học.
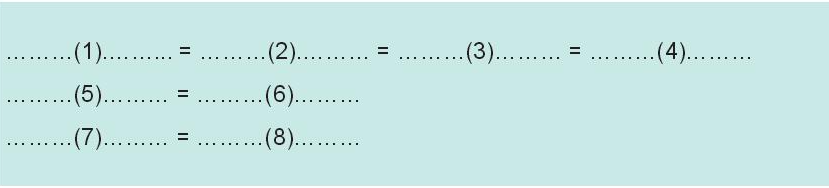
Lời giải:
(1) Số Z = (2) số proton = (3) số electron = (4) số hiệu nguyên tử
(5) Số lớp electron = (6) số thứ tự chu kì
(7) Số electron lớp ngoài cùng = (8) số thứ tự nhóm A
4. Định luật tuần hoàn
Chọn từ hoặc cụm từ thích hợp để hoàn thành nội dung của định luật tuần hoàn:
Tính chất của các …?... và đơn chất cũng như thành phần và …?... của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của …?... nguyên tử.
Lời giải:
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
II. Luyện tập
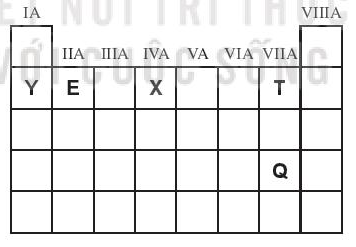
(1) Thứ tự giảm dần tính kim loại là Y, E, X.
(2) Thứ tự tăng dần độ âm điện là Y, X, T.
(3) Thứ tự tăng dần tính phi kim là T, Q.
(4) Thứ tự giảm dần bán kính nguyên tử Y, E, X, T.
Lời giải:
Đáp án đúng là: C
(1) Đúng vì trong một chu kì tính kim loại giảm theo chiều tăng của điện tích hạt nhân nguyên tử.
⇒ Tính kim loại: Y > E > X > T
(2) Đúng vì trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử độ âm điện tăng dần
⇒ Thứ tự tăng dần độ âm điện là Y < X < T.
(3) Sai vì trong một nhóm A tính phi kim giảm dần theo chiều tăng của điện tích hạt nhân nguyên tử.
⇒ Thứ tự tăng dần tính phi kim là Q < T
(4) Đúng vì trong 1 chu kì bán kính nguyên tử giảm dần theo chiều tăng của điện tích hạt nhân nguyên tử.
⇒ Thứ tự giảm dần bán kính nguyên tử là Y > E > X > T.
(1) Nguyên tử S có 3 lớp electron và có 10 electron p.
(2) Nguyên tử S có 5 electron hóa trị và 6 electron s.
(3) Công thức oxide cao nhất của S có dạng là SO3 và là acidic oxide.
(4) Nguyên tố S có tính phi kim mạnh hơn so với nguyên tố có số hiệu nguyên tử là 8.
(5) Hydroxide cao nhất của S có dạng H2SO4 và có tính acid.
Lời giải:
Đáp án đúng là: B
- Sulfur (S) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn.
⇒ Nguyên tử S có 3 lớp electron và có 6 electron lớp ngoài cùng.
⇒ Cấu hình electron của nguyên tử S là 1s22s22p63s23p4.
⇒ Nguyên tử S có 6 electron hóa trị, 6 electron s, 10 electron p
⇒ (1) đúng, (2) sai.
- Oxide cao nhất có dạng SO3 và là acidic oxide ⇒ (3) đúng
- Nguyên tố S (Z = 16) và nguyên tố có số hiệu nguyên tử Z = 8 thuộc cùng một nhóm A. Nguyên tố S có tính phi kim yếu hơn nguyên tố có số hiệu nguyên tử là 8 vì trong một nhóm A theo chiều tăng dần điện tích hạt nhân thì tính phi kim giảm dần.
⇒ (4) sai
- Hydroxide cao nhất của S có dạng H2SO4 và có tính acid mạnh.
⇒ (5) đúng
(1) X và Y thuộc 2 nhóm A kế tiếp nhau.
(2) X là kim loại. Y là phi kim.
(3) XO là basic oxide và YO3 là acidic oxide.
(4) Hydroxide cao nhất của Y có dạng Y(OH)6 và có tính base
Lời giải:
Đáp án đúng là: A
- Oxide cao nhất của X và Y có dạng là XO và YO3 cho ta biết:
+ X thuộc nhóm IIA, Y thuộc nhóm VIA ⇒ (1) sai
+ X là kim loại, Y là phi kim ⇒ (2) đúng
+ XO là basic oxide và YO3 là acidic oxide ⇒ (3) đúng.
+ Hydroxide cao nhất của Y có dạng H2XO4 và có tính acid ⇒ (4) sai.
⇒ Có 2 phát biểu đúng.
b) Sắp xếp các nguyên tố trên (trừ H) theo chiều bán kính nguyên tử tăng dần và giải thích.
c) Sắp xếp các nguyên tố trên (trừ H) theo chiều độ âm điện giảm dần và giải thích.
Lời giải:
a) Từ công thức của borax là Na2B4O7.10H2O ta xác định được thành phần của borax gồm các nguyên tố sau: Na, B, O, H.
Dựa vào bảng tuần hoàn ta xác định được:
+ Nguyên tố Na (Z =11) nằm ở ô 11, chu kì 3, nhóm IA.
Cấu hình electron của nguyên tử Na là 1s22s22p63s1.
+ Nguyên tố B (Z = 5) nằm ở ô 5, chu kì 2, nhóm IIIA.
Cấu hình electron của nguyên tử B là 1s22s22p1.
+ Nguyên tố O (Z = 8) nằm ở ô 8, chu kì 2, nhóm VIA.
Cấu hình electron của nguyên tử O là 1s2 2s2 2p4.
b)
– Xét nhóm IA, bán kính nguyên tử tăng dần theo chiều tăng của điện tích hạt nhân.
⇒ Bán kính nguyên tử: Li < Na (1)
- Xét chu kì 2, bán kính nguyên tử giảm dần theo chiều tăng của điện tích hạt nhân
⇒ Bán kính nguyên tử: Li > B > O. (2)
Từ (1) và (2) ⇒ Chiều bán kính tăng dần: O < B < Na
c)
- Xét nhóm IA độ âm điện giảm dần theo chiều tăng của điện tích hạt nhân.
⇒ Độ âm điện: Na < Li (3)
- Xét chu kì 2 độ âm điện tăng dần theo chiều tăng của điện tích hạt nhân.
⇒ Độ âm điện: Li < B < O (4)
Từ (3) và (4) ⇒ Chiều độ âm điện giảm dần là: O > H > B > Na
a) Nêu vị trí của các nguyên tố tạo nên cafein trong bảng tuần hoàn.
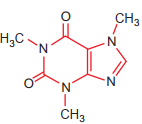
Lời giải:
a) Từ công thức cấu tạo của cafein, xác định được các nguyên tố tạo nên cafein là C, N, O, H.
+ Nguyên tố C thuộc ô thứ 6, chu kì 2, nhóm IVA.
+ Nguyên tố N thuộc ô thứ 7, chu kì 2, nhóm VA.
+ Nguyên tố O thuộc ô thứ 8, chu kì 2, nhóm VIA.
+ Nguyên tố H thuộc ô thứ 1, chu kì 1, nhóm IA.
b) Các nguyên tố C, N, O cùng thuộc chu kì 2 nên:
- Tính phi kim tăng dần theo chiều tăng của điện tích hạt nhân.
⇒ Tính phi kim tăng dần C < N < O
- Bán kính nguyên tử giảm theo chiều tăng của điện tích hạt nhân.
⇒ Bán kính nguyên tử giảm C > N > O
- Độ âm điện tăng dần theo chiều tăng của điện tích hạt nhân.
⇒ Độ âm điện tăng dần C < N < O
a) Viết cấu hình electron, từ đó xác định vị trí của hai nguyên tố A và B trong bảng tuần hoàn.
b) So sánh tính chất hóa học của A với B và giải thích.
Lời giải:
a) Gọi số đơn vị điện tích hạt nhân của nguyên tố A là Z.
Hai nguyên tố A, B đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn nên số đơn vị điện tích hạt nhân của nguyên tố B là Z + 1.
Theo bài ra: Z + (Z + 1) = 25 ⇒ Z = 12
⇒ Cấu hình electron của A (Z = 12) là 1s22s22p63s2.
Cấu hình electron của B (Z = 13) là 1s22s22p63s23p1.
⇒ Nguyên tố A (Mg) thuộc ô số 12, chu kì 3, nhóm IIA.
Nguyên tố B (Al) thuộc ô số 13, chu kì 3, nhóm IIIA.
b) Nguyên tử A có 2 electron lớp ngoài cùng nên A là kim loại.
Nguyên tử B có 3 electron lớp ngoài cùng nên B là kim loại.
Nguyên tố B kế tiếp nguyên tố A trong một chu kì nên tính kim loại giảm dần theo chiều tăng của điện tích hạt nhân
⇒ Tính kim loại: A > B.
Lý thuyết Ôn tập chương 2
I. Hệ thống hóa kiến thức
1. Cấu tạo bảng tuần hoàn
a) Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
- Điện tích hạt nhân tăng dần.
- Cùng số lớp electron → cùng chu kì (hàng).
- Cùng số electron hóa trị → cùng nhóm (cột).
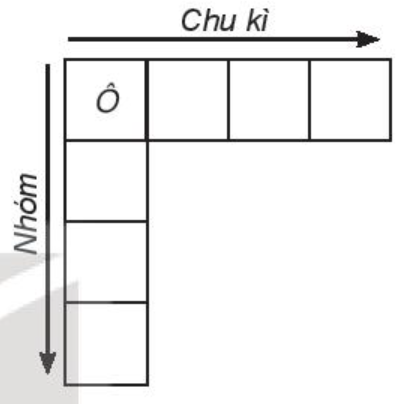
b) Trong bảng tuần hoàn (đến năm 2016) có 118 nguyên tố, 7 chu kì và 18 nhóm.
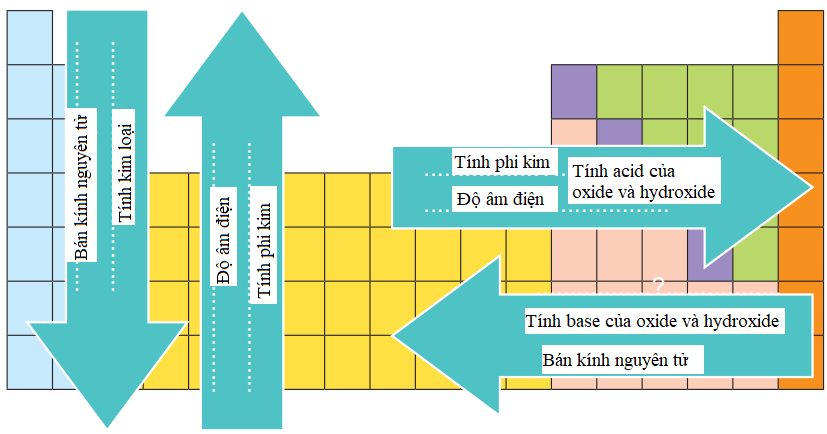
2. Xu hướng biến đổi trong bảng tuần hoàn
a) Bán kính nguyên tử
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
b) Giá trị độ âm điện
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
c) Tính kim loại, tính phi kim
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
d) Tính acid – base của các oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
3. Bảng tuần hoàn và cấu tạo nguyên tử
Nhận xét:
Số proton = số electron = số hiệu nguyên tử = số Z
Số thứ tự chu kì = số lớp electron
Số thứ tự nhóm A = số electron lớp ngoài cùng
4. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
5. Ví dụ luyện tập
Ví dụ 1. Cho các nguyên tố X (Z = 11), Y (Z = 13), T (Z = 14), Q (Z = 19).
a) So sánh tính kim loại
b) So sánh bán kính nguyên tử
Hướng dẫn giải:
X (Z = 11): 1s22s22p63s1 → X thuộc chu kì 3, nhóm IA.
Y (Z = 13): 1s22s22p63s23p1 → Y thuộc chu kì 3, nhóm IIIA.
T (Z = 14): 1s22s22p63s23p2 → T thuộc chu kì 3, nhóm IVA.
Q (Z = 19): 1s22s22p63s23p64s1 → Q thuộc chu kì 4, nhóm IA.
a) So sánh tính kim loại.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
→ Tính kim loại: X > Y > T.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
→ Tính kim loại: X < Q.
Vậy, tính kim loại: Q > X > Y > T.
b) So sánh bán kính nguyên tử
Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
→ Bán kính nguyên tử: X > Y > T.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
→ Bán kính nguyên tử: X < Q.
Vậy, bán kính nguyên tử: Q > X > Y > T.
Ví dụ 2. Sulfur (S) là nguyên tố thuộc nhóm VIA, chu kì 3 của bảng tuần hoàn.
a) Viết cấu hình electron của nguyên tử S.
b) Xác định số proton, electron của nguyên tử S.
c) Viết công thức oxide cao nhất và hydroxide cao nhất của S.
Hướng dẫn giải:
a)
Số thứ tự chu kì = số lớp electron = 3.
Số thứ tự nhóm A = số electron lớp ngoài cùng = 6.
→ Cấu hình electron của nguyên tử S: 1s22s22p63s23p4.
b) Số proton = số electron = Z = 16.
c) S thuộc nhóm VIA →Hóa trị cao nhất của S là VI.
Công thức oxide cao nhất của S là SO3 (acidic oxide).
Công thức hydroxide cao nhất là H2SO4 (có tính acid).
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 13: Liên kết hydrogen và tương tác Van der waals
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức