Giải Hóa 10 Bài 6 (Kết nối tri thức): Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Với giải bài tập Hóa 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 6.
Giải bài tập Hóa lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Video giải bài tập Hóa lớp 10 Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm
Lời giải:
- Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì bán kính nguyên tử giảm theo chiều tăng của điện tích hạt nhân do lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
+ Trong một nhóm, bán kính nguyên tử tăng theo chiều tăng của điện tích hạt nhân do lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
- Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng của điện tích hạt nhân độ âm điện tăng. Do khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng thì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng.
- Trong một nhóm A, theo chiều tăng của điện tích hạt nhân độ âm điện giảm. Do khi số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm.
- Xu hướng biến đổi tính kim loại và tính phi kim:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần. Do bán kính nguyên tử giảm, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng, dẫn đến khả năng nhường electron giảm nên tính kim loại giảm, khả năng nhận electron tăng nên tính phi kim tăng.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần. Tuy điện tích hạt nhân tăng, nhưng bán kính nguyên tử tăng nhanh chiếm ưu thế hơn nên lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm dần đến khả năng nhường electron tăng. Do đó tính kim loại tăng, khả năng nhận electron giảm nên tính phi kim giảm.
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
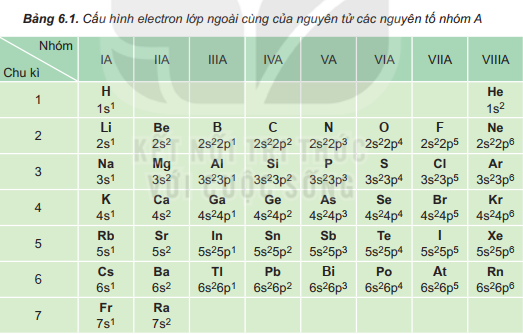
Lời giải:
|
Nguyên tử |
Li |
Al |
Ar |
Ca |
Si |
Se |
P |
Br |
|
Số electron lớp ngoài cùng |
1 |
3 |
8 |
2 |
4 |
6 |
5 |
7 |
Lời giải:
Dựa vào bảng tuần hoàn ta xác định được:
|
|
Ô |
Chu kì |
Nhóm |
Số electron hóa trị |
|
Z = 8 |
8 |
2 |
VIA |
6 |
|
Z = 11 |
11 |
3 |
IA |
1 |
|
Z = 17 |
17 |
3 |
VIIA |
7 |
|
Z = 20 |
20 |
4 |
IIA |
2 |
II. Bán kính nguyên tử
a) lithium (Z = 3) và potassium (Z = 19).
b) calcium (Z = 20) và selenium (Z = 34).
Lời giải:
a) Lithium (Li) và potassium (K) cùng thuộc nhóm IA trong bảng tuần hoàn. Trong một nhóm A theo chiều tăng điện tích hạt nhân bán kính nguyên tử tăng
⇒ Bán kính nguyên tử: Li < K
Giải thích:
Trong một nhóm A, theo chiều tăng điện tích hạt nhân, số lớp electron tăng ⇒ lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm dẫn đến bán kính nguyên tử tăng.
b) Calcium (Ca) và selenium (Se) cùng thuộc chu kì 4 trong bảng tuần hoàn. Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
⇒ Bán kính nguyên tử: Ca > Se
Giải thích:
Trong một chu kì, theo chiều tăng điện tích hạt nhân số electron lớp ngoài cùng tăng
⇒ Lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng dẫn đến bán kính nguyên tử giảm.
III. Độ âm điện
Lời giải:
- Ca (Z = 20) và Mg (Z = 12) cùng thuộc nhóm IIA.
Mà trong một nhóm A, khi số lớp electron tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm
⇒ Độ âm điện: Mg > Ca (1)
- Mg (Z = 12), P (Z = 15) và S (Z = 16) cùng thuộc chu kì 3.
Mà trong một chu kì, khi số electron lớp ngoài cùng tăng, điện tích hạt nhân tăng thì lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng nên độ âm điện tăng.
⇒ Độ âm điện: Mg < P < S (2)
Từ (1) và (2) ⇒ Dãy các nguyên tố được sắp xếp theo thứ tự độ âm điện tăng dần là Ca < Mg < P < S.
a) Sắp xếp theo thứ tự tăng dần về bán kính nguyên tử của các nguyên tố hóa học trong almelec.
b) Cho biết thứ tự giảm dần về độ âm điện của các nguyên tố hóa học có trong almelec.
Lời giải:
a) Trong almelec gồm các nguyên tố: Al (Z = 13), Mg (Z = 12), Si (Z = 14)
Ta thấy ba nguyên tố này cùng thuộc chu kì 2 trong bảng tuần hoàn
Mà trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
⇒ Bán kính nguyên tử tăng dần theo thứ tự: Si < Al < Mg
b) Trong một chu kì, theo chiều tăng của điện tích hạt nhân độ âm điện tăng.
⇒ Độ âm điện giảm dần theo thứ tự: Si > Al > Mg
IV. Tính kim loại và tính phi kim
Hoạt động 1 trang 38 Hóa học 10: So sánh tính kim loại của sodium và magnesium
Chuẩn bị: kim loại Na; Mg; dung dịch phenolphthalein; nước; cốc thủy tinh.
- Cho một mẩu nhỏ Na vào cốc (1), một dây Mg vào cốc (2).
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Viết phương trình hóa học của các phản ứng.
2. So sánh mức độ phản ứng của sodium và magnesium với nước.
Lời giải:
1. Phương trình hóa học của các phản ứng:
2Na + 2H2O ⟶ 2NaOH + H2↑
Mg gần như không phản ứng. Không thấy hiện tượng gì.
2. Sodium phản ứng mãnh liệt với nước.
Magnesium gần như không phản ứng với nước ở nhiệt độ thường.
Hoạt động 2 trang 38 Hóa học 10: So sánh tính kim phi của chlorine và iodine
Chuẩn bị: Hình ảnh hoặc video phản ứng của nước của chlorine với dung dịch potassium iodide (∗).
Câu hỏi: So sánh tính phi kim của chlorine và iodine.

Lời giải:
Hiện tượng: Nước chlorine phản ứng với dung dịch potassium iodide tạo dung dịch có màu nâu (do một phần iodine tan trong nước tạo dung dịch màu nâu). Một phần iodine màu đen tím rắn lắng xuống đáy ống nghiệm
Phương trình hóa học: Cl2 + 2KI → 2KCl + I2
Từ thí nghiệm trên ta thấy chlorine có tính phi kim mạnh hơn iodine nên đã đẩy iodine ra khỏi muối.
Kết luận: Chlorine có tính phi kim mạnh hơn iodine.
Lời giải:
Dựa vào bảng tuần hoàn ta thấy Ba (Z = 56), Mg (Z = 12), Ca (Z = 20), Sr (Z = 38) đều cùng thuộc nhóm IIA.
Mà trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần.
⇒ Sắp xếp theo chiều giảm dần tính kim loại: Ba > Sr > Ca > Mg
Lời giải:
Đáp án đúng là: B
Dựa vào bảng tuần hoàn ta có: O (Z = 8) và Se (Z = 34) cùng thuộc nhóm VIA
⇒ Tính phi kim O > Se (1)
F (Z = 9) và Cl (Z = 17) cùng thuộc nhóm VIIA
⇒ Tính phi kim F > Cl (2)
O (Z = 8) và F (Z = 9) cùng thuộc chu kì 2
⇒ Tính phi kim F > O (3)
Từ (1), (2), (3) ⇒ Tính phi kim: F > O > Se và F > Cl
Vậy tính phi kim của F là mạnh nhất.
Lý thuyết Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
I. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Nguyên tử các nguyên tố nhóm A (gồm các nguyên tố s và p) có số electron lớp ngoài cùng (electron hóa trị) bằng nhau (trừ He trong nhóm VIIIA). Sự giống nhau về số electron hóa trị dẫn đến sự tương tự nhau về tính chất hóa học của các nguyên tố trong cùng nhóm A.
Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn →là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
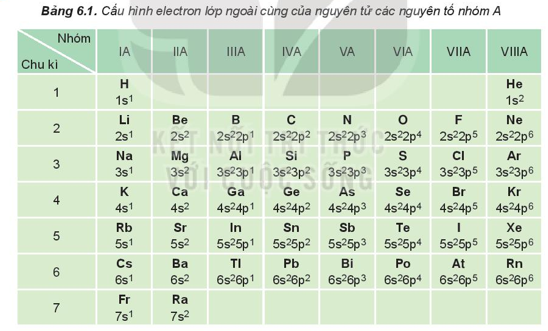
II. Bán kính nguyên tử.
Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng là do lực hút giảm.
Xu hướng biến đổi bán kính nguyên tử:
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
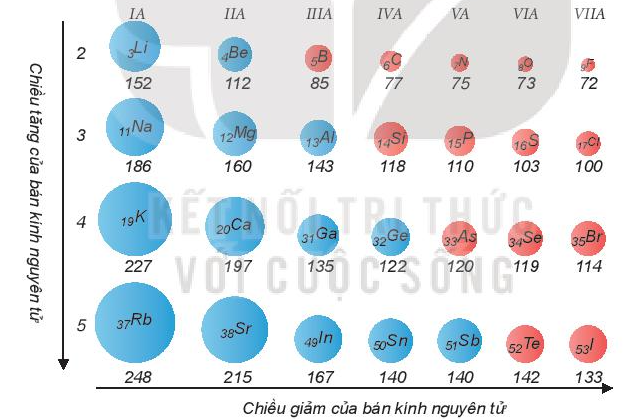 Ví dụ: So sánh bán kính nguyên tử của lithium (Z = 3) và potassium (Z = 19).
Ví dụ: So sánh bán kính nguyên tử của lithium (Z = 3) và potassium (Z = 19).
Hướng dẫn giải:
Cấu hình electron của nguyên tử:
Lithium (Z = 3): 1s22s1 → Lithium thuộc chu kì 2, nhóm IA.
Potassium (Z = 19): 1s22s22p63s23p64s1 → Potassium thuộc chu kì 4, nhóm IA.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
→Bán kính của nguyên tử lithium nhỏ hơn bán kính nguyên tử potassium.
III. Độ âm điện
Độ âm điện của nguyên tử (c) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
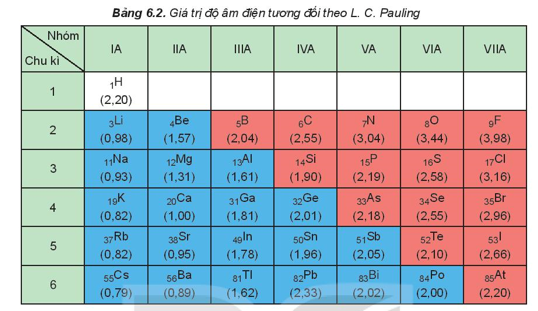
Ví dụ: Cho nguyên tử các nguyên tố: X (Z = 11); Y (Z = 13); T (Z = 17). So sánh độ âm điện của X, Y, T.
Hướng dẫn giải:
Cấu hình electron của nguyên tử các nguyên tố:
X (Z = 11): 1s22s22p63s1 → X nằm ở ô số 11, chu kì 3, nhóm IA.
Y (Z = 13): 1s22s22p63s23p1 →Y nằm ở ô số 13, chu kì 3, nhóm IIIA.
T (Z = 17): 1s22s22p63s23p5 →T nằm ở ô số 17, chu kì 3, nhóm VIIA.
→ X, Y, T đều thuộc chu kì 3.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
→ So sánh độ âm điện: X < Y < T.
IV. Tính kim loại và tính phi kim
1. Khái niệm
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương. Nguyên tử của nguyên tố nào càng dễ nhường electron để trở thành ion dương, tính kim loại của nguyên tố đó càng mạnh.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm. Nguyên tử của nguyên tố nào càng dễ nhận electron để trở thành ion âm, tính phi kim của nguyên tố đó càng mạnh.
2. Sự biến đổi tính kim loại, tính phi kim
Xu hướng biến đổi tính kim loại và tính phi kim:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
Ví dụ 1:

Ví dụ 2: Cho nguyên tử các nguyên tố X (Z = 9), Y (Z = 15), T (Z = 17). So sánh tính phi kim của X, Y, T.
Hướng dẫn giải:
Cấu hình electron nguyên tử:
X (Z = 9): 1s22s22p5 →X thuộc chu kì 2, nhóm VIIA.
Y (Z = 15): 1s22s22p63s23p3 → Y thuộc chu kì 3, nhóm VA.
T (Z = 17): 1s22s22p63s23p5 →T thuộc chu kì 3, nhóm VIIA.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng tăng dần.
→ Tính phi kim: Y < T (Y, T cùng thuộc chu kì 3).
Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng giảm dần.
→Tính phi kim: X > T (X, T cùng thuộc nhóm VIIA).
Vậy: Tính phi kim tăng dần là Y < T < X.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Bài 8: Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Lý thuyết Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
