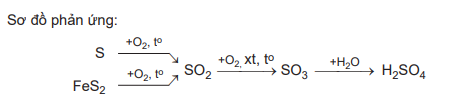Giải Hóa 10 Bài 15 (Kết nối tri thức): Phản ứng oxi hóa – khử
Với giải bài tập Hóa 10 Bài 15: Phản ứng oxi hóa – khử sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 15.
Giải bài tập Hóa lớp 10 Bài 15: Phản ứng oxi hóa – khử
Mở đầu trang 71 Hóa học 10: Trong là luyện gang, xảy ra phản ứng oxi hoá – khử theo sơ đồ sau:
Lời giải:
- Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình nhường và quá trình nhận electron.
- Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
- Để lập phương trình hóa học của phản ứng oxi hóa – khử, ta áp dụng phương pháp thăng bằng electron. Nguyên tắc của phương pháp như sau:
“Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận”
Phản ứng oxi hóa – khử: Fe2O3 + 3CO to→ 2Fe + 3CO2
Có sự thay đổi số oxi hóa của các chất như sau: +3Fe2O3 + 3+2CO →t°
I. Số oxi hóa
Câu hỏi 1 trang 73 Hóa học 10: Xác định số oxi hóa của nguyên tử Fe và S trong các chất sau:
a) Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4.
b) S, H2S, SO2, SO3, H2SO4, Na2SO3.
Lời giải:
a)
- Số oxi hóa của Fe đơn chất là 0
- Trong hợp chất
Tổng số oxi hóa = x.1 + (-2).1 = 0 ⇒ x = +2
Vậy số oxi hóa của Fe trong hợp chất FeO là +2
- Trong hợp chất
Tổng số oxi hóa = x.2 + (-2).3 = 0 ⇒ x = +3
Vậy số oxi hóa của Fe trong hợp chất Fe2O3 là +3
- Trong hợp chất
Tổng số oxi hóa = x.1 + (-2).2 + (+1).2 = 0 ⇒ x = +2
Vậy số oxi hóa của Fe trong hợp chất Fe(OH)2 là +2
- Trong hợp chất
Tổng số oxi hóa = x.3 + (-2).4 = 0 ⇒ x =
Vậy số oxi hóa của Fe trong hợp chất Fe3O4 là
b)
- Số oxi hóa của đơn chất S là 0
- Trong hợp chất
Tổng số oxi hóa = (+1).2 + x = 0 ⇒ x = -2
Vậy số oxi hóa của S trong hợp chất H2S là -2
- Trong hợp chất
Tổng số oxi hóa = x.1 + (-2).2 = 0 ⇒ x = +4
Vậy số oxi hóa của S trong hợp chất SO2 là +4
- Trong hợp chất
Tổng số oxi hóa = x.1 + (-2).3 = 0 ⇒ x = +6
Vậy số oxi hóa của S trong hợp chất SO3 là +6
- Trong hợp chất
Tổng số oxi hóa = (+1).2 + x.1 + (-2).4 = 0 ⇒ x = +6
Vậy số oxi hóa của S trong hợp chất H2SO4 là +6
- Trong hợp chất
Tổng số oxi hóa = (+1).2 + x.1 + (-2).3 = 0 ⇒ x = +4
Vậy số oxi hóa của S trong hợp chất Na2SO3 là +4
II. Chất oxi hóa, chất khử, phản ứng oxi hóa – khử
Hoạt động trang 73 Hóa học 10: Xác định chất oxi hoá, chất khử
Chuẩn bị: đinh sắt, dung dịch CuSO4, dung dịch H2SO4 loãng, ống nghiệm.
Thí nghiệm 1: Cho đinh sắt vào ống nghiệm đựng dung dịch CuSO4.
Thí nghiệm 2: Cho đinh sắt vào ống nghiệm đựng dung dịch H2SO4.
Quan sát hiện tượng và thực hiện yêu cầu sau:
1. Viết quá trình oxi hoá, quá trình khử.
2. Xác định chất oxi hoá, chất khử trong hai phản ứng trên.
Lời giải:
1. Viết quá trình oxi hoá, quá trình khử.
Thí nghiệm 1: Cho đinh sắt vào ống nghiệm đựng dung dịch CuSO4.
Quá trình oxi hóa:
Quá trình khử:
Thí nghiệm 2: Cho đinh sắt vào ống nghiệm đựng dung dịch H2SO4.
Quá trình oxi hóa:
Quá trình khử:
2. Xác định chất oxi hoá, chất khử trong hai phản ứng trên.
Thí nghiệm 1: Chất khử là Fe, chất oxi hóa là CuSO4.
Thí nghiệm 2: Chất khử là Fe, chất oxi hóa là H2SO4.
a) Hãy xác định các nguyên tử có sự thay đổi số oxi hoá.
b) Viết quá trình oxi hoá, quá trình khử.
c) Dùng mũi tên biểu diễn sự chuyển electron từ chất khử sang chất oxi hóa.
Lời giải:
a) Số oxi hóa của Fe tăng từ +2 lên +3.
Số oxi hóa của O (O2) giảm từ 0 xuống -2.
b) Quá trình oxi hóa:
Quá trình khử:
c)
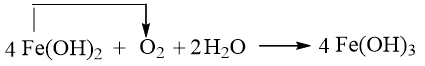
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
Câu hỏi 3 trang 75 Hóa học 10: Xét các phản ứng hóa học xảy ra trong công nghiệp:
Lời giải:
Phản ứng a) không là phản ứng oxi hóa – khử do không có sự thay đổi số oxi hóa của các nguyên tử.
Phản ứng b) là phản ứng oxi hóa – khử do có sự thay đổi số oxi hóa của các nguyên tử.
Đối với phản ứng b) C + CO2 CO
Bước 1:
Chất khử là C, chất oxi hóa là CO2.
Bước 2: Các quá trình oxi hóa, quá trình khử
Bước 3: Xác định hệ số
Bước 4: Cân bằng
C + CO2 2CO
IV. Phản ứng oxi hoá – khử trong thực tiễn
Câu hỏi 4 trang 76 Hóa học 10: Nêu một số phản ứng oxi hoá – khử có lợi và có hại trong thực tế.
Lời giải:
Một số phản ứng oxi hóa – khử có lợi trong thực tế:
- Phản ứng đốt cháy nhiên liệu (than đá, khí thiên nhiên, xăng, dầu, …) cung cấp năng lượng dưới dạng nhiệt dùng để đun nấu, sưởi ấm, chạy động cơ.
- Sản xuất hóa chất trong công nghiệp, ví dụ sản xuất sulfuric acid từ quặng pyrite.
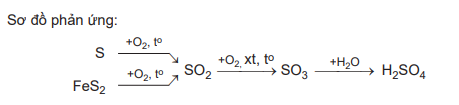
- Phản ứng chuyển hóa các chất trong tự nhiên như chuổi phản ứng:
N2 + O2 2NO
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3
HNO3 tan vào nước mưa và chuyển hóa thành gốc nitrate (NO3-), cung cấp chất đạm cho cây lúa. Nhờ quá trình trên, hàng năm một lượng lớn phân đạm tự nhiên được bổ sung cho đất.
Một số phản ứng oxi hóa – khử có hại trong thực tế:
- Sự han gỉ kim loại.
Trong không khí ẩm, các vật dụng bằng thép vị oxi hóa tạo gỉ sắt.
4Fe + 3O2 + xH2O → 2Fe2O3.xH2O
- Mưa axit ăn mòn các công trình xây dựng, tượng đài …
Lời giải:
1) S + O2 SO2
2) 4FeS2 + 11O2 2Fe2O3 + 8SO2
3) 2SO2 + O2 2SO3
4) SO3 + H2O ⟶ H2SO4
Trong các phản ứng trên, phản ứng (1), (2), (3) là phản ứng oxi hóa khử do có sự thay đổi số oxi hóa của các nguyên tử.
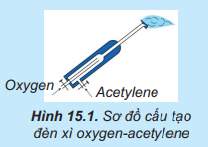
Lời giải:
Phương trình hóa học của phản ứng:
⇒ Chất oxi hóa là O2, chất khử là C2H2.
⇒ 2C2H2 + 5O2 4CO2 + 2H2O
Khí CO2 đi lên phía trên, gặp các lớp than cốc và bị khử thành CO:
Tiếp đó, khí CO khử Fe2O3 thành Fe theo sơ đồ phản ứng tổng quát:
Lập các phương trình hóa học ở trên, chỉ rõ chất oxi hóa, chất khử.
Lời giải:
- Lập phương trình: C + O2 CO2
⇒ Chất khử là C, chất oxi hóa là O2.
⇒ C + O2 CO2
- Lập phương trình: CO2 + C CO
⇒ Chất khử là C, chất oxi hóa là CO2.
⇒ CO2 + C 2CO
- Lập phương trình: Fe2O3 + CO Fe + CO2
⇒ Chất khử là CO, chất oxi hóa là Fe2O3.
⇒ Fe2O3 + 3CO 2Fe + 3CO2
Lý thuyết Phản ứng oxi hóa - khử
I. Số oxi hóa
1. Khái niệm
Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
Số oxi hóa được viết ở dạng số đại số, dấu viết trước, số viết sau.
Ví dụ 1: Xét phân tử NaCl.
Nguyên tử Na nhường 1 electron cho nguyên tử Cl, khi đó nguyên tử Na trở thành ion dương mang điện tích 1+ (số oxi hóa của Na là +1) và nguyên tử Cl nhận 1 electron của nguyên tử Na trở thành ion âm mang điện tích 1– (số oxi hóa của Cl là –1): .
Ví dụ 2: Xét phân tử H2O.

Độ âm điện của nguyên tử O lớn hơn độ âm điện của nguyên tử H, nếu các cặp electron liên kết chuyển hoàn toàn về nguyên tử O thì nguyên tử O có thêm 2 electron và trở thành ion âm có điện tích 2– (số oxi hóa của O là –2); mỗi nguyên tử H mất đi 1 electron và trở thành ion dương có điện tích 1+ (số oxi hóa của H là +1): .
Ví dụ 3: Xét phân tử H2.
H : H
Do hai nguyên tử H giống nhau nên cặp electron liên kết không lệch về nguyên tử nào. Do vậy, mỗi nguyên tử H đều trung hòa điện, có điện tích bằng 0 và số oxi hóa là 0: .
2. Quy tắc xác định số oxi hóa
Thông thường, số oxi hóa của nguyên tử được xác định trực tiếp từ công thức phân tử theo các quy tắc sau:
Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
Ví dụ: .
Quy tắc 2: Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là – 2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.

Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ví dụ 1: Xác định số oxi hóa của S trong phân tử Na2SO4.
Hướng dẫn:
Trong hợp chất, số oxi hóa của Na là +1, số oxi hóa của O là –2.
Số oxi hóa của từng nguyên tử: .
Áp dụng quy tắc 3, ta có: (+1)×2 + x + (–2)×4 = 0 ® x = +6.
Ví dụ 2: Xác định số oxi hóa của C trong ion .
Hướng dẫn:
Số oxi hóa của O là – 2.
Gọi số oxi hóa của C trong ion đa nguyên tử là x.
Áp dụng quy tắc 4, ta có: x + (–2)×3 = –2 x = +4.
II. Chất oxi hóa, chất khử, phản ứng oxi hóa – khử
1. Chất oxi hóa, chất khử
Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
Ví dụ: Đưa mẩu than gỗ nóng đỏ vào bình đựng khí O2, mẩu than cháy sáng.
Trong phản ứng trên, nguyên tử C nhường 4 electron, là chất khử; phân tử O2 nhận 4 electron, là chất oxi hóa.
(quá trình oxi hóa)
(quá trình khử)
2. Phản ứng oxi hóa – khử
Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình quá trình nhường electron và quá trình nhận electron.
Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Ví dụ: Phản ứng nào sau đây là phản ứng oxi hóa – khử?
(a) CaCO3 CaO + CO2.
(b) BaCl2 + Na2SO4 BaSO4¯ + 2NaCl.
(c) 4Al + 3O2 2Al2O3.
Hướng dẫn giải:
(a) Không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của các nguyên tố.
(b) Không phải là phản ứng oxi hóa – khử vì không có sự thay đổi số oxi hóa của các nguyên tố.
(c) : có sự thay đổi số oxi hóa của nguyên tố Al, O Đây là phản ứng oxi hóa – khử.
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
Phương pháp thăng bằng electron đường dùng để lập phương trình hóa học của phản ứng oxi hóa – khử theo nguyên tắc: “Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận”.
Ví dụ: Cân bằng phương trình hóa học của phản ứng sau theo phương pháp thăng bằng electron: NH3 + O2NO + H2O.
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử:
NH3: chất khử; O2: chất oxi hóa.
Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
4NH3 + 5O2 4NO + 6H2O
III. Phản ứng oxi hóa – khử trong thực tiễn
1. Sự cháy
Phản ứng cháy là phản ứng oxi hóa – khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa. Chất cháy thường là nhiên liệu (than đá, khí thiên nhiên, xăng dầu, …), còn chất oxi hóa thường là oxygen.
Ví dụ: Phản ứng oxi hóa – khử xảy ra khi đốt cháy carbon trong than đá và butane trong khí gas:
C + O2 CO2
2C4H10 + 13O2 8CO2 + 10H2O
2. Sự han gỉ kim loại
Sau một thời gian sử dụng, nhiều thiết bị, máy móc, vật dụng bằng kim loại thường bị han gỉ, do sự oxi hóa bởi oxygen trong không khí.
Ví dụ: Trong không khí ẩm, các vật dụng bằng thép bị oxi hóa tạo gỉ sắt.
4Fe + 3O2 + xH2O 2Fe2O3.xH2O
3. Sản xuất hóa chất
Trong công nghiệp, phần lớn các phản ứng hóa học xảy ra trong các quy trình sản xuất là phản ứng oxi hóa – khử.
Ví dụ: Sulfuric acid là hóa chất quan trọng trong công nghiệp, được sản xuất chủ yếu từ sulfur hoặc quặng pyrite.
Sơ đồ phản ứng;
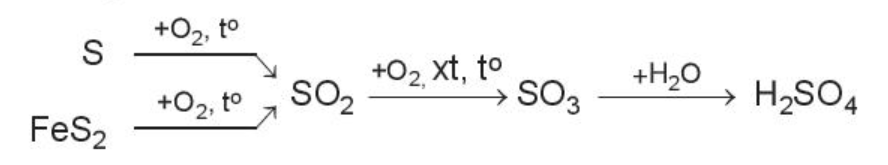
4. Chuyển hóa các chất trong tự nhiên
Trong tự nhiên cũng xảy ra rất nhiều quá trình kèm theo phản ứng oxi hóa – khử.
Ví dụ: Tia sét tạo tia lửa điện, là điều kiện cho nitrogen phản ứng với oxygen:
N2 + O2 2NO
Khí NO sinh ra nhanh chóng chuyển hóa thành NO2, sau đó tiếp tục bị oxi hóa thành HNO3:
2NO + O2 2NO2
4NO2 + O2 + 2H2O 4HNO3
Nitric acid tan vào nước mưa và chuyển hóa thành gốc nitrate () , cung cấp chất đạm cho cấy lúa. Nhờ quá trình trên, hàng năm một lượng lớn phân đạm tự nhiên được bổ sung cho đất.
5. Xác định nồng độ của một chất dựa vào phản ứng oxi hóa – khử
- Trong thực tế, dung dịch thuốc tím (KMnO4) được sử dụng phổ biến như một tác nhân oxi hóa mạnh để xác định hàm lượng các chất khử như iron(II); hydrogen peroxide, oxalic acid, …
Ví dụ: Trong quá trình bảo quản, một mẫu iron (II) sulfate bị oxi hóa một phần thành hợp chất iron (III). Hàm lượng iron (II) sulfate còn lại trong mẫu được xác định thông qua phản ứng với dung dịch thuốc tím có nồng độ đã biết:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức