Giải Hóa 10 Bài 2 (Kết nối tri thức): Nguyên tố hóa học
Với giải bài tập Hóa 10 Bài 2: Nguyên tố hóa học sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 2.
Giải bài tập Hóa lớp 10 Bài 2: Nguyên tố hóa học
Video giải bài tập Hóa lớp 10 Bài 2: Nguyên tố hóa học
Lời giải:
Các nguyên tử có cùng số đơn vị điện tích hạt nhân thuộc về cùng một nguyên tố hóa học.
Trong nguyên tử số đơn vị điện tích hạt nhân = số electron = số proton.
I. Nguyên tố hóa học
Lời giải:
L (Z = 8, A = 16) và E (Z = 8, A = 18) thuộc cùng một nguyên tố hóa học vì cùng có số đơn vị điện tích hạt nhân là 8.
II. Kí hiệu nguyên tử
Câu hỏi 2 trang 18 Hóa học 10: Kí hiệu một nguyên tử cho biết những thông tin gì? Cho ví dụ.
Lời giải:
Kí hiệu một nguyên tử cho biết:
- Kí hiệu nguyên tố
- Số khối (A)
- Số hiệu nguyên tử (Z)
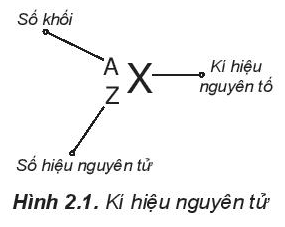
+ Từ số hiệu nguyên tử ta có thể biết được số proton, số electron nguyên tử.
Số hiệu nguyên tử (Z) = số proton = số electron.
+ Từ số khối (A) và số hiệu nguyên tử (Z) ta có thể biết được số neutron (N) theo công thức:
A = Z + N
Ví dụ: Từ kí hiệu hóa học của nguyên tử sodium là N2311a cho biết:
- Kí hiệu nguyên tố: Na
- Số khối: A = 23
- Số hiệu nguyên tử: Z = 11
+ Số hiệu nguyên tử = số proton = số electron = 11
+ Số neutron = A – Z = 23 – 11 = 12
Câu hỏi 3 trang 18 Hóa học 10: Hãy biểu diễn kí hiệu của một số nguyên tử sau:
a) Nitrogen (số proton = 7 và số neutron = 7).
b) Phosphorus (số proton = 15 và số neutron = 16).
c) Copper (đồng) (số proton = 29 và số neutron = 34).
Lời giải:
a) Nitrogen (số proton = 7 và số neutron = 7).
Số hiệu nguyên tử nitrogen = số proton = 7
Số khối của nguyên tử nitrogen A = Z + N = 7 + 7 = 14
Kí hiệu nguyên tử nitrogen: N147
b) Phosphorus (số proton = 15 và số neutron = 16).
Số hiệu nguyên tử phosphorus = số proton = 15
Số khối của nguyên tử phosphorus A = Z + N = 15 + 16 = 31
Kí hiệu nguyên tử phosphorus: P3115
c) Copper (số proton = 29 và số neutron = 34).
Số hiệu nguyên tử copper = số proton = 29
Số khối của nguyên tử copper A = Z + N = 29 + 34 = 63
Kí hiệu nguyên tử copper: C6329u
III. Đồng vị
b) F5426e, F5626e, F5726e, F5826e.
Lời giải:
Em cần nhớ: Trong nguyên tử:
+ Số hiệu nguyên tử Z = số proton = số electron.
+ A = Z + N
a)
|
|
S2814i |
S2914i |
S3014i |
|
Số proton |
14 |
14 |
14 |
|
Số electron |
14 |
14 |
14 |
|
Số neutron |
14 |
15 |
16 |
b)
|
|
F5426e |
F5626e |
F5726e |
F5826e |
|
Số proton |
26 |
26 |
26 |
26 |
|
Số electron |
26 |
26 |
26 |
26 |
|
Số neutron |
28 |
30 |
31 |
32 |
IV. Nguyên tử khối
Lời giải:
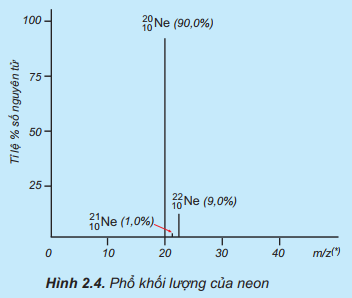
Nguyên tử khối trung bình của Ne là
ˉA=(1.21)+(9.22)+(90.20)100=20,19
Lời giải:
Chromium có 4 nguyên tử đồng vị trong tự nhiên đó là 50Cr; 52Cr; 53Crvà 54Cr với tỉ lệ phần trăm các đồng vị khác nhau.
⇒ Nguyên tử khối trung bình của chromium không phải là số nguyên mà là 51,996.
Lời giải:
Gọi phần trăm số nguyên tử của đồng vị C6329utồn tại trong tự nhiên là x %.
⇒ Phần trăm số nguyên tử của C6529ulà 100 – x (%)
Ta có: ˉA = 63.x+65.(100−x)100=63,546
⇒ x = 72,7%
Vậy phần trăm số nguyên tử của đồng vị C6329utồn tại trong tự nhiên là 72,7%
Lời giải:
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
Ví dụ: Trong tự nhiên, neon (Ne) có ba đồng vị bền là N2110e (1,0%), N2010e (90,0%), N2210e (9,0%)
Ta xác định được:
- Mỗi đồng vị N2110e, N2010e, N2210e có nguyên tử khối lần lượt là 21, 20, 22
- Nguyên tử trung bình của Ne là
ˉA=(1.21)+(9.22)+(90.20)100=20,19
Lời giải:
- Nguyên tử khối của các nguyên tố hóa học không phải là các trị số nguyên vì hầu hết các nguyên tố trong tự nhiên là hỗn hợp của nhiều đồng vị, mỗi đồng vị có tỉ lệ phần trăm số nguyên tử xác định. Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình của hỗn hợp các đồng vị của nguyên tố đó.
- Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng khác nhau số neutron.
Lý thuyết Nguyên tố hóa học
I. Nguyên tố hóa học
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số electron ở vỏ nguyên tử. Các electron trong nguyên tử quyết định tính chất hóa học của nguyên tử, nên các nguyên tử của cùng một nguyên tố hóa học có tính chất hóa học giống nhau.
Ví dụ 1: Tất cả nguyên tử có cùng số đơn vị điện tích hạt nhân là 6 đều thuộc nguyên tố carbon dù chúng có thể có số neutron khác nhau.
Ví dụ 2: Cho các nguyên tử sau: B (Z = 8, A = 16), D (Z = 7, A = 14), E (Z = 9, A = 19), F (Z = 8, A = 18).
Trong các nguyên tử trên, nguyên tử B và F thuộc cùng một nguyên tố hóa học vì có cùng số đơn vị điện tích hạt nhân (Z = 8).
II. Kí hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z) của nguyên tố đó) và số khối (A) là những đặc trưng cơ bản của một nguyên tử.
Khi viết kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở phía dưới và số khối A ở phía trên.
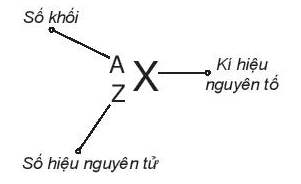
Ví dụ 1: Kí hiệu nguyên tử helium là H42e. Cho biết:
+ Nguyên tử helium có kí hiệu là He.
+ Số hiệu nguyên tử helium là Z = 2 = số proton = số electron.
+ Số khối của nguyên tử helium là A = 4.
A = Z + N → Số neutron = N = A – Z = 4 – 2 = 2.
Ví dụ 2: Nguyên tử nitrogen có 7 proton và 7 neutron.
Ta có:
+ Số hiệu nguyên tử Z = số proton = 7.
+ Số khối của nguyên tử nitrogen là A = Z + N = 7 + 7 = 14.
→Kí hiệu nguyên tử nitrogen là N147.
III. Đồng vị
Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
Ví dụ 1: Mô hình cấu tạo nguyên tử các đồng vị của nguyên tố hydrogen.
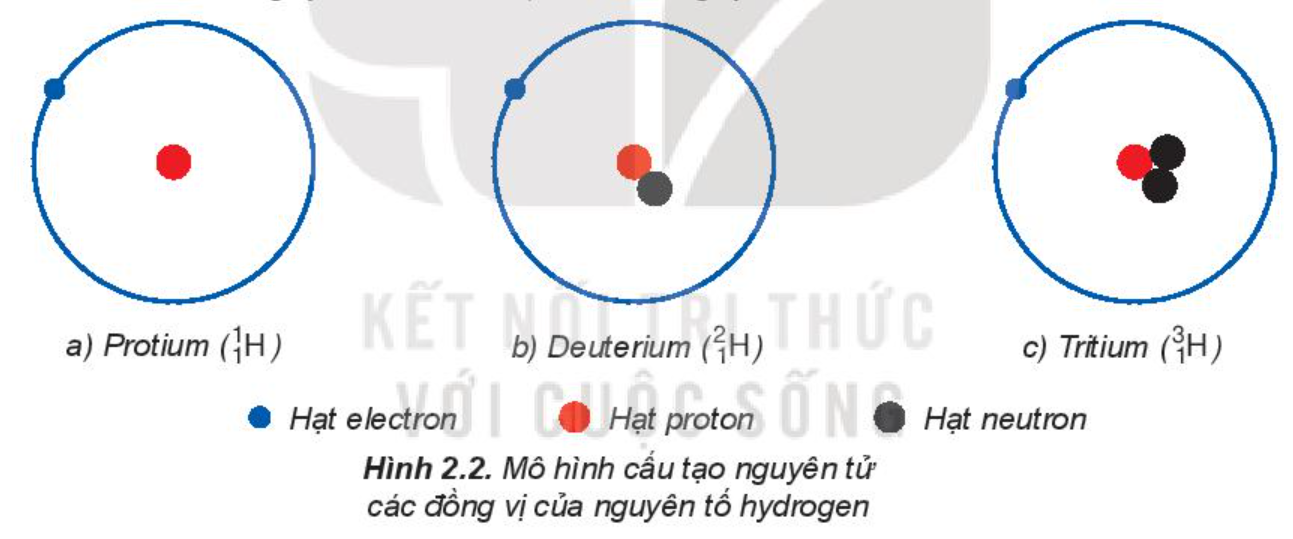 Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
Ví dụ 2: Ở dạng đơn chất, đồng vị C3717l có tỉ khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị C3517l.
IV. Nguyên tử khối
1. Nguyên tử khối
Nguyên tử khối là khối lượng của nguyên tử, cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử. Do khối lượng proton và neutron đều xấp xỉ 1,0 amu, còn khối lượng electron nhỏ hơn rất nhiều (0,00055 amu), nên có thể coi khối lượng nguyên tử xấp xỉ số khối.
Ví dụ: Nguyên tử của nguyên tố potassium có 19 proton và 20 neutron.
Nguyên tử khối của potassium là A = 19 + 20 = 39.
2. Nguyên tử khối trung bình
Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu ˉA) của hỗn hợp các đồng vị của nguyên tố đó.
Biểu thức tổng quát tính nguyên tử khối trung bình (ˉA): ˉA=(X.a)+(Y.b)+...100
Trong đó, ˉA là nguyên tử khối trung bình; X và Y, … lần lượt là nguyên tử khối của các đồng vị X và Y, …; a và b, … lần lượt là % số nguyên tử của các đồng vị X và Y, …
Ví dụ 1: Trong tự nhiên, nguyên tố chlorine có hai đồng vị bền là C3517l (chiếm 75,77%) và C3717l (chiếm 24,23% số nguyên tử).
Nguyên tử khối trung bình của chlorine:ˉA=(75,77.35)+(24,23.37)100=35,48 .
Ví dụ 2: Nguyên tử khối trung bình của copper bằng 63,546. Copper tồn tại trong tự nhiên dưới hai dạng đồng vị C6329u và C6529u . Tính phần trăm số nguyên tử của đồng vị C6329u tồn tại trong tự nhiên.
Hướng dẫn:
Gọi phần trăm số nguyên tử của đồng vị C6329u và C6529u lần lượt là x (%) và y (%).
Ta có: x + y = 100 (*).
Nguyên tử khối trung bình của copper: ˉA=63x+65y100=63,546 (**).
Từ (*) và (**), suy ra: x = 72,7 và y = 27,3.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Bài 7: Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
