Giải Hóa 10 Bài 1 (Kết nối tri thức): Thành phần của nguyên tử
Với giải bài tập Hóa 10 Bài 1: Thành phần của nguyên tử sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 1.
Giải bài tập Hóa lớp 10 Bài 1: Thành phần của nguyên tử
Video giải bài tập Hóa lớp 10 Bài 1: Thành phần của nguyên tử
Lời giải:
Nguyên tử gồm hạt nhân ở tâm (chứa proton mang điện tích dương và neutron không mang điện) và vỏ nguyên tử (chứa các electron mang điện tích âm)
- Lịch sử phát hiện ra hạt electron:
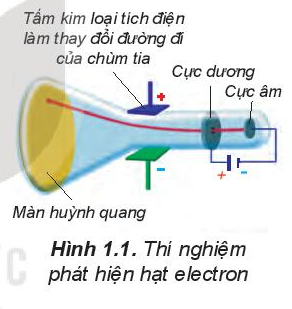
Năm 1897, J.J. Thomson (Tôm-xơn, người Anh) thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm và bị hút lệch về phía cực dương của điện trường, chứng tỏ chúng mang điện tích âm. Đó chính là chùm các hạt electron.
- Lịch sử phát hiện ra hạt nhân nguyên tử và hạt proton:
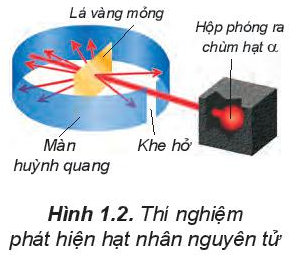
Năm 1911, E. Rutherford (Rơ-dơ-pho, người Niu Di-lân) thực hiện thí nghiệm bắn phá lá vàng rất mỏng bằng chùm hạt α (alpha). Ông sử dụng màn huỳnh quang bao quanh lá vàng để quan sát vị trí va chạm của hạt α. Kết quả thí nghiệm cho thấy hầu hết các hạt α đều xuyên thẳng qua lá vàng. Chứng tỏ nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương và có kích thước rất nhỏ so với kích thước nguyên tử.
Năng 1918, E Rutherford và các cộng sự khi dùng hạt α bắn phá nitrogen đã phát hiện ra hạt proton.
- Lịch sử phát hiện ra hạt neutron:
Năm 1932, J.Chadwick (chat-uých, người Anh), cộng sự của Rutherford, đã phát hiện ra hạt neutron khi bắn phá beryllium bằng các hạt α.
I. Các loại hạt cấu tạo nên nguyên tử
Câu hỏi 1 trang 14 Hóa học 10: Nguyên tử chứa những hạt mang điện là
Lời giải:
Đáp án đúng là: C
Hạt proton mang điện tích dương, hạt electron mang điện tích âm.
Hạt neutron không mang điện.
Lời giải:
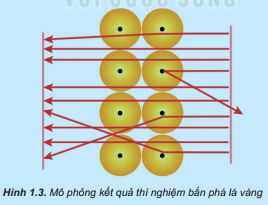
Nhận xét về đường đi của các hạt α:
+ Hầu hết các hạt α đều xuyên thẳng qua lá vàng một số ít hạt đi lệch hướng ban đầu và một số rất ít hạt bị bật lại phía sau khi gặp lá vàng.
+ Chứng tỏ nguyên tử có cấu tạo rỗng, ở tâm có một hạt nhân có kích thước rất nhỏ so với nguyên tử. Hạt nhân nguyên tử mang điện tích dương và có khối lượng lớn.
II. Kích thước và khối lượng của nguyên tử
Lời giải:
Ta có tỉ lệ: dntdhn=300,003=10 000dntdhn=300,003=10000
⇒ Kích thước của nguyên tử vàng lớn hơn gấp khoảng 10000 lần hạt nhân của nó.
a) Khối lượng hạt nhân với khối lượng nguyên tử.
b) Khối lượng hạt nhân với khối lượng vỏ nguyên tử.
Lời giải:
a) Khối lượng của hạt nhân nitrogen là
mhn=mp+mnmhn=mp+mn= 7.1,673.10-27 + 7.1,675.10-27 = 2,3436.10-26 (kg)
Nguyên tử trung hòa về điện ⇒ số hạt electron = số hạt proton = 7
Khối lượng nguyên tử nitrogen là
mnt=mhn+memnt=mhn+me= 2,3436.10-26 + 7.9,109.10-31 = 2,3442.10-26 (kg)
⇒ mhn ≈ mnt
b) Khối lượng của vỏ nguyên tử nitrogen là
me = 7.9,109.10-31 = 6,3763.10-30 (kg)
⇒ mhn ≫ me (khối lượng hạt nhân lớn hơn rất nhiều so với khối lượng vỏ nguyên tử).
III. Điện tích hạt nhân và số khối
Lời giải:
Hạt nhân của nguyên tử aluminium có điện tích bằng +13.
⇒ Số đơn vị điện tích hạt nhân (Z) = 13 = số proton = số electron.
Ta có:
Số khối A = số proton + số neutron
⇔ 27 = 13 + số neutron
⇔ Số neutron = 14
Em có thể trang 16 Hóa học 10: Vận dụng phương pháp mô hình để mô tả cấu tạo nguyên tử.
Lời giải:
Ví dụ: Mô hình nguyên tử Li như sau:
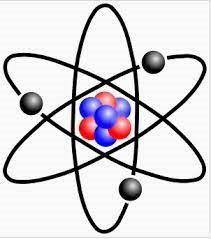
Với quả cầu màu đen là hạt electron, quả cầu màu xanh là hạt neutron, quả cầu màu đỏ là hạt proton.
Từ mô hình nguyên tử Li xác định được thành phần cấu tạo của nguyên tử Li:
+ Lớp vỏ gồm 3 electron.
+ Hạt nhân gồm 3 proton và 4 neutron.
Lý thuyết Thành phần của nguyên tử
I. Các loại hạt cấu tạo nên nguyên tử
Năm 1897, J. J. Thomson thực hiện thí nghiệm phóng điện qua không khí loãng đã phát hiện ra chùm tia phát ra từ cực âm và bị hút lệch về phía cực dương của điện trường, chứng tỏ chúng mang điện tích âm. Đó chính là chùm các hạt electron. Electron là một thành phần của nguyên tử.
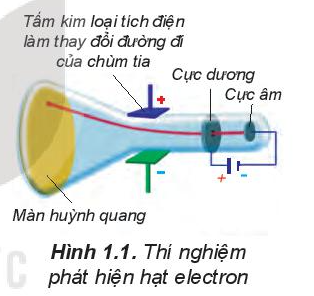
Năm 1911, E.Rutherford thực hiện thí nghiệm bắn phá lá vàng rất mỏng bằng chùm hạt a (alpha).
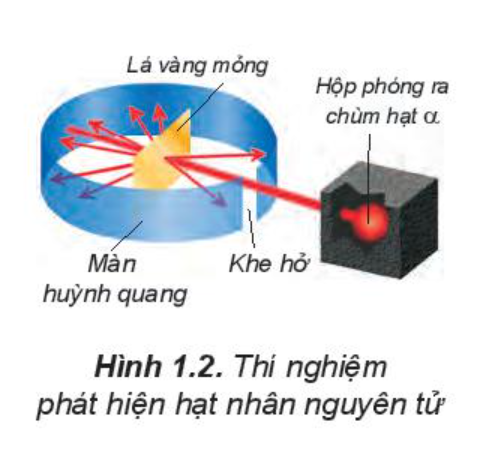
Kết quả thí nghiệm: hầu hết các hạt a đều xuyên thẳng qua lá vàng, chứng tỏ nguyên tử có cấu tạo rỗng, ở tâm chứa một hạt nhân mang điện tích dương và có kích thước rất nhỏ so với kích thước nguyên tử.
Năm 1918, E.Rutherford và các cộng sự khi dùng hạt a bắn phá nitrogen đã phát hiện ra hạt proton.
Năm 1932, J. Chadwick, cộng sự của Rutherford, đã phát hiện ra hạt neutron khi bắn phá berylium bằng các hạt a.
Kết luận:
Thành phần cấu tạo của nguyên tử gồm:
- Hạt nhân: ở tâm của nguyên tử, chứa các proton mang điện tích dương và các neutron không mang điện (trừ trường hợp H11).
- Vỏ nguyên tử: chứa các electron mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân.
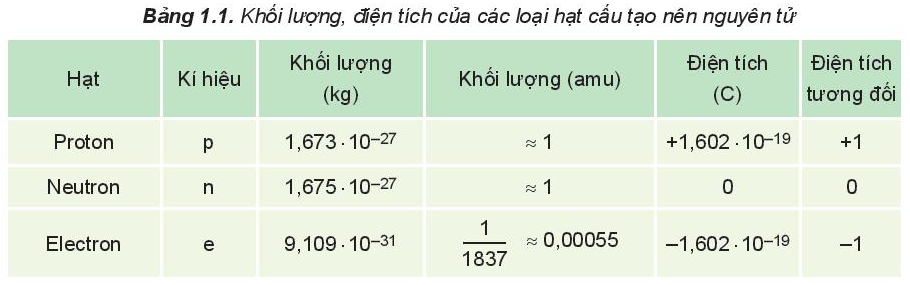
Khối lượng, điện tích của các loại hạt cấu tạo nên nguyên tử:
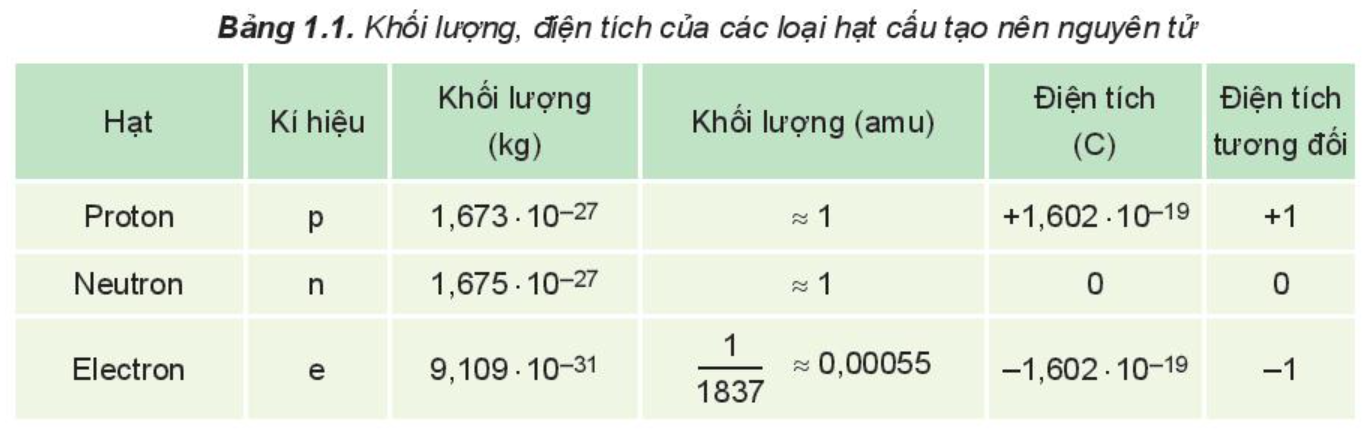
Trong nguyên tử, số proton bằng số electron. Nguyên tử trung hòa về điện.
Khối lượng của electron rất nhỏ, không đáng kể so với khối lượng của proton hay neutron nên khối lượng của nguyên tử tập trung hầu hết ở hạt nhân.
II. Kích thước và khối lượng của nguyên tử
1. Kích thước
Kích thước của nguyên tử rất nhỏ nên thường được biểu diễn bằng đơn vị picomet (pm) hay Angstrom (oA).
1 pm = 10-12 m; 1oA = 10-10 m
Hạt nhân nguyên tử có kích thước vô cùng nhỏ so với nguyên tử.
2. Khối lượng
Khối lượng nguyên tử bằng tổng khối lượng các hạt proton, neutron và electron có trong nguyên tử.
Có thể biểu thị khối lượng nguyên tử theo đơn vị khối lượng nguyên tử, kí hiệu amu.
1 amu = 1,661×10-27 kg
Ví dụ: Một nguyên tử oxygen có khối lượng là 2,656×10-26 kg.
1 amu = 1,661×10-27 kg nên khối lượng của một nguyên tử oxygen là: 2,656×10−261,661×10−27=15,990(amu).
III. Điện tích hạt nhân và số khối
- Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử Na có 11 proton nên số đơn vị điện tích hạt nhân là Z = 11.
- Tổng số proton và tổng số neutron (kí hiệu là N) trong hạt nhân của một nguyên tử được gọi là số khối (hay số nucleon), kí hiệu là A.
A = Z + N
Ví dụ: Hạt nhân nguyên tử Na có 11 proton và 12 neutron.
Số khối của hạt nhân nguyên tử Na là: A = 11 + 12 = 23.
Xem thêm lời giải bài tập Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 3: Cấu trúc lớp vỏ electron nguyên tử
Bài 5: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Xem thêm tài liệu Hóa học lớp 10 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
