Lý thuyết Liên kết hydrogen và tương tác van der waals – Hóa 10 Kết nối tri thức
Tóm tắt lý thuyết Hóa học 10 Bài 13: Liên kết hydrogen và tương tác van der waals ngắn gọn, chi tiết sách Kết nối tri thức sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học lớp 10.
Lý thuyết Hóa học 10 Bài 13: Liên kết hydrogen và tương tác van der waals
A. Lý thuyết Liên kết hydrogen và tương tác van der waals
I. Mở đầu
Các tính chất vật lí của các chất có liên kết cộng hóa trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng của phân tử và mức độ phân cực của liên kết cộng hóa trị trong phân tử.
Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hóa trị hay liên kết kim loại. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals (Van đơ Van).
II. Liên kết hydrogen
1. Bản chất của liên kết hydrogen
Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
Ví dụ:
 Một số kiểu tạo thành liên kết hydrogen:
Một số kiểu tạo thành liên kết hydrogen:
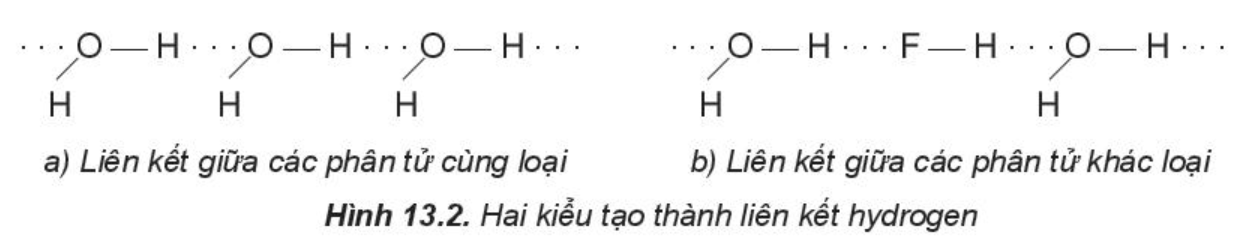
Chú ý:
- Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N …
+ Nguyên tử F, O, N, … liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
2. Vai trò và ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
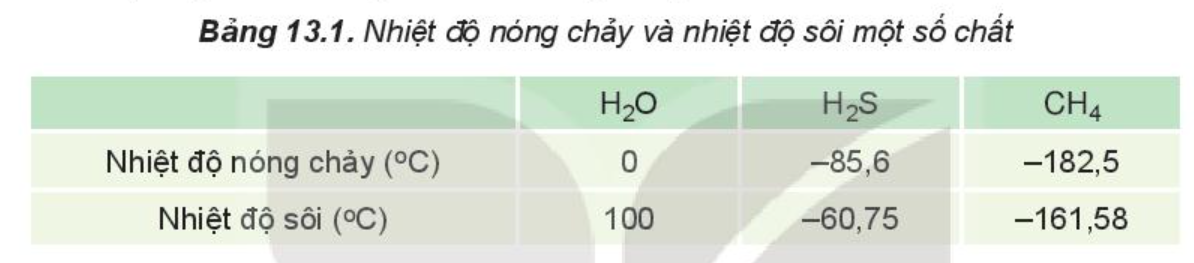
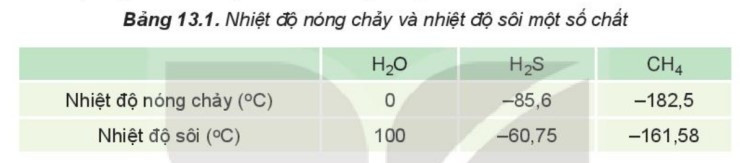
Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
Ví dụ: Do ảnh hưởng của liên kết hydrogen nên nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4.
III. Tương tác van der Waals
1. Khái niệm tương tác van der Waals
Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Ví dụ:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
2. Ảnh hưởng của tương tác van der Waals đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
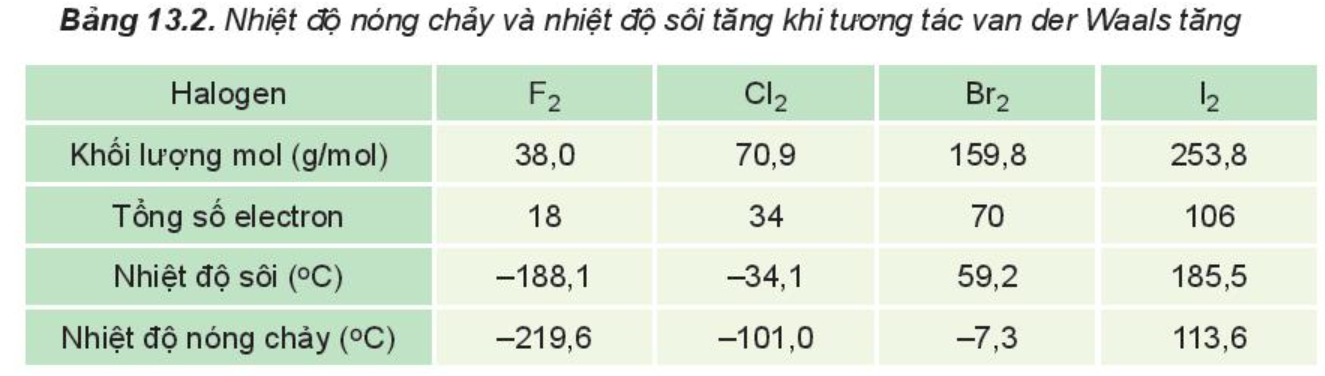
Ví dụ 1: Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
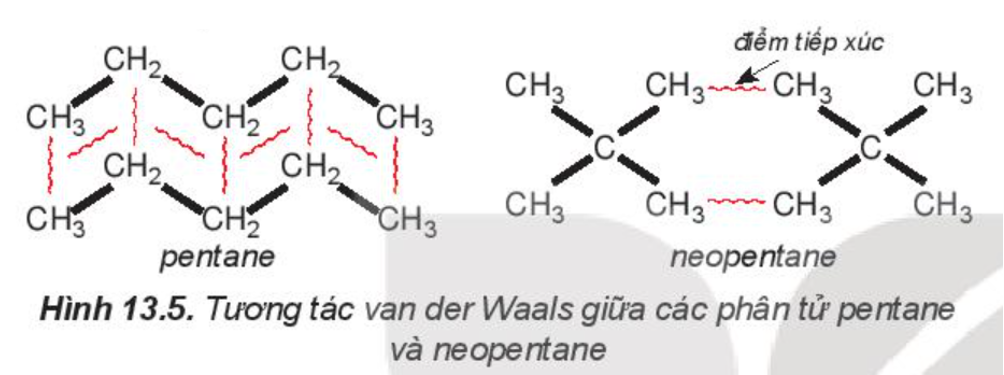
Ví dụ 2: Pentane là hydrocarbon no có công thức C5H12. Đồng phân mạch không phân nhánh pentane có nhiệt độ sôi (36oC) cao hơn so với đồng phân mạch nhánh neopentane (9,5oC) do diện tích tiếp xúc giữa các phân tử pentane lớn hơn nhiều so với neopentane.
B. Trắc nghiệm Liên kết hydrogen và tương tác van der waals
Câu 1. So với lực kiên kết ion, liên kết cộng hóa trị hay liên kết kim loại thì tương tác giữa các phân tử
A. mạnh hơn rất nhiều.
B. yếu hơn rất nhiều.
C. không khác nhiều.
D. giống hoàn toàn.
Đáp án: B
Giải thích:
Lực tương tác giữa các phân tử yếu hơn rất nhiều so với lực liên kết ion, liên kết cộng hóa trị hay liên kết kim loại. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals (Van đơ Van).
Câu 2. Phát biểu nào sau đây không đúng?
A. Keo dán là một ví dụ về việc sử dụng lực tương tác giữa các phân tử để gắn các vật với nhau.
B. Bong bóng xà phòng thể hiện tương tác giữa các phân tử nước và các phân tử xà phòng tạo thành màng mỏng, giữ được không khí bên trong để bay lên.
C. Các tính chất vật lí của các chất có liên kết cộng hóa trị chỉ phụ thuộc vào mức độ phân cực của liên kết cộng hóa trị trong phân tử.
D. Một số tương tác điển hình giữa các phân tử là liên kết hydrogen và tương tác van der Waals (Van đơ Van).
Đáp án: C
Giải thích:
Các tính chất vật lí của các chất có liên kết cộng hóa trị được quyết định bởi lực tương tác giữa các phân tử, hình dạng của phân tử và mức độ phân cực của liên kết cộng hóa trị trong phân tử.
Câu 3. Liên kết hydrogen được hình thành giữa
A. nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn).
B. nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện nhỏ) còn cặp electron hóa trị chưa tham gia liên kết.
C. nguyên tử H (đã liên kết với một nguyên tử có độ âm điện nhỏ) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
D. nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
Đáp án: D
Giải thích:
Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
Câu 4. Liên kết hydrogen thường biểu diễn bằng
A. dấu gạch đơn (–)
B. dấu gạch đôi (=).
C. mũi tên một chiều (®).
D. dấu ba chấm (…).
Đáp án: D
Giải thích:
Liên kết hydrogen thường biểu diễn bằng dấu ba chấm (…).
Ví dụ:

Câu 5. Chọn phát biểu đúng. Điều kiện để tạo thành liên kết hydrogen là
A. Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn (như F, O, N, …) và các nguyên tử này phải có ít nhất một cặp electron hóa trị chưa liên kết.
B. Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn (như F, O, N, …).
C. Nguyên tử hydrogen liên kết với các nguyên tử còn ít nhất một cặp electron hóa trị chưa liên kết.
D. Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện nhỏ và các nguyên tử này phải có ít nhất một cặp electron hóa trị chưa liên kết.
Đáp án: A
Giải thích:
Điều kiện cần và đủ để tạo thành liên kết hydrogen:
+ Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn (như F, O, N, …).
+ Nguyên tử F, O, N, … liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết.
Câu 6. Liên kết hydrogen
A. làm tăng nhiệt độ nóng chảy và làm giảm nhiệt độ sôi của nước.
B. làm giảm nhiệt độ nóng chảy và làm tăng nhiệt độ sôi của nước.
C. làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
D. làm giảm nhiệt độ nóng chảy, nhiệt độ sôi của nước.
Đáp án: C
Giải thích:
Liên kết hydrogen làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của nước.
Ví dụ: Do ảnh hưởng của liên kết hydrogen nên nhiệt độ nóng chảy và nhiệt độ sôi của H2O cao hơn nhiều so với H2S và CH4.
Câu 7. Tương tác van der Waals là
A. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
B. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
C. nhiệt lượng cần cung cấp cho một phản ứng hóa học.
D. nhiệt lượng tỏa ra trong một phản ứng hóa học.
Đáp án: A
Giải thích:
Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
Câu 8. Cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng. Đó là do
A. phân tử bromine có khối lượng lớn hơn.
B. ở trạng thái lỏng, giữa các phân tử bromine tồn tại một tương tác yếu, đó là tương tác van der Waals.
C. ở trạng thái lỏng, giữa các phân tử bromine tồn tại một tương tác yếu, đó là liên kết hydrogen.
D. phân tử bromine có kích thước lớn hơn.
Đáp án: B
Giải thích:
Cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng. Như vậy, ở trạng thái lỏng, giữa các phân tử bromine tồn tại một tương tác yếu. Tương tác yếu đó gọi là tương tác van der Waals.
Câu 9. Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Đó là do
A. nguyên tử khí hiếm có cấu hình electron bền vững.
B. nguyên tử khí hiếm khó tham gia vào các phản ứng hóa học.
C. ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng.
D. ở nhiệt độ thấp, giữa các nguyên tử khí hiếm có thể liên kết với nhau bằng liên kết hydrogen.
Đáp án: C
Giải thích:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng. Như vậy, ở nhiệt độ thấp, giữa các nguyên tử khí hiếm tồn tại một tương tác yếu để giữ các nguyên tử khí hiếm lại với nhau trong trạng thái lỏng. Tương tác đó cũng là tương tác van der Waals.
Câu 10. Tương tác van der Waals làm
A. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
B. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
C. thay đổi liên kết hóa học trong một số chất.
D. tăng kích thước của các chất.
Đáp án: A
Giải thích:
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
Câu 11. Trong dãy halogen, đi từ F2 đến I2:
A. nhiệt độ nóng chảy và nhiệt độ sôi giảm dần.
B. nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
C. nhiệt độ nóng chảy tăng dần; nhiệt độ sôi giảm dần.
D. nhiệt độ nóng chảy giảm dần; nhiệt độ sôi tăng dần.
Đáp án: A
Giải thích:
Trong dãy halogen, tương tác van der Waals tăng theo sự tăng của số electron (và proton) trong phân tử, làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 14: Ôn tập chương 3
Lý thuyết Bài 15: Phản ứng oxi hóa - khử
Lý thuyết Bài 16: Ôn tập chương 4
Lý thuyết Bài 17: Biến thiên enthalpy trong các phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
