Lý thuyết Quy tắc octet – Hóa 10 Kết nối tri thức
Tóm tắt lý thuyết Hóa học 10 Bài 10: Quy tắc octet ngắn gọn, chi tiết sách Kết nối tri thức sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học lớp 10.
Lý thuyết Hóa học 10 Bài 10: Quy tắc octet
A. Lý thuyết Quy tắc octet
I. Khái niệm liên kết hóa học
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Ví dụ:
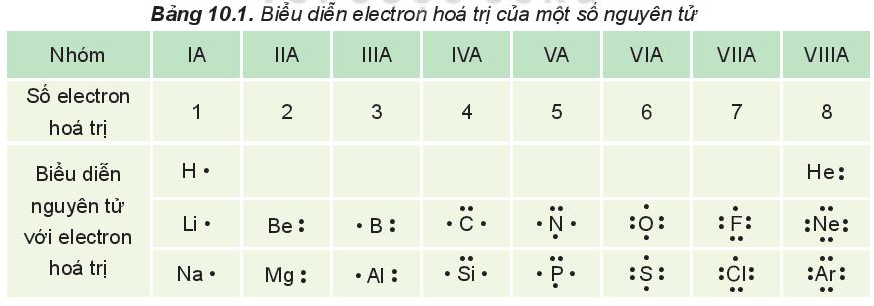
II. Quy tắc octet
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Ví dụ 1: Xét sự hình thành liên kết hóa học trong phân tử Cl2.
Cấu hình electron của nguyên tử Cl (Z = 17): [Ne]3s23p5.
Khi hình thành liên kết hóa học trong phân tử Cl2, nguyên tử Cl có 7 electron hóa trị, mỗi nguyên tử Cl cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử Cl góp chung 1 electron.
Phân tử Cl2 được biểu diễn:

Xung quanh mỗi nguyên tử Cl đều có 8 electron.
Ví dụ 2: Xét sự hình thành liên kết hóa học trong phân tử NaF.
Cấu hình electron của nguyên tử:
Na (Z = 11): [Ne]3s1 có 1 electron lớp ngoài cùng.
F (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng.
Khi hình thành liên kết hóa học trong phân tử NaF, nguyên tử Na có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị, nguyên tử Na nhường 1 electron hóa trị tạo thành hạt mang điện tích dương, nguyên tử F nhận 1 electron tạo thành hạt mang điện tích âm. Các hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau.
B. Trắc nghiệm Quy tắc octet
Câu 1. Theo thuyết cấu tạo hóa học, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng
A. sự giảm năng lượng khi các nguyên tử kết hợp lại với nhau.
B. sự tăng năng lượng khi các nguyên tử kết hợp lại với nhau.
C. sự giảm bán kính nguyên tử khi các nguyên tử kết hợp lại với nhau.
D. sự tăng bán kính nguyên tử khi các nguyên tử kết hợp lại với nhau.
Đáp án: A
Giải thích:
Theo thuyết cấu tạo hóa học, sự liên kết giữa các nguyên tử tạo thành phân tử hay tinh thể được giải thích bằng sự giảm năng lượng khi các nguyên tử kết hợp lại với nhau.
Câu 2. Khi tạo liên kết hóa học thì nguyên tử có xu hướng
A. đạt tới cấu hình electron bền vững của khí hiếm He.
B. đạt tới cấu hình electron bền vững của khí hiếm.
C. nhường electron để tạo thành ion dương.
D. nhận electron để tạo thành ion âm.
Đáp án: B
Giải thích:
Khi tạo liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm.
Câu 3. Liên kết hóa học là
A. là sự kết hợp giữa hai nguyên tử phi kim để tạo thành phân tử bền vững hơn.
B. là sự trao đổi electron giữa các nguyên tử tạo thành phân tử.
C. sự kết hợp giữa các nguyên tử tạo thành ion đa nguyên tử.
D. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Đáp án: D
Giải thích:
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 4. Trong các phản ứng hóa học, các electron nào tham gia vào quá trình tạo thành liên kết?
A. chỉ có các electron thuộc phân lớp s.
B. chỉ có các electron thuộc phân lớp p.
C. chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát ngoài cùng.
D. chỉ có các electron thuộc lớp trong cùng.
Đáp án: C
Giải thích:
Trong các phản ứng hóa học, chỉ có các electron thuộc lớp ngoài cùng và phân lớp sát lớp ngoài cùng tham gia vào quá trình tạo thành liên kết.
Câu 5. Nguyên tử Mg có 2 electron hóa trị, được biểu diễn là
A. –Mg–
B. Mg=
C. Mg :
D. : Mg
Đáp án: C
Giải thích:
Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.
Nguyên tử Mg có 2 electron hóa trị. Biểu diễn như sau: Mg
Câu 6. Nguyên tố aluminium thuộc nhóm IIIA. Số electron hóa trị của nguyên tử nguyên tố aluminium là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: C
Giải thích:
Số electron hóa trị = Số thứ tự nhóm A = 3.
Nguyên tử aluminium có 3 electron hóa trị.
Câu 7. Nguyên tử chlorine có Z = 17. Số electron hóa trị của nguyên tử chlorine là
A. 3.
B. 5.
C. 6.
D. 7.
Đáp án: D
Giải thích:
Cấu hình electron của nguyên tử chlorine (Z = 17): 1s22s22p63s23p5.
Electron cuối cùng điền vào phần lớp p Chlorine thuộc nhóm A.
Số electron hóa trị = Số electron lớp ngoài cùng = 7.
Câu 8. Khi nguyên tử oxygen nhận thêm 2 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
A. Carbon.
B. Neon.
C. Sodium.
D. Argon.
Đáp án: B
Giải thích:
Nguyên tử oxygen có Z = 8 = Số proton = Số electron.
Nguyên tử oxygen nhận thêm 2 electron để tạo thành ion có 10 electron có cấu hình giống nguyên tử nguyên tố khí hiếm Argon (Ar): 1s22s22p6.
Câu 9. Nguyên tử Na nhường đi 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố nào?
A. Oxygen.
B. Carbon.
C. Magnesium.
D. Neon.
Đáp án: D
Giải thích:
Nguyên tử Na có Z = 11 = Số proton = Số electron.
Nguyên tử Na nhường 1 electron để tạo thành ion có 10 electron có cấu hình giống nguyên tử nguyên tố khí hiếm Argon (Ar): 1s22s22p6.
Câu 10. Quy tắc octet:
A. Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
B. Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron của nguyên tử chlorine.
C. Khi hình thành liên kết hóa học, các nguyên tử có xu hướng vừa nhường, vừa nhận electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.
D. Khi hình thành liên kết hóa học, các nguyên tử có xu hướng vừa nhường, vừa nhận electron để đạt tới cấu hình electron của nguyên tử chlorine.
Đáp án: A
Giải thích:
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Vì các khí hiếm (trừ helium) đều có 8 electron lớp ngoài cùng nên quy tắc này được gọi là quy tắc octet.
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 11: Liên kết ion
Lý thuyết Bài 12: Liên kết cộng hóa trị
Lý thuyết Bài 13: Liên kết hydrogen và tương tác van der waals
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Soạn văn lớp 10 (ngắn nhất) – Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn lớp 10 - KNTT
- Bố cục tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Kết nối tri thức
- Văn mẫu lớp 10 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 10 – Kết nối tri thức
- Giải sgk Toán 10 – Kết nối tri thức
- Giải sbt Toán 10 – Kết nối tri thức
- Giải Chuyên đề Toán 10 – Kết nối tri thức
- Lý thuyết Toán 10 – Kết nối tri thức
- Chuyên đề dạy thêm Toán 10 Kết nối tri thức (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Global Success – Kết nối tri thức
- Giải sbt Tiếng Anh 10 Global Success – Kết nối tri thức
- Ngữ pháp Tiếng Anh 10 Global success
- Bài tập Tiếng Anh 10 Global success theo Unit có đáp án
- Trọn bộ Từ vựng Tiếng Anh 10 Global success đầy đủ nhất
- Giải sgk Vật lí 10 – Kết nối tri thức
- Giải sbt Vật lí 10 – Kết nối tri thức
- Giải Chuyên đề Vật lí 10 – Kết nối tri thức
- Lý thuyết Vật lí 10 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 10 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 10 – Kết nối tri thức
- Giải sbt Sinh học 10 – Kết nối tri thức
- Lý thuyết Sinh học 10 – Kết nối tri thức
- Giải Chuyên đề Sinh học 10 – Kết nối tri thức
- Giải sgk Lịch sử 10 – Kết nối tri thức
- Giải sbt Lịch sử 10 – Kết nối tri thức
- Giải Chuyên đề Lịch sử 10 – Kết nối tri thức
- Lý thuyết Lịch sử 10 - Kết nối tri thức
- Giải sgk Địa lí 10 – Kết nối tri thức
- Lý thuyết Địa Lí 10 – Kết nối tri thức
- Giải sbt Địa lí 10 – Kết nối tri thức
- Giải Chuyên đề Địa lí 10 – Kết nối tri thức
- Giải sgk Công nghệ 10 – Kết nối tri thức
- Lý thuyết Công nghệ 10 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Kết nối tri thức
- Giải Chuyên đề Kinh tế và pháp luật 10 – Kết nối tri thức
- Lý thuyết KTPL 10 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 10 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sbt Hoạt động trải nghiệm 10 – Kết nối tri thức
- Giải sgk Tin học 10 – Kết nối tri thức
- Lý thuyết Tin học 10 – Kết nối tri thức
- Giải sbt Tin học 10 – Kết nối tri thức
- Giải Chuyên đề Tin học 10 – Kết nối tri thức
- Giải sgk Giáo dục thể chất 10 – Kết nối tri thức
